基于高通量测序技术分析微冻凡纳滨对虾的微生物
陶飞燕 ,潘 创,陈胜军,胡 晓,邓建朝,李春生,荣 辉,王悦齐
(1. 上海海洋大学食品学院,上海 201306; 2. 中国水产科学研究院南海水产研究所/农业农村部水产品加工重点实验室/国家水产品加工技术研发中心,广东 广州 510300)
凡纳滨对虾 (Litopenaeus vannamei) 是养殖产量最高的三大虾品种之一[1]。根据《2020中国渔业统计年鉴》[2]数据,凡纳滨对虾产量占海水养殖虾的78.91%和淡水养殖虾的21.29%。其味道鲜美,营养丰富,含人体必需氨基酸及钙 (Ca)、铁 (Fe)、锌 (Zn) 等矿物元素[3],是一种兼具营养价值与经济价值的高蛋白营养水产品,近年来国内外对其需求逐渐上升[4]。然而,对虾在贮藏和流通过程中,品质容易劣变,其表面附着的微生物是造成其变质的最根本因素。受生长环境、加工工艺、产品特征等因素的影响,凡纳滨对虾会形成自身独有的菌相,数量及种类繁多[5-7]。在对虾失去活力后,那些适合生存的微生物会利用虾体内丰富的营养物质进行生长繁殖,产生腐败气味,加速腐败进程,严重影响产品的货架期。因此对凡纳滨对虾进行菌相研究,找出贮藏过程中的优势微生物对控制其品质具有重要意义。
对水产品微生物的研究以往多通过对菌株进行富集培养和分离纯化,再根据形态、生理、生化等实验得出结果,但结果往往不能完全反映样品中微生物种类的真实情况[8]。近年来,随着科技的进步,以DNA为基础的宏基因组学技术取得较大进展。以高通量测序为主的宏基因组学技术是一种非培养分析法,无需对菌株进行培养,而是直接从样品中提取出细菌的总DNA进行分析,能检测到难以培养或不能培养的微生物[9]。与传统培养法相比,宏基因组学技术能更完整地反映样品中的微生物,达到鉴定微生物单一基因或全基因组的目的,且能同时对多个样品进行分析,具有快速、高效等优点[10-12]。如今高通量测序技术已成功应用于多个领域,在各种水产品如牡蛎、小龙虾上均有所应用[13-14]。目前关于凡纳滨对虾在冷藏、冰温过程中的菌相变化已有报道[15-17],但是关于微冻贮藏以及凡纳滨对虾不同形态下表面微生物变化的研究还鲜有报道。本实验以微冻的整虾、去头尾虾和虾仁为研究对象,采用Illumina HiSeq高通量测序技术分析不同贮藏时期的样品微生物组成,进一步了解凡纳滨对虾在微冻贮藏期间的菌群变化规律,揭示其腐败机理,为其贮藏保鲜研究提供重要参考依据。
1 材料与方法
1.1 材料、试剂与仪器
活凡纳滨对虾 (平均体长13.0 cm) 购于广东省广州市华润万家超市,于5~10 min内快速运至实验室进行处理。
SQ510C全自动高压蒸汽灭菌器 (日本Yamato公司);Sigma-3K30高速冷冻离心机 (德国Sigma公司);SW-CJ-1FD超净工作台 (苏州净化设备有限公司);THZ-C台式恒温振荡器 (太仓华美生化仪器厂);IN612C低温恒温培养箱 (日本Yamato公司);Hiseq PE250测序仪 (美国Illumina公司);Agilent 2 100生物分析仪 (美国Agilent科技公司);实时荧光定量PCR仪 (美国Bio-Rad公司)。
1.2 实验方法
1.2.1 分组与预处理 将凡纳滨对虾分成3组:完整对虾、去头尾虾和虾仁。每组设置3个平行组,于微冻 (−3 ℃) 环境下贮藏4周至完全腐败。根据预实验结果以1周为取样时间间隔,分别在第0、第1、第2、第3和第4周取样,进行表面微生物提取及测序。
1.2.2 虾体表面微生物提取 在无菌操作环境下,将5组样品及其平行组分别加入盛有无菌生理盐水的无菌三角瓶中,室温条件下在恒温振荡器中以300 r·min−1提取60 min,将虾体表面微生物提取到无菌生理盐水中。用无菌生理盐水淋洗样品3次,连同三角瓶中的液体一起转移至灭菌后的离心管中,以 12 000 r·min−1离心 15 min,所获得的菌液沉淀物于−80 ℃冰箱中贮藏,用于微生物菌落分析[18]。
1.2.3 DNA提取与PCR扩增 对虾体的菌液沉淀物进行表面微生物的基因组DNA提取,通过1%琼脂糖凝胶电泳测试样品的完整性。取质量合格的基因组DNA 30 ng,采用引物515F (5'-GTGCCAGCMGCCGCGGTAA-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3')对凡纳滨对虾菌体的16S rDNA基因V4可变区进行PCR扩增。PCR反应体系为:合格DNA 30 ng,PCR Primer Cocktail 4 μL,PCR Master Mix 25 μL,ddH2O 补充至总体积50 μL。PCR的反应条件设置为:98 ℃预变性3 min,30个循环 (98 ℃变性45 s,55 ℃退火45 s,72 ℃ 延伸 45 s);72 °C 终延伸 7 min。将扩增后的产物用AmpureXPbeads (AGENCOURT) 纯化,溶于洗脱缓冲液中,贴上标签,完成建库。使用Agilent 2 100生物分析仪对文库的片段范围及浓度进行检测,对检测合格的文库,根据插入的片段大小,选择HiSeq平台进行测序 (由深圳华大基因有限公司协助完成)[19]。
1.2.4 Illumina HiSeq测序数据处理及分析 将下机数据进行过滤,滤除低质量的数据(Reads),将剩余的高质量数据用于后期分析。通过软件FLASH(Fast length adjustment of short reads, ver. 1.2.11),利用reads之间的重叠关系将reads拼接成序列(Tags)。利用软件Usearch (ver. 7.0.109 0) 将拼接好的Tags在97%的序列相似度下聚类成操作分类单元(Operational taxonomic unit, OTU)。根据聚类分析结果,计算得到赵氏指数 (Chao)、艾斯指数(ACE)、香农指数 (Shannon)和辛普森指数 (Simpson),进行Alpha多样性分析。其中,Chao和ACE指数用来表征样品菌群丰富度,指数越大,丰富度越高。Shannon和Simpson指数表示菌群多样性,Shannon指数越大,Simpson指数越小,多样性越高[18,20]。通过RDP classifer (ver. 2.2) 软件将OTU代表序列与Greengene数据库比对,进行物种注释,利用物种柱状图直观展示各样品的物种组成及比例,以及通过热图来反映样品菌群组成的相似性和差异性等,分析不同贮藏时期的整虾、去头尾虾和虾仁的菌群结构和变化规律。
2 结果与分析
2.1 微生物数量分析
采用Illumina HiSeq高通量测序对微冻条件下的凡纳滨对虾整虾、去头尾虾和虾仁3组样品进行分析,通过拼接、过滤等对得到的原始数据序列进行处理。样品测序覆盖率作为测序准确性的指标,反映了测序结果能否代表样品中微生物的真实情况。数值越高,样品序列测出概率越高,测序结果越准确[21-22]。3组对虾样品的测序覆盖率均超过0.998 (表1),说明此次测序深度适合,数据可信,可进行样品的微生物多样性分析[23]。

表1 不同形式凡纳滨对虾的测序覆盖率和操作分类单元数量Table 1 Coverage and OTU number of L. vannamei with different forms
根据各处理组在97%序列相似水平下的OTU生物信息统计,绘制了凡纳滨对虾的韦恩图 (图1)。整虾、去头尾虾和虾仁3组样品的共有微生物达348种,而整虾与去头尾虾之间共同微生物有461种,高出整虾与虾仁70种,说明整虾与去头尾虾的物种相似度更高。由凡纳滨对虾虾仁、去头尾虾和整虾的OTU数量变化 (表1) 可知,随贮藏时间延长,各组的OTU数量呈下降趋势。其中,虾仁的OTU数量在4周内从最初的281降至31,去头尾虾从281降至54,而整虾则是从316降至59。由以上结果可知,整虾表面微生物种类相对更多,其次是去头尾虾,最后是虾仁。凡纳滨对虾在去头尾和去壳过程中明显减少了部分微生物,且随着微冻贮藏时间的延长,各组对虾表面微生物减少的趋势表明低温对部分微生物的生长产生了抑制作用,该结果与邓晓影等[10]对凡纳滨对虾微生物群落的研究结果一致。

图1 不同形式凡纳滨对虾的韦恩图R. 虾仁样品;Q. 去头尾虾样品;Z. 整虾样品;后图同此Figure 1 Venn diagram of L. vannamei with different formsR. Shrimp samples; Q. Decapitated shrimp samples;Z. Whole shrimp samples; the same below.
2.2 物种多样性分析
Alpha多样性常用于评价样品中微生物菌群的丰富度和个体分配均匀性,以丰富度指数(Chao、ACE) 和多样性指数 (Shannon、Simpson) 为代表[24]。表2和表3反映了此次测序中凡纳滨对虾样品的Alpha多样性指数的变化趋势。与新鲜的0周样品相比,4周后的虾仁、去头尾虾和整虾的Chao和ACE指数均明显减小 (表2),说明对虾表面的微生物种类随贮藏时间的延长而减少,丰富度下降。其中,虾仁中Chao和ACE指数整体低于其他两组,说明虾仁的去头尾去壳制备过程对其表面的附着微生物组成具有较大影响,该结果与样品的OTU数量分析结果一致。相比于虾仁的持续下降趋势,去头尾虾和整虾的丰富度指数在微冻贮藏中期先增长后下降,可能是因为贮藏过程中优势腐败菌属繁殖使微生物数量增加,而繁殖产生的不良代谢物影响了其他菌种生长使多样性降低。其次,微冻环境抑制部分微生物的生长使对虾中微生物结构发生显著性变化[9]。各组凡纳滨对虾在贮藏期间Shannon指数下降和Simpson指数升高的趋势(表3),验证了对虾表面微生物的多样性在贮藏期间逐渐降低的结论。这与曹荣等[8]对冷藏牡蛎微生物种类的研究结果较为相似,均表明在低温贮藏过程中水产品中的微生物种类趋于简化。

表2 不同形式凡纳滨对虾的Alpha丰富度指数表Table 2 Alpha abundance indices of L. vannamei with different forms

表3 不同形式凡纳滨对虾的Alpha多样性指数表Table 3 Alpha diversity indices of L. vannamei with different forms
稀释曲线由测序数量及其对应的OTU数量构建,可直接反映测序数量的合理性,并可通过物种变化趋势间接评估样品中的微生物物种丰度[19,25]。当样品测序数超过70 000时,其稀释曲线趋于平缓 (图2-a),表明测序数量较合理,基本已覆盖到样品中的所有物种[26]。随着测序数量的增加,Alpha多样性的各指数稀释曲线基本趋于平缓 (图2-b、2-c、2-d、2-e),验证了测序的合理性,即测序数量已包含绝大多数微生物信息,足够充分。

图2 不同形式凡纳滨对虾多样性指数的稀释曲线Figure 2 Rarefaction curves of Alpha diversity indices of L. vannamei with different forms
2.3 不同分类水平上的物种注释及分析
为获得物种分类信息,使用Greengene数据库对3组样品序列进行物种注释分析,并分别在目和属水平上对微冻贮藏不同阶段的样品统计群落组成,选择0周鲜样、贮藏中期第2周和贮藏末期第4周的数据作物种柱状图 (图3和图4)。在目分类水平上 (图3),新鲜虾仁的表面微生物主要是弧菌目、交替单胞菌目、气单胞菌目和立克次氏体目,占菌群总量的88.52%。去头尾虾的主要菌群有弧菌目、交替单胞菌目、弯曲菌目和气单胞菌目,总量占83.27%。其中,弧菌目丰度最高(40.62%),交替单胞菌目次之 (20.34%)。弧菌目也是整虾的优势菌种,其丰度占总菌群的23.29%,其次为交替单胞菌目 (20.41%)、黄杆菌目 (17.31%)、弯曲菌目 (10.13%) 和假单胞菌目 (8.84%)。有研究发现,新鲜牡蛎的优势菌群也是弧菌目和交替单胞菌目[19],与本实验结果相似。对比3组样品的微生物组成,整虾中黄杆菌目 (17.31%)、假单胞菌目(8.84%) 的相对丰度明显高于去头尾虾 (5.49%,3.48%) 和虾仁 (2.13%, 4.14%),而弧菌目和气单胞菌目丰度则远低于其他两组。贮藏2周后,整虾、去头尾虾和虾仁中的假单胞菌目相对丰度分别增至47.24%、29.77%和41.36%。研究表明,假单胞菌目为典型的嗜冷菌,可分解蛋白等大分子,产生氨臭味,是水产品低温贮藏的主要腐败菌[27]。此外,弧菌目明显减少,可见该菌种低温耐受性差,不能完全适应微冻环境。除假单胞菌目外,交替单胞菌目的比例也在增加,虾仁中占比达41.61%,成为贮藏第2周的优势菌种,而在去头尾虾中的相对丰度为21.61%,在整虾中仅4.08%。推测此菌种也是致腐菌种之一,且对低温的耐受性很好。在去头尾虾和整虾样品中,红细菌目占有一定比例,分别为23.25%和14.16%,推测该菌种可能较多的分布于虾壳表面,因此虾仁在剥壳过程中丰度显著下降。和虾仁的物种组成相比,去头尾虾和整虾表现出来的菌种多样性更高。微冻4周后,假单胞菌目和交替单胞菌目在整虾、去头尾虾和虾仁中的比例总和分别为95.30%、96.96%和96.92% (图3-c),成为贮藏末期的绝对优势腐败菌,使凡纳滨对虾在贮藏中产生强烈的腐败气味从而不能被消费者所接受。

图3 不同形式对虾样品微生物物种组成 (目水平)数字0、2、4分别表示贮藏0周、2周和4周;后图同此Figure 3 Bacterial community composition at order level of L. vannamei with different formsThe number 0, 2 and 4 indicate the storage time of 0 week,2 weeks and 4 weeks. The same below.

图4 不同形式对虾样品微生物物种组成 (属水平)Figure 4 Bacterial community composition at genus level of L. vannamei with different forms
在属水平上 (图4),新鲜虾仁表面附着微生物主要为弧菌属 (47.49%),其他菌种比例相对较高(33.47%),希瓦氏菌属占比10.55%。在新鲜去头尾虾中,除弧菌属 (34.68%) 和其他菌种 (35.85%)外,比例最大的是弓形菌属 (12.12%) 和希瓦氏菌属 (7.14%)。其他菌种 (34.55%)、弧菌属 (17.57%)、黄杆菌属 (14.77%)、弓形菌属 (10.13%) 和希瓦氏菌属 (9.45%) 构成了新鲜整虾的主要微生物。弓形菌属大比例存在于去头尾虾和整虾中,虾仁中比例较少 (图4-a),由此推测该菌属可能附着在虾壳表面生长。微冻贮藏2周后,虾仁中希瓦氏菌属和假单胞菌属比例大幅增加,分别为41.42%和46.58%。去头尾虾中的菌种也逐渐丰富起来,假红杆菌属(20.74%)、不动杆菌属 (18.26%)、希瓦氏菌属(11.83%)、嗜冷杆菌属 (6.35%) 和其他菌种(25.14%) 均为相对丰度较高的菌群。整虾中的菌相组成类似于去头尾虾,嗜冷杆菌属、弓形菌属和黄杆菌属比例更高,分别达29.28%、12.80%和12.81%。而假红杆菌属、不动杆菌属的相对丰度较低,菌种比例分别为6.52%和8.91%。微冻4周后,各组样品的菌相组成均逐渐变得单一。虾仁样品中占据主要地位的菌属主要为假单胞菌属 (55.50%)和希瓦氏菌属 (41.14%)。去头尾虾的优势菌属为假单胞菌属 (65.87%)、希瓦氏菌属 (21.90%) 和部分嗜冷杆菌属 (9.09%)。整虾中除假单胞菌属 (52.07%)和嗜冷杆菌属 (18.01%) 外,假交替单胞菌属具有一定比例,占总菌群量的25.08%。由菌种变化趋势 (图4) 可知,微冻温度可大幅减少对虾样品中的微生物种类,但仍然存在假单胞菌属、希瓦氏菌属等几种典型的嗜冷菌属,随贮藏时间的延长比例有所增加。田凤和王玲[28]对腐败的凡纳滨对虾分离优势菌群,同样得到假单胞菌和希瓦氏菌所占的比例较高的结论。因此可以推测假单胞菌属和希瓦氏菌属是凡纳滨对虾的主要腐败菌,代谢力强,能适应低温环境,是造成高蛋白水产品腐败的主要原因。然而,研究发现冷藏条件下青虾 (Macrobrachium nipponense) 的优势菌群主要是不动杆菌、黄杆菌和希瓦氏菌[29];冷藏克氏原螯虾 (Procambarus clarkii) 的优势腐败菌为希瓦氏菌属、肉食杆菌属、嗜冷杆菌属等[14];冷藏小黄鱼 (Larimichthys polyactis) 在腐败末期的微生物以希瓦氏菌属、变形杆菌属和普罗威斯登菌属等为主[30]。可见优势腐败菌因水产品种类不同而有所差异。
2.4 物种组成热图与关键物种差异
热图是数据的一种二维呈现,将高低丰度物种分块聚集,通过颜色梯度直观表现数据大小,反映各样本之间的微生物组成的相似性和差异性[31]。图5为整虾、去头尾虾和虾仁在属水平上的物种丰度热图。由横向聚类分析发现,去头尾虾和整虾聚为一类,虾仁单独一类,说明虾仁中的微生物种类及组成与其他两组样品差异较大。从相对丰度来看,3组样品中的希瓦氏菌属和假单胞菌属较其他菌种相对丰度更高,嗜冷菌属、假交替单胞菌属、黄杆菌属等在整虾中丰度最高,弧菌属在虾仁中比例最大。由此可见,虾仁的制备过程是弧菌属污染样品的主要阶段,可能会对虾产品的质量安全造成隐患[10]。通过颜色梯度看,各组样品的微生物组成中整虾物种种类最为丰富,其次为去头尾虾,最后是虾仁,这表明在去头尾去壳过程中部分微生物减少,该结果与凡纳滨对虾样品物种组成分析结果一致。
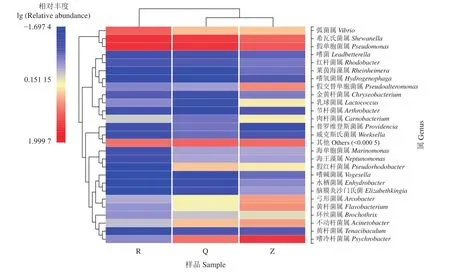
图5 不同形式对虾样品微生物丰度聚类热图 (属水平)同一行中颜色深浅表示该微生物在不同样品中的丰度差异;图上方进化树表明样本间的相似程度;图左方进化树表明微生物间的相似程度Figure 5 Microbial community heatmap analysis at genus level of L. vannamei with different formsThe shade of color in the same row indicates the difference in the abundance of the microorganism in different samples; the evolutionary tree on the top of the figure indicates the degree of similarity between samples; the evolutionary tree on the left of the figure indicates the degree of similarity between microorganisms.
虾仁中相对丰度较高的菌种为假单胞菌属、希瓦氏菌属和弧菌属,除此之外,其他菌种丰度均不足1%。去头尾虾中菌种比例最大的是假单胞菌属和希瓦氏菌属,均超过25%。另外,除假交替单胞菌属和肉杆菌属的丰度低于1%,其余菌种均占有一定的比例。而整虾的主要微生物有嗜冷菌属、假单胞菌属和希瓦氏菌属,其余菌群相对丰度均高于1%,各占一定比例 (表4)。此结果同样表明去头尾虾和整虾中的菌群丰富度较虾仁更高,较好地验证了上述热图和物种组成分析的结果。

表4 不同形式对虾样品关键物种差异 (属水平)Table 4 Key species differences at genus level of L. vannamei with different forms %
3 结论
本实验以高通量测序技术为核心,全面反映了微冻贮藏环境下凡纳滨对虾虾仁、去头尾虾和整虾的微生物组成。结果表明,整虾、虾仁和去头尾虾这3种形态的虾在微冻环境下的菌种比例差异明显。其中,在属水平上,新鲜虾仁主要包括弧菌属、希瓦氏菌属和其他菌属,去头尾虾中主要为弧菌属、弓形菌属等,整虾中主要为弧菌属、黄杆菌属等。经过4周的微冻贮藏后,凡纳滨对虾样品存在严重的腐败、黑变现象以及产生了强烈的不良气味,而此时假单胞菌属、希瓦氏菌属和嗜冷菌属在各组样品的微生物组成中占据主导地位。因此以上菌属对凡纳滨对虾的品质劣变起关键作用,在后续研究中应重点关注以保障对虾产品的质量。其次,红细菌目、弓形菌属等微生物主要存在于虾壳表面,在整虾和去头尾虾中占有很大比例,同样应对此种特殊分布的菌种加以关注并进行控制。另外,将新鲜样品与微冻2周和4周的样品进行对比,微生物的种类从丰富逐渐变得单一,可见微冻温度对微生物的生长有一定的抑制作用。
综上所述,虽然凡纳滨对虾整虾、去头尾虾和虾仁的优势腐败菌种类差异不明显,但其在不同贮藏时期的菌群组成、菌种丰度、菌种对微冻环境的耐受性等却有较大的差别。因此,今后在凡纳滨对虾的贮运流通过程中,可采用保鲜剂、抑菌剂、减菌化处理等手段结合低温环境对优势腐败菌种进行针对性抑制,从而延缓产品的鲜度下降及品质劣变现象,延长对虾货架期,满足消费者需求。

