RSV诱导哮喘小鼠树突细胞自噬机制及五虎汤的干预作用
张鑫 王孟清 罗银河 胡燕 丁伊 江智豪
〔摘要〕 目的 研究PI3K/Akt/mTOR信號通路对呼吸道合胞病毒(respiratory syncytial virus, RSV)诱导哮喘小鼠树突细胞(dendritic cells, DC)自噬的调控机制及五虎汤的干预作用。方法 用RSV滴鼻联合雾化鸡卵清蛋白(ovalbumin, OVA)激发的方法制备哮喘小鼠模型,造模后的小鼠分为模型组、五虎汤低剂量组、五虎汤中剂量组、五虎汤高剂量组、地塞米松组、雷帕霉素组、氯喹组,每组10只,并设空白组(10只)对照。实验结束后PAS、Masson染色观察评价肺组织病变情况,并计算气道黏液储备指数与胶原沉积指数;电镜观察自噬小体;Western blot检测DC自噬相关蛋白及对PI3K/Akt/mTOR信号通路中关键蛋白PI3K、p-Akt、p-mTOR表达的影响。结果 气道反应性结果显示造模成功。病理染色显示模型组小鼠气道黏液储备指数与胶原沉积指数较空白组显著增高,差异有统计学意义(P<0.01);与模型组相比,五虎汤各剂量组及其他药物组哮喘小鼠气道黏液储备指数与胶原沉积指数降低,差异有统计学意义(P<0.01)。电镜下观察小鼠肺组织自噬小体显示模型组相较于空白组中自噬小体数量明显增加,各治疗组的自噬小体较模型组增加。Western blot显示,自噬蛋白LC3Ⅱ/LC3Ⅰ在五虎汤各剂量组以及雷帕霉素组中的表达显著增高,与模型组相比差异有统计学意义(P<0.01);氯喹组LC3Ⅱ/LC3Ⅰ水平较模型组降低(P<0.01);地塞米松组与模型组比较,LC3Ⅱ/LC3Ⅰ水平相对表达无统计学差异(P>0.05);通路关键蛋白表达水平显示,五虎汤各剂量组及雷帕霉素组中PI3K、p-Akt和p-mTOR的蛋白表达水平与模型组相比明显降低,差异有统计学意义(P<0.01,P<0.05)。结论 RSV诱导哮喘小鼠树突细胞自噬水平上升,PI3K/Akt/mTOR信号通路被活化,五虎汤通过抑制PI3K/Akt/mTOR信号通路,进一步上调树突细胞的自噬,减轻气道重塑。
〔关键词〕 儿童哮喘;五虎汤;呼吸道合胞病毒;树突细胞;细胞自噬;PI3K/Akt/mTOR
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.01.008
〔Abstract〕 Objective To study the regulation mechanism of PI3K / Akt / mTOR signaling pathway on RSV-induced autophagy of dendritic cells in asthmatic mice and the intervention effect of Wuhu Decoction. Methods The mouse model of asthma was established by RSV nasal drop combined with ovalbumin (OVA) atomization. After modeling, mice were divided into the model group, the Wu-hu Decoction low-dose group, the Wu-hu Decoction medium-dose group, the Wu-hu Decoction high-dose group, the dexamethasone group, the rapamycin group and the chloroquine group, with 10 mice in each group, and a blank group (10 mice). After the end of the experiment, PAS staining and Masson staining were used to observe and evaluate the pathological changes of lung tissue, and the airway mucus reserve index and collagen deposition index were calculated; autophagy was observed by electron microscopy; Western blot was used to detected the autophagy-related proteins of DC and their effects on the expression of PI3K, p-Akt, and p-mTOR in the PI3K / Akt / mTOR signaling pathway. Results The airway reactivity results showed that the model was successful; pathological staining showed that the airway mucus reserve index and collagen deposition index of mice in the model group were significantly higher than the blank group, and the difference was statistically significant (P<0.01); compared with the model group, the airway mucus reserve index and collagen deposition index of asthma mice in Wu-hu Decoction each dose groups and other drug groups decreased, with statistical significance (P<0.01). Observation of autophagosomes in mouse lung tissue under electron microscope showed that the number of autophagosomes in the model group was significantly increased compared with the blank group, and the autophagosomes in each treatment group increased compared with the model group. Western blot showed that the autophagy protein LC3Ⅱ / LC3Ⅰin Wu-hu Decoction each dose groups and the rapamycin group were significantly higher than the model group, with statistical significance (P<0.01); the LC3Ⅱ / LC3Ⅰlevel of the chloroquine group was lower than the model group (P<0.01); there was no significant difference in the relative expression of LC3Ⅱ / LC3Ⅰbetween the dexamethasone group and the model group (P>0.05); the key proteins expression levels of pathway showed that the protein expressions of PI3K, p-Akt and p-mTOR in Wu-hu Decoction dose groups and rapamycin group were significantly lower than the model group, and the difference was statistically significant (P<0.01, P<0.05). Conclusion The autophagy level of DC cells in RSV-induced asthma mice increased, and the PI3K / Akt / mTOR signaling pathway was activated. Wuhu Decoction inhibited the PI3K / Akt / mTOR signaling pathway to further up-regulate DC cell autophagy and reduce airway remodeling.
〔Keywords〕 childhood asthma; Wu-hu Decoction; respiratory syncytial virus; dendritic cells; cell autophagy; PI3K / Akt / mTOR
哮喘是最常见的儿童慢性呼吸道疾病,全球范围内患病人数呈逐年上升的趋势[1],儿童哮喘与呼吸道合胞病毒(respiratory syncytial virus, RSV)感染有密切的关系,大部分儿童哮喘患者起源于RSV的感染[2]。RSV感染人体后首先被抗原提呈细胞摄取,进而诱发机体的免疫反应。树突细胞(dendritic
cells, DC)是最重要的一种抗原提呈细胞[3]。细胞自噬是细胞利用溶酶体降解自身物质以适应生存环境的过程,病毒感染会诱发DC的自噬[4]。研究表明自噬会影响DC的抗原提呈功能,而DC自噬功能的紊乱是哮喘重要的发病机制[5-6]。中药复方五虎汤是治疗儿童哮喘的名方,对病毒诱发的哮喘有很好的疗效,前期临床实验证实,五虎汤可通过婴幼儿哮喘的DC细胞,影响T细胞因子IL-4、IL-5的分泌[7],前期动物实验亦证实,五虎汤可通过干预RSV诱导的DC自噬对哮喘小鼠的气道反应性、炎性因子的分泌产生影响[8-9],但其具体的分子机制不明。本研究旨在通过动物实验进一步验证疗效,探明其分子机制。
1 材料
1.1 动物
90只SPF级雌性BALB/c小鼠,6~8周龄,体质量18~20 g,购自湖南斯莱克景达公司,动物资格证书编号:SCXK(湖南)2016-0002。小鼠在12 h∶12 h光暗交替的环境中分笼饲养,可自由饮水和进食,以标准普通饲料喂养,实验在湖南中医药大学动物实验中心进行,许可证号:SYXK(湘)2019-0004,本研究中实验动物经湖南中医药大学第一附属医院动物伦理委员会批准同意,批准号:20180810-02。
1.2 药物与试剂
五虎汤(组成:生石膏9.0 g、生甘草2.4 g、杏仁6.0 g、麻黄2.4 g、细茶叶4.8 g),每瓶100 mL,含生药24.6 g,由湖南中医药大学第一附属医院药剂科制备;地塞米松(美国Sigma公司,批号D1756);雷帕霉素(美国Selleckchem,批号S1039);氯喹(美国 Selleckchem,批号C193834);RSV Long株由武汉大学医学部病毒学研究所提供;鸡卵清蛋白、Masson、PAS染色液(上海Solarbio公司,批号9006-59-1、G1285);氯化乙酰胆碱(美国Selleck公司,批号2260-50-6);Lung Dissociation Kit(mouse)、CD11c Micro Beads Ultra Pure(mouse)、AutoMACS Running Buffer(德国美天旎生物公司,批号130-095-927、130-108-3381、130-091-221);LC3 I、LC3 Ⅱ兔抗多克隆抗体(美国Cell Signaling Technology公司,批号4599S、3868S;PI3K、p-Akt、p-mTOR(美国CST 公司,批号4249S、S4060S、5536S);β-actin鼠单抗(美国Immunoway公司,批号YM3028)。
1.3 主要仪器
S888E超声雾化器(南京道芬电子有限公司);DHX-50小动物呼吸机与WESTERN BLOTP气道阻力和肺顺应性分析软件(美国BUXCO公司);HT7700透射电子显微镜(日立高新技术公司);台式离心机(金坛市大地自动化仪器厂)。
2 方法
2.1 RSV诱发哮喘小鼠模型建立
将90只SPF级雌性BALB/c小鼠编号,随机数字表法选取15只为空白组,剩余小鼠为造模组。参照课题组前期研究文献的造模方法[8-10],实验前2 d,造模组小鼠分别鼻腔滴入滴度为2.4×106 PFU的RSV,每只0.05 mL,同时腹腔注射1% OVA以致敏,0.25 mL/只,空白组给予等容积Hep-2细胞滴鼻,同时皮下注射等容积的生理盐水。自实验第9日起,于上午9:00将造模组小鼠放入自制的雾化箱中,以10 mL浓度为1% OVA雾化激发,空白组给予同样体积的生理盐水,每次30 min,隔天1次,持续2周。
2.2 气道反应性检测验证造模是否成功
从空白组和造模组小鼠中分别随机抽取5只进行气道反应性测定,验证造模是否成功。小鼠末次给药后24 h,麻醉后切开气管,进行气管插管后,把小鼠放入体描箱中,连接呼吸机,调整呼吸机参数,频率为75次/min,潮气量为8 mL/kg,记录初始的气道压力、流速以及潮气量变化,待小鼠气道压力平稳后,雾化吸入0.1 mL不同濃度的乙酰胆碱(0、6.25、12.5、25、50 mg/mL),每次吸入乙酰胆碱后,收集吸入后5 s到1 min的数据,并用软件计算出最大肺阻力。
2.3 动物分组及给药
选取造模成功的小鼠70只,随机分成模型组、五虎汤低剂量组、五虎汤中剂量组、五虎汤高剂量组、阳性对照组(地塞米松组)以及自噬诱导组(雷帕霉素组)、自噬抑制剂组(氯喹组)每组各10只,并选取空白组10只进行对照。小鼠按体表面积折算,临床等效关系拟定五虎汤中剂量组灌胃3.2 g/kg,0.5倍等效剂量五虎汤低剂量组灌胃1.6 g/kg,2倍等效剂量五虎汤高剂组灌胃6.4g/kg,并腹腔注射等容积的生理盐水;地塞米松组腹腔注射地塞米松1.82 mg/kg,并以等容积生理盐水灌胃;雷帕霉素组腹腔注射雷帕霉素1 mg/kg,并灌胃等容积生理盐水;氯喹组腹腔注射氯喹60 mg/kg,并灌胃等容积生理盐水;空白组及模型组灌胃并腹腔注射等容积生理盐水,每日1次,连续给药14 d。
2.4 肺组织病理染色
PAS染色步骤如下:肺组织切片后用二甲苯脱蜡,再用乙醇洗去二甲苯,随后分别用95%、85%、75%的乙醇进行水化,再用Weigert铁苏木素液染色5 min,水洗,以阿利新蓝染色液染色10~20 min,再放入氧化剂中进行氧化5 min,再放入Schiff Reagent浸染10 min,苏木素染色液染核1~2min,再用Scott蓝化液返蓝,水洗3 min,行脱水、透明、封片处理后镜检,Masson染色步骤如下:脱蜡、水化与PAS染色相同,用蓝化液返蓝5 min,丽春红品红染色液染色5 min再用磷钼酸溶液洗2 min,苯胺蓝染色液中染色1 min,再进行脱水、透明、封片处理后镜检。用ImagePro Plus 6.0系统对PAS、Masson染色的结果进行统计分析,计算气道胶原沉积指数与黏液储备情况,每组图片重复计算3次。
2.5 透射电镜观察肺组织自噬体
实验结束后取肺组织,用2.5%的戊二醛、磷酸盐浓度为0.22 mmol/L缓冲液固定4 h左右,0.1 mol/L磷酸漂洗10~15 min,重复3次,再以1%锇酸后固定2 h,逐级乙醇脱水、环氧树脂包埋,30 ℃烘箱过夜后再用60 ℃烘箱内烘12 h,切成厚度为50~100 nm的薄片,最后用醋酸铀以及硝酸铅双染色后在透射电镜下进行肺组织自噬体检查。
2.6 CD11c磁珠分选法分离肺组织树突细胞
取肺组织及气道组织,用外科剪充分剪碎,加入胶原酶IV后在37 ℃下孵育45 min,再碾磨、过滤、加红细胞裂解液制成肺单细胞悬液,Percoll液 4 ℃梯度离心30 min,采用300×g离心细胞悬液10 min,完全吸出上清液,每1×108细胞加入100 μL CD11c磁珠,充分混合后在冰箱中避光孵育10 min,随后再加入缓冲液,离心10 min,吸出上清液,测定细胞数目,500 μL缓冲液重悬。随即将色谱柱置于MACS分离器磁场中,用3 mL适量缓冲液冲洗LS色谱柱后,将细胞悬浮液注入柱中,待液体净,用适缓冲液洗涤柱子3次,取出色谱柱并将其放在合适的收集管上。移取5 mL缓冲液到色谱柱后,随即将柱塞推入柱中,冲刷出磁性标记细胞,即获得所需的树突细胞。
2.7 Western blot检测自噬相关蛋白LC3 I、LC3 II及PI3K/Akt/mTOR 信号通路关键蛋白表达
从分离的DC中提取总蛋白,采用BCA法测定蛋白浓度,每组称取50 μg的总蛋白,按照1∶4的比例加入SDS上样缓冲液,在沸水浴中加热5 min,在预制胶孔中加入样本,然后进行SDS-PAGE电泳转膜,用5%的牛奶封闭1 h,分别加入LC3 I(稀释比1∶2 000)、LC3 II(稀释比例1∶1 000)、兔抗多克隆抗体和内参β-actin(稀释比例1∶5 000),进行孵育,用8% SDS-PAGE从每组取40 μg的总蛋白,特定的一抗PI3K(稀释比例1∶1 000)、p-Akt(稀释比例1∶1 000)、p-mTOR(稀释比例1∶2 000)兔抗多克隆抗体和内参β-actin(稀释比例1∶5 000)孵育过夜,用TBST洗涤10 min,共3次,用过氧化物酶标记二抗后加入,室温与膜孵育1 h,再次洗涤。凝胶成像系统曝光成像,扫描后用quantity one灰度分析软件进行光密度计算,以被检测的蛋白条带灰度值/β-actin灰度值作为目的蛋白的相对表达水平。
2.8 统计方法
实验数据采用SPSS 25.0软件进行统计分析,数据结果采用“x±s”表示。两组数据比较,满足正态性和方差齐性,用配对t检验,多组比较满足正态性和方差齐性的计量资料采用完全随机设计资料的方差分析,其中,各组间两两比较采用LSD法,方差不齐者用Dunett's T3检验,不满足正态性用秩和檢验,P<0.05表示差异具有统计学意义,P<0.01表明差异有显著统计学意义。
3 结果
3.1 两组小鼠气道阻力比较
不同浓度的乙酰胆碱(0、6.25、12.5、25、50 mg/mL)激发小鼠气道阻力显示,造模组小鼠均比空白组小鼠的气道阻力明显增高(P<0.01),说明造模成功。见表1。
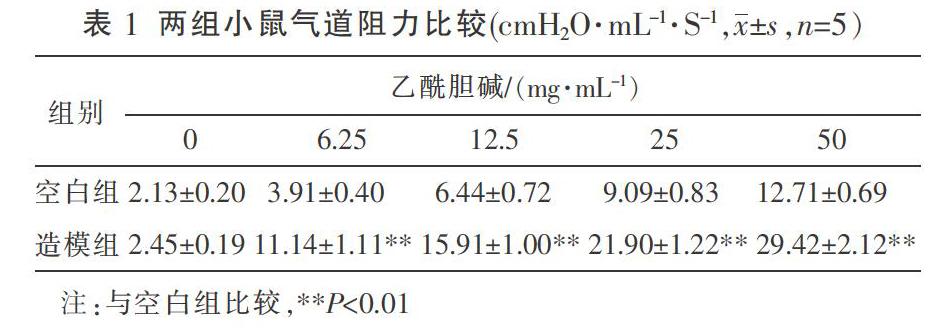
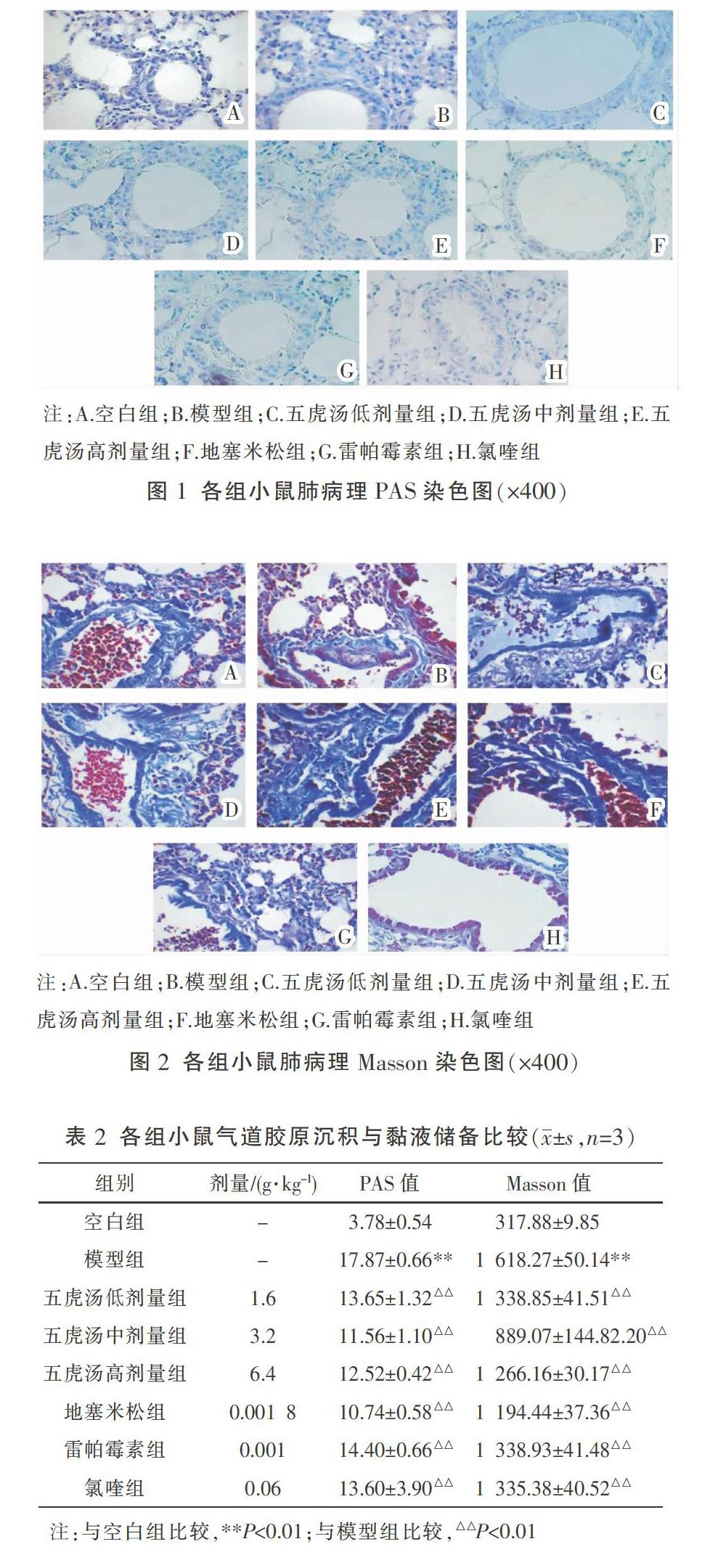
3.2 各组哮喘小鼠肺组织PAS、Masson染色情况比较
PAS染色结果如图1所示,相较于空白组,模型组管腔内杯状细胞与黏液分泌较多,五虎汤组与地塞米松组、雷帕霉素组、氯喹组治疗后,视野内的杯状细胞与黏液分泌减少;软件定量分析PAS染色红染阳性区域,与模型组相比,五虎汤各剂量组及其他药物组均可降低哮喘小鼠气道黏液储备指数(P<0.01)。Masson染色结果如图2所示,模型组小鼠与空白组相比气道壁则增厚;与模型组比较,五虎汤组、地塞米松组、雷帕霉素组及氯喹组气道壁厚度均有不同程度的减轻。软件定量分析Masson染色蓝染阳性区域测定气道胶原沉积指数,与模型组相比,五虎汤组、地塞米松组、雷帕霉素组及氯喹组均可显著降低哮喘小鼠气道胶原沉积指数(P<0.01)。见表2。
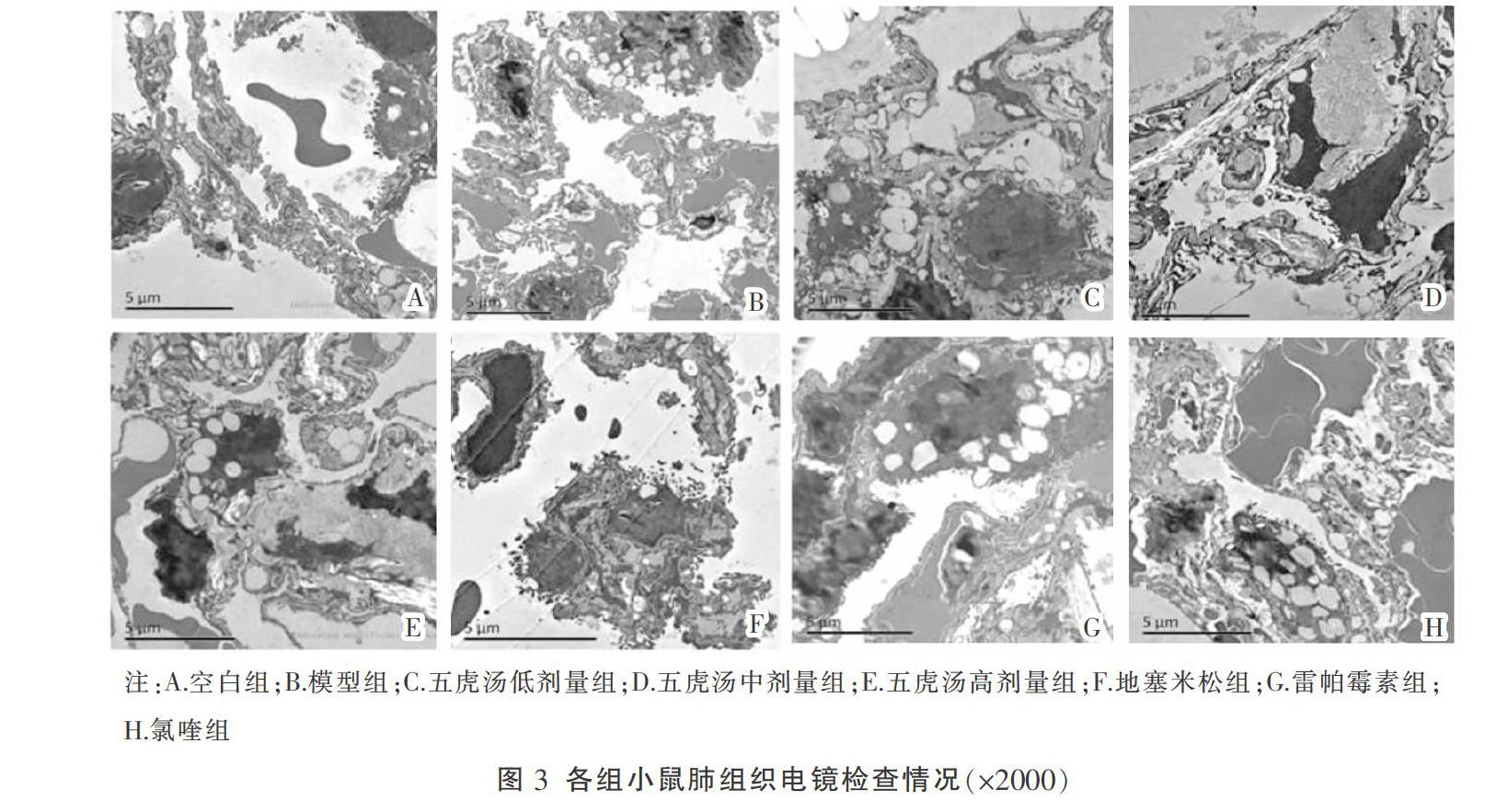
3.3 各组小鼠电镜检查情况比较
在透射电镜下观察比较各组小鼠肺组织自噬小体,模型组相较于空白组中自噬小体数量明显增加;与模型组相比,五虎汤各剂量组雷帕霉素及氯喹的自噬小体增加。见图3。
3.4 各组小鼠自噬相关蛋白表达情况
Western blot检测各组自噬相关蛋白LC3 I、LC3 Ⅱ如图4所示,模型组与空白组比较LC3Ⅱ/LC3Ⅰ比值明显升高,差异有统计学意义(P<0.01)。与模型组比较,五虎汤低、中、高剂量组与雷帕霉素组LC3Ⅱ/LC3Ⅰ水平升高,差异有统计学意义(P<0.01);氯喹组LC3Ⅱ/
LC3Ⅰ水平降低(P<0.01);地塞米松组LC3Ⅱ/LC3Ⅰ水平相对表达的差异无统计学差异(P>0.05)。见表3。
3.5 各组小鼠PI3K/Akt/mTOR信号通路关键蛋白的表达
模型组PI3K、p-Akt、p-mTOR的水平较空白组显著上升,差异有统计学意义(P<0.01)。与模型组相比,五虎汤各剂量组与地塞米松组、雷帕霉素组均可降低PI3K、p-Akt和p-mTOR的蛋白表达水平,差异具有统计学意义(P<0.05)。氯喹组的PI3K、p-Akt表达水平与模型组相比,差异无统计学意义(P>0.05)。见表4和图5。
4 讨论
RSV感染是儿童哮喘的重要诱因[11],DC被认为是RSV作用人体的始动因子,RSV作用人体后被DC摄取、抗原提呈,导致T细胞免疫失衡,使哮喘发作[3]。细胞自噬是细胞利用溶酶体降解自身物质以适应生存环境的过程,病毒感染会诱发机体细胞的自噬[5]。研究表明自噬可以影响DC的抗原提呈功能[12]。DC自噬功能的紊乱或失调可能是哮喘重要的发病机制[5]。
五虎汤是治疗小儿喘证的名方,全方由麻黄、杏仁、石膏、甘草、细茶5味药物组成,功效为清肺平喘。临床上对病毒性性哮喘有很好的疗效。本次实验采用RSV滴鼻联合OVA雾化的方法构建病毒性哮喘小鼠动物模型,对五虎汤治疗病毒诱发哮喘的疗效及分子机制进行研究。实验结果显示,相较于空白组,模型组小鼠肺组织病理切片呈现炎性细胞浸润、气道杯状上皮数量增加、气道上皮胶原沉积,提示模型小鼠气道中存在炎症、气道高反应,并且气管壁发生了气道重塑,经五虎汤干预后各项指标改善,表明五虎汤对RSV诱导的哮喘小鼠有保护作用。在透射电镜下观察到,空白组小鼠的肺组织中未见自噬小体,而模型组中的自噬小体明显增加,经五虎汤、雷帕霉素、氯喹干预后肺组织中自噬小体数量继续增加。根据文献中的报道,自噬小体数量增加并不代表自噬水平一定增加,有可能因自噬溶酶体部分降解受阻引起的自噬小体堆积[13]。因此,我们对小鼠肺DC的自噬的蛋白LC3Ⅱ/LC3Ⅰ水平进行检测,结果显示五虎汤各剂量组与雷帕霉素组中LC3Ⅱ/
LC3Ⅰ水平增高,而氯喹组LC3Ⅱ/LC3Ⅰ水平降低,提示五虎汤可上调RSV感染后的DC自噬水平,而氯喹通过干扰自噬溶酶体的降解而抑制自噬。
PI3K/Akt/mTOR信号通路可以负向调节细胞自噬[14]。该通路主要由PI3K、Akt、mTOR 3个作用分子组成,其中的PI3K参与细胞自噬的启动,激活下游的蛋白[15-16]。Akt是一种蛋白激酶,被激活后发生磷酸化,发挥自噬信号传递、自噬体运动、囊泡融合作用[17]。哺乳动物雷帕霉素靶蛋白(mammalian target
of rapamycin, mTOR)是细胞自噬、增殖的调节因子,上游的p-Akt可以使mTOR磷酸化,从而使其活性增强,自噬受到抑制[18]。一些研究[19-20]表明PI3K/Akt/mTOR信号通路调控的自噬可使细胞纤维化,在呼吸道表现为气道壁的增厚及僵硬,并最终引起气道的重塑。实验结果表明,抑制该通路的雷帕霉素,可以减轻气道重塑,与文献[21]报道相一致。同时,也有研究表明,PI3K/Akt/mTOR信号通路对DC功能的调节具有重要作用[22]。实验结果显示RSV诱导哮喘模型小鼠肺中DC细胞PI3K、p-Akt、p-mTOR蛋白表达水平增高,与空白组相比有统计学意义(P<0.01);说明DC细胞中的PI3K/Akt/mTOR信号通路被激活,给予五虎汤、雷帕霉素干预后PI3K、p-Akt、p-mTOR表达水平呈下降趋势,与模型组相比有统计学意义(P<0.05,P<0.01),而氯喹组PI3K、p-Akt与模型组相比差异无统计学意义(P>0.05),我们推测中药五虎汤可抑制该通路,增强DC的自噬功能从而减轻气道重塑。综上所述,五虎汤治疗RSV诱发哮喘的机制可能是抑制PI3K/Akt/mTOR信號通路,进而上调DC的自噬水平,减轻气道重塑。
参考文献
[1] PAPI A, BRIGHTLING C, PEDERSEN S E, et al. Asthma[J].The Lancet, 2018, 391(122): 783-800.
[2] WARK P B, RAMSAHAI J M, PATHINAYAKE P, et al. Respiratory viruses and asthma[J]. Seminars in Respiratory and Critical Care Medicine, 2018, 39(1): 45-55.
[3] VAN RIJT L S, VAN KESSEL C H, BOOGAARD I, et al. Respiratory viral infections and asthma pathogenesis: A critical role for dendritic cells?[J].Journal of Clinical Virology, 2005, 34(3): 161-169.
[4] AWADY A R, ARCE R M, CUTLER C W. Dendritic cells: microbial clearance via autophagy and potential immunobiological consequences for periodontal disease[J]. Perioelontology, 2000, 2015, 69(1): 160-180.
[5] Jyothula S S, EISSA N T. Autophagy and role in asthma[J]. Current Opinion in Pulmonary Medicine, 2013, 19(1): 30-35.
[6] GHISLAT G, LAWRENCE T. Autophagy in dendritic cells[J].Cellular Molecular Immunology, 2018, 15(11): 944-952.
[7] 楊静宜,王孟清,黄 婷,等.五虎汤对哮喘婴幼儿DC刺激T淋巴细胞分泌IL-4、IL-5的影响[J].湖南中医药大学学报,2009,29(2):49-51.
[8] 丁 伊.RSV诱导的树突细胞自噬对哮喘小鼠气道反应性的影响及五虎汤的干预作用[D].长沙:湖南中医药大学, 2019.
[9] 周 民.RSV诱导的树突细胞自噬对哮喘小鼠炎性细胞因子的影响及五虎汤的干预作用[D].长沙:湖南中医药大学,2019.
[10] CHEN X, LUO Y, WANG M, et al. Wuhu Decoction regulates dendritic cell autophagy in the treatment of respiratory syncytial virus (RSV)-Induced mouse asthma by AMPK/ULK1 signaling pathway[J]. Medscimonit, 2019, 25: 5389-5400.
[11] GERN J E. Mechanisms of virus-induced asthma[J]. The Journal of Pediatrics, 2003, 142(2): S9-S14.
[12] MORRIS S, SWANSON M S, LIEBERMAN A, et al. Autophagy-mediated dendritic cell activation is essential for innate cytokine production and APC function with respiratory syncytial virus responses[J]. The Journal of Immunology, 2011, 187(8): 3953-3961.
[13] GUI D, CUI Z, ZHANG L, et al. Salidroside attenuates hypoxia-induced pulmonary arterial smooth muscle cell proliferation and apoptosis resistance by upregulating autophagy through the AMPK-mTOR-ULK1 pathway[J]. BMC Pulmonary Medicine, 2017, 17(191): 5-12.
[14] GLICK D, BARTH S, MACLEOD K F. Autophagy: cellular and molecular mechanisms[J]. The Journal of Pathology, 2010, 221(1): 3-12.
[15] DAHLIN A, QIU W, LITONJUA A A, et al. The phosphatidylinositide 3-kinase (PI3K) signaling pathway is a determinant of zileuton response in adults with asthma[J]. The Pharmacogenomics Journa, 2018, 18(5): 665-677.
[16] HURLEY J H, YOUNG L N. Mechanisms of autophagy initiation[J]. Annual Review of Biochemistry, 2017, 86(6): 225-244.
[17] XU Z, HAN X, OU D, et al.Targeting PI3K/AKT/mTOR-mediated autophagy for tumor therapy[J]. Applied Microbiology and Biotechnology, 2020, 104(2): 575-587.
[18] SHI B, MA M, ZHENG Y, et al. mTOR and Beclin1: Two key autophagy-related molecules and their roles in myocardial ischemia/reperfusion injury[J]. Journal of Cellular Physiology, 2019, 234(8): 12562-12568
[19] CAO B, LI J, ZHOU X, et al. Clioquinol induces pro-death autophagy in leukemia and myeloma cells by disrupting the mTOR signaling pathway[J]. Scientific Reports, 2014, 4(1): 49-57.
[20] ZEKI A A, YEGANEH B, KENYON N J, et al. Autophagy in airway diseases: a new frontier in human asthma?[J]. Allergy, 2016, 71(1): 5-14.
[21] 延光海,金光玉,朴红梅等.雷帕霉素对哮喘小鼠气道重塑的影响[J].中国药理学通报,2013,29(7):942-946.
[22] WEICHHART T, SAEMANN M D. The PI3K/Akt/mTOR pathway in innate immune cells: emerging therapeutic applications[J]. Annals of the Rheumatic Diseases, 2008, 67(11): 70-74.

