云南6种特色蜂蜜的抗氧化性分析
解道豪 匡海鸥 谭霞 李佛琳 董坤 李亚辉 杨明华
摘要:测定云南省6种特色蜂蜜的理化特征、抗氧化物质含量及抗氧化能力,结合基本理化特征分析不同抗氧化物质对抗氧化能力的贡献度,以阐明云南部分特色蜂蜜的基本理化特征和抗氧化特性,探讨用抗氧化性评价蜂蜜质量的可行性。参照国家标准方法测定6种蜂蜜的基本理化指标;采用分光光度法测定6种蜂蜜中总酚、总黄酮、脯氨酸含量及还原力和1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力,分析数据显著性和相关性。结果表明,蜂蜜中总酚含量均值为(20.78±0.13)mgGAE/100g,总黄酮含量在(2.42±0.19)~(15.96±0.12)mgQE/100g之间,脯氨酸含量平均值为(913.44±12.17)mg/kg。咖啡蜜的DPPH自由基清除能力及还原力均明显高于其他蜜。总酚和总黄酮含量是影响蜂蜜总抗氧化性的主要因素,其他抗氧化物质的含量增加时会提高蜂蜜的抗氧化能力。同一地区、同一时间采集的澳洲坚果蜜,除DPPH自由基清除率无显著性差异外,中蜂坚果蜜的总酚、总黄酮和脯氨酸含量均显著低于西蜂坚果蜜,而还原力却显著高于西蜂坚果蜜。总酚、总黄酮含量与还原力之间具有极显著的正相关关系(相关系数分别为0.675、0.681),总黄酮含量与DPPH自由基清除率IC50呈显著负相关关系(r=-0.501)。由于蜂蜜本身化学成分的种类与含量不同,并受到蜂种、蜜源植物、地理环境等因素的影响,不同蜂蜜抗氧化能力存在明显差异。所有蜂蜜样品的抗氧化能力(还原力)表现为咖啡蜜>中蜂坚果蜜>红河百花蜜>野藿香蜜>西蜂坚果蜜>野坝子蜜17>苕子蜜>野坝子蜜16>维西百花蜜。
关键词:云南蜂蜜;抗氧化物质;抗氧化能力;相关性分析;还原力
中图分类号:TS207.3文献标志码:A
文章编号:1002-1302(2021)04-0135-06
作者簡介:解道豪(1995—),男,云南宾川人,硕士研究生,主要从事蜜蜂生物学及蜂产品开发利用研究。E-mail:18468167655@163.com。
通信作者:李亚辉,博士,教授,博士生导师,主要从事生殖与发育生物学和蜜蜂科学研究。E-mail:kmliyh@163.com。
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成贮藏在巢脾内的天然甜物质,是一种非人为改变其成分、甜而有黏性、透明或半透明的液体[1-2]。蜂蜜中含有丰富的氨基酸、酶、蛋白质、维生素、矿物质、酚类化合物等[3-4],是一种成分复杂的高能量碳水化合物产品。
人体内的氧化平衡被破坏时会发生氧化应激,这种反应会破坏脂质、蛋白质的结构,导致许多疾病的发生[5]。蜂蜜作为药食同源食品,具有抗炎症、抗癌症以及增强免疫力和减少心脏病发病率的作用[6-7]。蜂蜜含有包括酚酸类物质、抗坏血酸、抗氧化酶、黄酮类物质、类胡萝卜素和美拉德反应产物等在内的多种天然抗氧化物质,在体内外均有显著的抗氧化活性[8-9]。蜂蜜中酚酸类物质是抗氧化活性的主要物质,总酚含量可用来确定蜂蜜的植物源和地理来源,是评价蜂蜜真伪的重要指标性化合物[10]。蜂蜜中的黄酮类物质来自植物的花蜜、花粉和蜂胶,是蜂蜜中常见的抗氧化物质。已有研究发现,蜂蜜中的脯氨酸含量与蜂蜜的自由基清除能力呈极显著正相关[11],而蜂蜜中脯氨酸的含量也被作为衡量蜂蜜中游离氨基酸含量的标准[12]。
国外对于蜂蜜的抗氧化物质和抗氧化能力之间的关系有广泛的研究,澳大利亚的桉树蜂蜜和新西兰的麦卢卡蜂蜜中的酚类和黄酮类物质含量与抗氧化能力呈显著正相关[13-14]。Dz[DD(-1][HT6]·[DD)][KG-*8]ugan等测定了90多种蜂蜜,其中荞麦蜜的抗氧化能力最强,而无论使用何种方法,油菜蜜的抗氧化能力最弱[15]。近年来,我国也相继报道过蜂蜜的抗氧化性研究,如董蕊等对益母草蜜、蒲公英蜜、枇杷蜜等15种蜜源植物蜂蜜的多酚含量与抗氧化性进行了研究,并发现二者之间存在显著的关系[16]。郭夏丽等对江西的洋槐蜜、紫云英蜜、党参蜜、土黄连蜜、龙眼蜜、枣花蜜、野桂花蜜等7种不同蜜源的总酚、总黄酮含量及还原力进行了初步研究,发现我国蜂蜜的化学组成与抗氧化性之间具有显著关系[17]。
蜂蜜的性质和成分取决于其地理来源、花蜜种类、收获季节、环境因素和养蜂人的处理方法等[18]。云南省有十分丰富的蜜源植物,加上云南省独特的地理、气候和土壤条件,对于热带、亚热带经济作物如咖啡、澳洲坚果等具有得天独厚的种植条件,形成了许多包括野坝子蜜、咖啡蜜、澳洲坚果蜜等在内的云南本地特色蜜种。目前对云南特色蜂蜜抗氧化性的研究报道仍较少,且主要集中于典型的抗氧化物质(酚酸、总黄酮)方面,随着研究的深入,蜂蜜中越来越多的抗氧化成分被证实,但不同成分对抗氧化性的贡献须要明确。本研究对云南省6种特色蜂蜜的抗氧化物质和抗氧化性进行分析,测定蜂蜜中基本理化指标及总酚、总黄酮、脯氨酸含量以及1-1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力与还原力,分析不同抗氧化物质之间的相关性及其对抗氧化性的贡献度,以期阐明云南部分特色蜂蜜的抗氧化特性,并探讨抗氧化物质与蜂蜜种类之间的关系及用抗氧化性评价蜂蜜质量的可行性。
1材料与方法
1.1试验时间和地点
本试验于2019年7月10日至2020年1月3日在云南农业大学蜂学楼蜜蜂产品成分分析及检测实验室进行。
1.2材料、试剂和仪器
咖啡蜜(KF)采自云南省保山市,野坝子蜜[YBZ16(2016年)、YBZ17(2017年)]采自云南省大理市,中蜂坚果蜜(JGZ)和西蜂坚果蜜(JGX)均采自云南省芒市,野藿香蜜(YHX)采自云南省蒙自市,红河百花蜜(HHB)、维西百花蜜(WXB)均采自云南省红河哈尼族彝族自治州,苕子蜜(SZ)采自云南省寻甸回族彝族自治县,共9个样品。
没食子酸、槲皮素、脯氨酸标准品、Torlox标准液(纯度均>99%,北京索莱宝科技有限公司公司);福林酚、DPPH自由基、铁氰化钾、氯化铁、三氯乙酸、磷酸盐(PBS)缓冲液、茚三酮、三氯化铝、甲酸、异丙醇、乙二醇单甲醚(分析纯,云南表达科技有限责任公司)。
可见光分光光度计[A360,翱艺仪器(上海)有限公司],电子天平[AX223ZHE,奥豪斯仪器(常州)有限公司],数字显示恒温水浴锅(HH-8,常州国华电器有限公司)。
1.3试验方法
1.3.1样品前处理5g蜂蜜样品用超纯水定容至50mL容量瓶中,离心过滤备用。
1.3.2总酚含量的测定采用Folin-ciocalteu比色法[19]。标准曲线绘制:取纯度为99%的没食子酸标准物,用超纯水配制成浓度为100mg/mL的没食子酸溶液,用移液枪分别准确取0.1、0.2、0.3、0.4、0.5、0.6mL加入2.5mL0.2mol/L福林酚试剂,静待5min后加入2.5mL75g/L的Na2CO3。在室温下在避光反应2h,以超纯水为空白对照,测定760nm处的吸光度。1mLFC显色试剂混匀,静置2~5min后,各加入15%Na2CO35mL,建立没食子酸标准曲线[y=0.1308x+0.0017(r2=0.9946)]。吸取0.5mL蜂蜜样液加入2.5mL0.2mol/L福林酚试剂,5min后加入2.5mL75g/L的Na2CO3。避光反应2h,测定600nm处的吸光度。根据回归方程计算总酚含量,单位为mgGAE/100g。
1.3.3总黄酮含量的测定参考Arvouet-Grand等的方法[20]。分别精密量取0.1mg/mL槲皮素标准品0.00、1.00、2.00、3.00、4.00、5.00mL定容至10mL。各量取5mL加入5mLAlCl3溶液(2%溶于甲醇中)摇匀,10min后以未加槲皮素标准溶液作空白对照,测定415nm处吸光度。以槲皮素含量(μg)为横坐标,以吸光度为纵坐标绘制标准曲线[y=0.0081x-0.0063(r2=0.9852)]。取5mL蜂蜜滤液2份,其中1份不加AlCl3溶液,作样品空白对照,10min后测定415nm处的吸光度。测得样品吸光度减去样品空白吸光度。根据回归方程计算黄酮含量,单位为mgQE/100g。
1.3.4脯氨酸含量的测定采用Bogdanov等的方法[21]。分别准确吸取0.032mg/mL脯氨酸标准溶液0.00、0.20、0040、0.60、0.80、1.00mL定容至10mL。加入1mL80%甲酸,1mL水合茚三酮溶液(3%溶于乙二醇单甲醚中),剧烈振荡15min,沸水浴15min后转移至70℃水浴10min,然后加入5mL50%异丙醇水溶液,再70℃水浴10min,冷却,后测定510nm处的吸光度。以脯氨酸含量(mg)为横坐标,以吸光度为纵坐标绘制标准曲线[y=0.1660x+0.0331(r2=0.9728)]。取0.5mL蜂蜜溶液,其他处理同标准品,测定时以超纯水作为空白对照。
脯氨酸含量(mg/kg)=(Ds/Da)×(m1/m2)×80。
式中:Ds是样品的吸光度;Ea是脯氨酸标准品的吸光度;m1是标准溶液中脯氨酸的毫克数;m2是蜂蜜的质量;80是稀释因子。
1.3.5DPPH自由基清除能力的测定准确称取0.125gDPPH自由基放入事先准备好的盛有甲醇的烧杯中,待充分溶解后移至500mL容量瓶中,用甲醇定容到刻度线,作为原液,抽取10mL原液于100mL容量瓶中用甲醇定容到刻度,制成浓度为0.025mg/mL的溶液。取1mL蜂蜜水溶液样品与4mL的0.025mg/mLDPPH甲醇溶液混合,对照试验用超纯水替代蜂蜜水溶液。摇匀反应液,避光反应1h后,以甲醇作空白对照,测定517nm处的吸光度,同时计算半抑制浓度(IC50)。
DPPH清除率=(D0-D1)/D0×100%。
式中:D0是空白组吸光度;D1是1h后不同浓度样品溶液的吸光度。
1.3.6还原力的测定采用Oyaizu的方法[22]。精确称取25mgTrolox标准液溶于80%乙醇溶液中,定容至100mL容量瓶中,分别取0.00、0.50、1.00、2.00、3.00、4.00、5.00mL定容至10mL。吸取各标准溶液1mL,加入2.5mLPBS缓冲液(0.2mol/L,pH值为6.6),加入2.5mL1%铁氰化钾溶液,50℃水浴15min,再加入5mL10%三氯乙酸摇匀,800r/min离心5min,取2.5mL上清液,加入2.5mL蒸馏水和0.5mL0.1%氯化铁,混合后测定700nm处的吸光度,用蒸馏水调零。以Trolox含量(μg)为横坐标,以吸光度为纵坐标绘制标准曲线[y=0.9465x+0.2041(r2=0.9955)]。取蜂蜜样品1mL,其他处理同Trolox标准液,测定700nm处的吸光度,以超纯水调零。根据回归方程计算还原力,单位为mgTrolox/100g。
1.4数据处理
所有样品均测定3次,计算平均值,结果以“平均值±标准差”表示。用SPSS23软件分析数据间的显著性和相关性。
2结果与分析
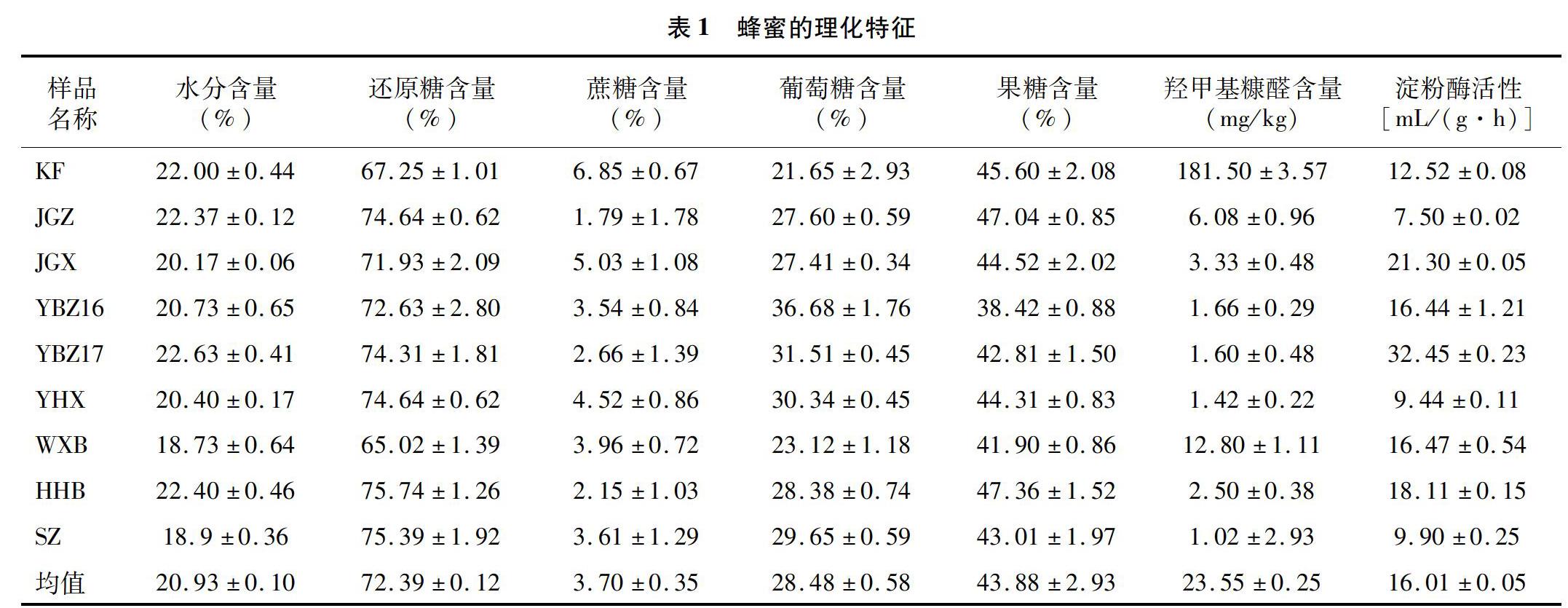
2.1蜂蜜的基本理化特征
参照相关国家标准要求,对9个蜂蜜样品进行基本理化指标检测,包括水分、还原糖、蔗糖、葡萄糖、果糖、羟甲基糠醛含量及淀粉酶活性等。由表1可知,以水分含量而言,维西百花蜜和苕子蜜属于一级品,其他为二级品。咖啡蜜和西蜂坚果蜜的蔗糖含量高于國家标准要求(≤5%),咖啡蜜的羟甲基糠醛含量远超过国家标准要求(≤40mg/kg),其他各项指标均符合蜂蜜的国家标准要求。
2.2蜂蜜的抗氧化物质含量及抗氧化能力分析
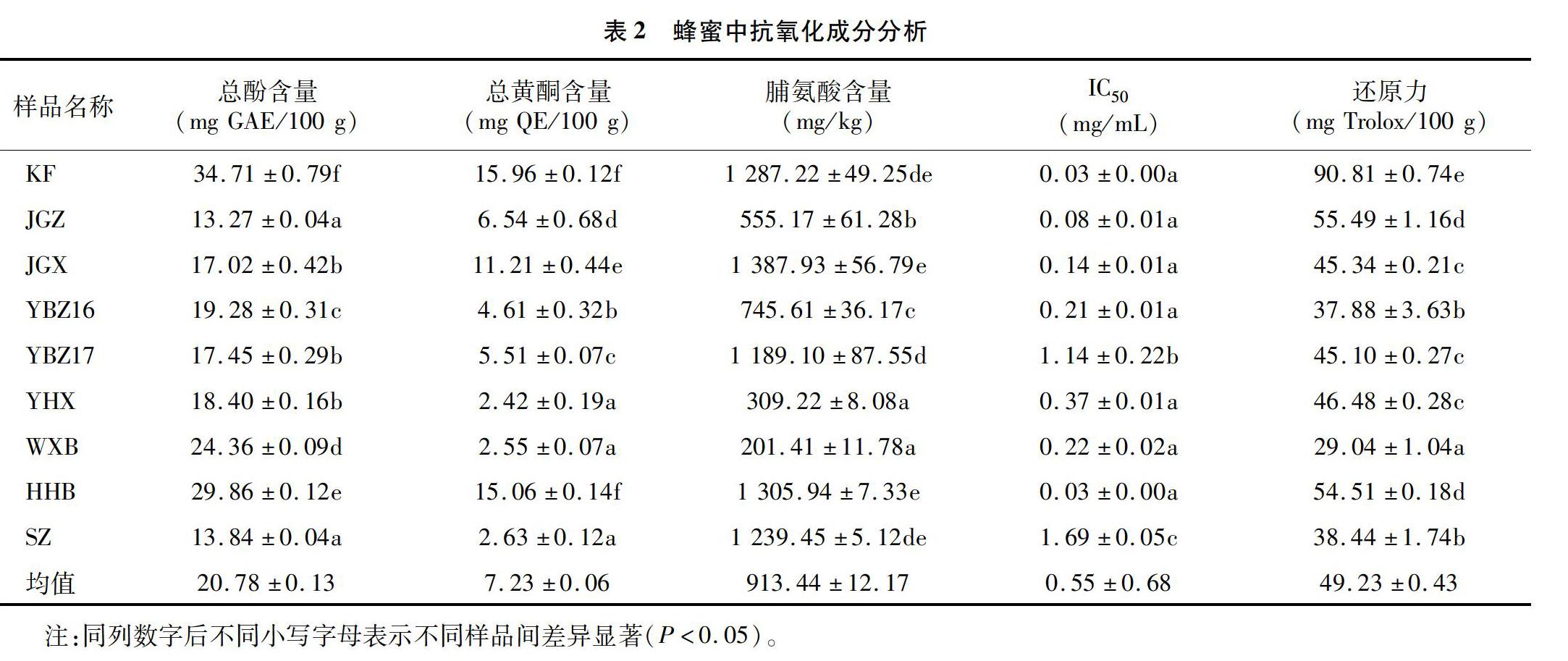
9个蜂蜜样品的抗氧化性成分含量见表2,相关性分析结果见表3。
2.2.1总酚含量不同蜂蜜的总酚含量在13.27~34.71mgGAE/100g之间,咖啡蜜的总酚含量显著高于其他蜜;中蜂坚果蜜和苕子蜜的总酚含量相对较低,且两者之间差异不显著;西蜂坚果蜜、野坝子蜜(YBZ17)和野藿香蜜之间的总酚含量差异不显著;其余各样品之间的总酚含量有显著性差异(P<0.05)。
2.2.2总黄酮含量不同蜂蜜的总黄酮含量在2.42~15.96mgQE/100g之间,咖啡蜜和红河百花蜜的总黄酮含量较高;野藿香蜜、苕子蜜和维西百花蜜的总黄酮含量较低,且差异不显著;不同蜂种采集的坚果蜜中总黄酮含量差异显著,西蜂采集的堅果蜜的总黄酮含量显著高于中蜂坚果蜜;2016年和2017年的野坝子蜜也存在显著性差异。
2.2.3脯氨酸含量不同蜂蜜的脯氨酸含量变化幅度较大,咖啡蜜、西蜂坚果蜜、红河百花蜜和苕子蜜这4种蜜的脯氨酸含量没有显著性差异,但显著高于其他蜂蜜;红河百花蜜与维西百花蜜脯氨酸含量有显著性差异;西蜂坚果蜜的脯氨酸含量显著高于中蜂坚果蜜。
2.2.4还原力测定还原力时,样品液吸光度值越大,其还原力越强。由表2可知,不同蜂蜜样品之间还原力的高低存在差异,还原力最高的是咖啡蜜,达到90.81mgTrolox/100g,最低的为维西百花蜜。不同年份野坝子蜂蜜的还原力差异显著,中蜂坚果蜜的还原力显著高于西蜂坚果蜜。还原力表现为咖啡蜜(KF)>中蜂坚果蜜(JGZ)>红河百花蜜(HHB)>野藿香蜜(YHX)>西蜂坚果蜜(JGX)>野坝子蜜17(YBZ17)>苕子蜜(SZ)>野坝子蜜16(YBZ16)>维西百花蜜(WXB)。
2.2.5DPPH自由基清除能力由图1可见,所有蜂蜜对自由基均具有清除作用,根据自由基清除曲线,随着蜂蜜样品浓度的增加,清除率不断提高。根据自由基清除曲线计算IC50,范围是0.03~1.69mg/mL,不同种类的蜂蜜自由基清除效果相差较大。红河百花蜜和咖啡蜜的自由基清除率最高,苕子蜜的自由基清除效果最差,除苕子蜜和2017年野坝子蜜以外,其余蜂蜜样品的自由基清除率差异均不显著。
3讨论与结论
蜂蜜中最常见的酚酸类化合物是苯甲酸和肉桂酸以及它们的酯[23],不同种类的单花种蜂蜜所含酚酸的种类存在较大差异,含量也存在差异,比如新西兰的麦卢卡蜜中没食子酸含量最高,被作为麦卢卡蜜的一个标志[24]。本研究所检测的9种蜂蜜样品中,咖啡蜜、红河百花蜜颜色都比其他蜜种深,其总酚含量显著高于其他浅色蜜,这与Ferreira等深色蜜的酚酸含量高于浅色蜜的研究结果[25]相一致。西蜂坚果蜜的总酚含量显著高于中蜂坚果蜜,表明在同一蜜源地,相同花期下不同蜂种采集的澳洲坚果蜜中总酚含量存在显著性差异,可能与周围蜜源的种类及分布,蜂种差异以及蜂种间的竞争等有关。
黄酮类化合物是存在于蜂蜜中的一类主要抗氧化成分,主要是以配基和糖苷的形式存在。蜜源植物的不同,蜂蜜中的黄酮种类和含量也各不相同。本研究结果表明,深色蜜比浅色蜜总黄酮含量高,验证了董蕊等提出的蜂蜜颜色与总黄酮含量成正相关的结论[16]。同一蜂场不同蜂种采集的澳洲坚果蜂蜜中总黄酮含量存在显著性差异,西蜂坚果蜜的总黄酮含量比中蜂坚果蜜多了近1倍。之前的研究表明北半球所采集的蜂蜜,其所含的黄酮类化合物主要来自蜂胶[26],西方蜜蜂有采胶的行为特性,而中蜂则没有,这样的差异可能导致了蜂蜜中总黄酮含量的差异。
研究表明,蜂蜜中含有多种游离氨基酸,不同的蜂蜜氨基酸种类不同,游离氨基酸中脯氨酸含量最高[27],且其含量与抗氧化能力有关。2016年和2017年的野坝子蜜脯氨酸含量差异明显,可能与储藏时间有关,蜂蜜中的氨基酸可能在储藏过程中受到外界环境影响而分解。西蜂坚果蜜的脯氨酸含量是中蜂坚果蜜的2.5倍,可以看出同一蜜源地不同蜂种采集的蜂蜜中脯氨酸的含量有极大差异。红河百花蜜与维西百花蜜脯氨酸含量差异显著,表明不同地域,不同蜜源对蜂蜜中脯氨酸的含量也有影响。本研究并未表现出脯氨酸含量与抗氧化性之间存在正相关性,这与Meda等的结论[11]并不一致,分析认为所测样品大部分是中蜂蜜,中蜂的采集特性使得中蜂蜜的花蜜来源复杂,不同蜂蜜中的脯氨酸含量差异较大,且抗氧化物质含量也各有高低,其中脯氨酸对总抗氧化性的贡献度仍须要进行深入研究。Meda等的研究认为蜂蜜中的脯氨酸含量与蜂蜜的自由基清除能力呈极显著的正相关关系[11];在本研究中,2017年野坝子蜜与苕子蜜的脯氨酸含量均较高,却并未表现出较强的自由基清除能力,由于不同的抗氧化物质对自由基的清除率的贡献度不同,可能与它们的总酚和总黄酮含量有关。
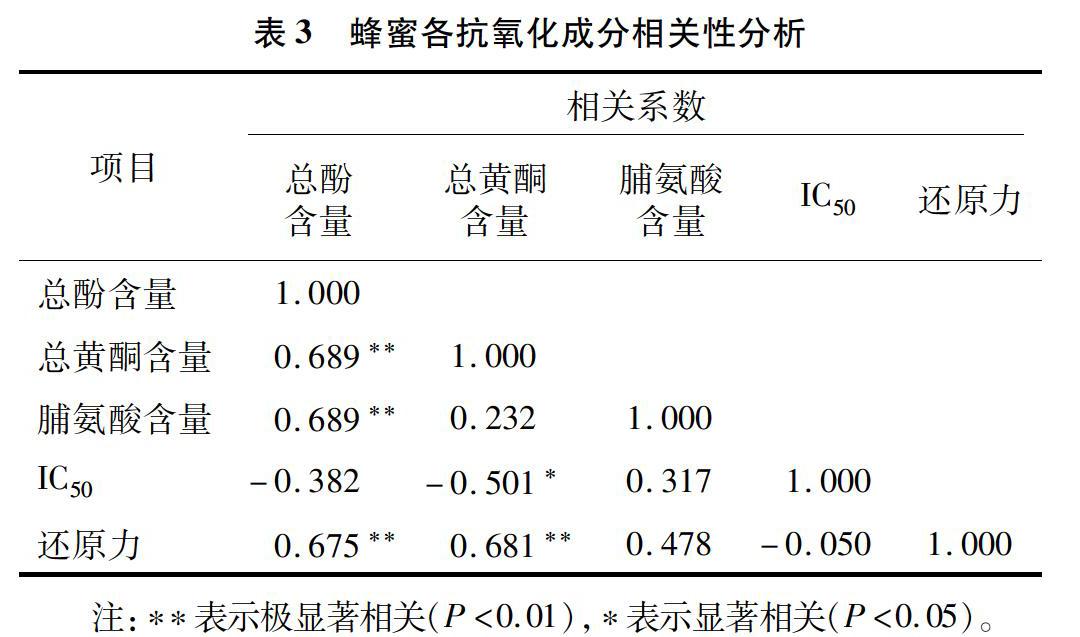
DPPH自由基是一种十分稳定的自由基,在甲醇溶液中显深紫色,加入蜂蜜后,自由基中的单电子配对使得颜色逐渐退去,颜色越浅自由基清除越彻底。蜂蜜中的总酚含量越高自由基清除效果越强,但是总酚含量并不是唯一的影响因子,西蜂坚果蜜与2017年的野坝子蜜总酚含量差不多,但是前者的总黄酮含量却是后者的2倍,两者的DPPH自由基清除率结果差异显著。总黄酮含量与DPPH自由基清除率的IC50呈显著负相关关系(r=-0.501),即总黄酮含量越高,IC50越低,清除效果越好,这一结果与郭夏丽等的结论[17]是相符的。
蜂蜜的还原力又称总抗氧化性,体现的是蜂蜜中所有抗氧化物质的抗氧化性。6种蜂蜜的还原力与总酚、总黄酮含量之间具有极显著的正相关关系(r=0.675,r=0.681),这与Ferreira等的结论[25]是一致的,说明总酚和总黄酮含量是影响蜂蜜总抗氧化性的主要因素。咖啡蜜的还原力远高于其他蜂蜜,可能与其高含量的羟甲基糠醛含量密切相关,蜂蜜在贮存和热加工过程中,会产生大量美拉德反应产物,如羟甲基糠醛,使蜂蜜的颜色加深,还原力增强。同一地区、同一时间采集的澳洲坚果蜜,除DPPH自由基清除率无显著差异外,中蜂坚果蜜的总酚、总黄酮和脯氨酸含量均显著低于西蜂坚果蜜,而还原力却显著高于西蜂坚果蜜,中蜂坚果蜜中的其他抗氧化物质可能起到了更多的作用。
本研究对云南6种特色蜂蜜的基本理化指标和抗氧化物质(总酚、总黄酮、脯氨酸含量)及抗氧化能力(DPPH自由基清除能力、还原力)进行分析,结果表明,不同的蜂蜜样品均具有抗氧化活性,不同品种的蜂蜜抗氧化能力各有差异,深色蜜的抗氧化能力强于浅色蜜;蜂蜜中酚酸含量越高,抗氧化能力就越强,对自由基的消除作用也就越强。总酚和总黄酮含量是影响抗氧化能力的主要因素,其他抗氧化物质的含量增加时会提高蜂蜜的总抗氧化能力。
参考文献:
[1]中华人民共和国卫生部.食品安全国家标准蜂蜜:GB14963—2011[S].北京:中国标准出版社,2011.
[2]和绍禹,林尊诚,周振桓,等.蜜蜂產品认知大全[M].昆明:云南科技出版社,2005:126-127.
[3]BogdanovS,JurendicT,SieberR,etal.Honeyfornutritionandhealth:areview[J].JournaloftheAmericanCollegeofNutrition,2008,27(6):677-689.
[4]daSilvaPM,GaucheC,GonzagaL,etal.Honey:chemicalcomposition,stabilityandauthenticity[J].FoodChemistry,2016,196:309-323.
[5]Alvarez-SuarezJM,GiampieriF,BattinoM.Honeyasasourceofdietaryantioxidants:structures,bioavailabilityandevidenceofprotectiveeffectsagainsthumanchronicdiseases[J].CurrentMedicinalChemistry,2013,20(5):621-638.
[6]AhmedS,OthmanNH.Honeyasapotentialnaturalanticanceragent:areviewofitsmechanisms[J].Evidence-basedComplementaryandAlternativeMedicine,2013(15):829070.
[7]AljadiA,KamaruddinM.EvaluationofthephenoliccontentsandantioxidantcapacitiesoftwoMalaysianfloralhoneys[J].FoodChemistry,2004,85(4):513-518.
[8]HabibHM,AlMeqbaliFT,KamalH,etal.Physicochemicalandbiochemicalpropertiesofhoneysfromaridregions[J].FoodChemistry,2014,153:35-43.
[9]ShantalRM,EscuredoO,CarmenSM.AssessmentofphysicochemicalandantioxidantcharacteristicsofQuercuspyrenaicahoneydewhoneys[J].FoodChemistry,2015,166:101-106.
[10]Toms-BarbernFA,MartosI,FerreresF,etal.HPLCflavonoidprofilesasmarkersforthebotanicaloriginofEuropeanunifloralhoneys[J].JournaloftheScienceofFoodandAgriculture,2001,81(5):485-496.
[11]MedaA,LamienCE,RomitoM,etal.Determinationofthetotalphenolic,flavonoidandprolinecontentsinBurkinaFasanhoney,aswellastheirradicalscavengingactivity[J].FoodChemistry,2005,91(3):571-577.
[12]HermosínI,ChicónRM,CabezudoMD.Freeaminoacidcompositionandbotanicaloriginofhoney[J].FoodChemistry,2003,83:263-268.
[13]MartosI,FerreresF,YaoL,etal.FlavonoidsinmonospecificeucalyptushoneysfromAustralia[J].JournalofAgriculturalandFoodChemistry,2000,48(10):4744-4748.
[14]SnowMJ,Manley-HarrisM.Onthenatureofnon-peroxideantibacterialactivityinNewZealandmanukahoney[J].FoodChem,2004,84(1):145-147.
[15]D[KG-*2]z[DD(-1][HT6]·[DD)]uganM,TomczykM,SowaP,etal.Antioxidantactivityasbiomarkerofhoneyvariety[J].Molecules,2018,23(8):2069.
[16]董蕊,郑毅男.不同蜜源蜂蜜多酚类抗氧化活性比较[J].吉林农业大学学报,2011,33(6):654-657,661.
[17]郭夏丽,罗丽萍,冷婷婷,等.7种不同蜜源蜂蜜的化学组成及抗氧化性[J].天然产物研究与开发,2010,22(4):665-670.
[18]ClearwaterMJ,RevellM,NoeS,etal.Influenceofgenotype,floralstage,andwaterstressonfloralnectaryieldandcompositionofmānuka(Leptospermumscoparium)[J].AnnalsofBotany,2018,121(3):501-512.
[19]SingletonVL,OrthoferR,Lamuela-RaventósRM.AnalysisoftotalphenolsandotheroxidationsubstratesandantioxidantsbymeansofFolin-ciocalteureagent[J].MethodsinEnzymology,1999,299C(1):152-178.
[20]Arvouet-GrandA,VennatB,PourratA,etal.Standardisationdunextraitdepropolisetidentificationdesprincipauxconstituants[J].JournaldePharmaciedeBelgique,1994,49:462-468.
[21]BogdanovS,MartinP,LullmannC,etal.Harmonisedmethodsoftheinternationalhoneycommission[R].SwissBeeResearchCenter,1999:59-60.
[22]OyaizuM.Studiesonproductsofbrowningreactions:antioxidantiveactivitiesofproductsofbrowningreactionpreparedfromglucosamine[J].TheJapaneseJournalofNutritionandDietetics,1986,44(6):307-316.
[23]FerreresF,AndradeP,Tomás-BarberánFA.Naturaloccurrenceofabscisicacidinheatherhoneyandfloralnectar[J].JournalofAgriculturalandFoodChemistry,1996,44(8):2053-2056.[HJ1.95mm]
[24]YaoLH,DattaN,Tomás-BarberánFA,etal.Flavonoids,phenolicacidsandabscisicacidinAustralianandNewZealandLeptospermumhoneys[J].FoodChemistry,2003,81(2):159-168.
[25]FerreiraI,AriesE,BerreiraJ,etal.AntioxidantactivityofPortuguesehoneysample:differentcontridutionsoftheentirehoneyandphenlicextract[J].FoodChemistry,2009,114(4):1438-1443.
[26]Tomás-BarberánFA,MartosI,FerreresF,etal.HPLCflavonoidprofileasmarkersforthebotanicaloriginofEuropeanhoney[J].JournaloftheScienceofFoodandAgriculture,2001,81(5):485-496.
[27]TruzziC,AnnibaldiA,IlluminatiS,etal.Determinationofprolineinhoney:comparisonbetweenofficialmethods,optimizationandvalidationoftheanalyticalmethodology[J].FoodChemistry,2014,150:477-481.

