不同浓度多聚赖氨酸溶液对同种异体骨进行表面改性的实验研究
笪 虎,张建中,宋建宽,徐长明,熊 卓
(1.涟水县人民医院骨科,江苏 涟水 223400;2.淮安市急救中心,江苏 淮安 223001;3.清华大学机械工程系,北京 100084)
针对大段骨缺损,临床上常使用组织工程骨进行修复。其中,同种异体骨是重要的组织工程骨之一[1-2]。但是,同种异体骨细胞亲和力(骨传导能力)不强,宿主细胞难以在其微孔表面大量黏附与增殖,临床治疗效果不佳[3-4]。为增强同种异体骨的细胞亲和力,本课题组在前期的实验中,采用冻干法,使用多聚赖氨酸溶液对兔同种异体骨的微孔进行表面改性,其细胞亲和力得到了显著提升;此外,该方法成本低廉,步骤简单,易于掌握和操作[5-7]。然而,有研究报道,多聚赖氨酸具有细胞毒性,可抑制细胞的生长[8]。为了使同种异体骨表面改性后具有最佳的细胞亲和力与最低的细胞毒性,本研究通过探讨多聚赖氨酸溶液的最佳浓度,旨在为其今后的临床应用提供实验依据。
1 材料与方法
1.1 材料
成年新西兰大白兔由空军军医大学实验动物中心提供,兔同种异体骨购自西京医院骨库,左旋多聚赖氨酸(分子量15万~30万)、L-抗坏血酸、地塞米松、胰蛋白酶、β-甘油磷酸钠、噻唑蓝(MTT)、DMSO购自美国Sigma,D-Hank’s液、转化生长因子-β2(transforming growth factor-β2,TGF-β2)、DMEM培养基购自美国Gibico,胎牛血清购自杭州四季青生物工程材料有限公司,碱性磷酸酶(alkaline phosphatase,ALP)活性测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 兔同种异体骨的表面改性和分组 兔同种异体骨均取自于兔椎体松质骨,切割成边长为3 mm的正方体,然后分别浸入100 mg/mL、30 mg/mL、1 mg/mL、0.1 mg/mL、0.025 mg/mL和0.01 mg/mL的多聚赖氨酸溶液中,持续振荡2 h,微孔被溶液充分浸透后取出,置于12孔培养板内,每孔放置1粒。先在-20 ℃下预冷2 h,随即转至-80 ℃下冷冻1 h,最后置于冷冻干燥机中干燥24 h。根据同种异体骨所浸入的多聚赖氨酸浓度,将其分为100 mg/mL组、30 mg/mL组、1 mg/mL组、0.1 mg/mL组、0.025 mg/mL组和0.01 mg/mL组,未经表面改性的同种异体骨纳入空白对照组。各组同种异体骨均经20 kGy60Co辐照灭菌,于4 ℃密封无菌保存。
1.2.2 兔骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的分离与扩增 以戊巴比妥麻醉新西兰大白兔后,将其股骨大粗隆及周围皮肤仔细反复消毒。持骨穿针,在股骨大粗隆处抽吸约0.5 mL骨髓,迅速滴入含10%胎牛血清的低糖DMEM培养基内,然后置于细胞培养箱内孵育,每2 d半量换液1次。采用全骨髓贴壁法提纯BMSCs。待细胞80%~90%融合时,进行消化、传代。
1.2.3 BMSCs的种植、诱导和培养 第3代BMSCs置于成骨培养基(含10%胎牛血清、50 mg/L L-抗坏血酸、1×10-8mol/L地塞米松和10 mmol/L β-甘油磷酸钠的高糖DMEM)内,制成细胞密度为1×107/mL的悬液。将含2×104个BMSCs的悬液滴入各组同种异体骨内,在细胞培养箱中孵育4 h后添加成骨培养基,每2 d半量换液1次。
1.2.4 MTT比色试验检测BMSCs黏附、增殖的情况 在培养和诱导的第3、5、7、9、11、13、15、17天,每组分别随机抽取8个标本。D-Hank’s液漂洗去除未黏附的细胞后,采用MTT比色试验法,用酶联免疫检测仪在490 nm波长处测定其吸光度A值,利用表格记录每个时间点各组的吸光度A值,以间接检测细胞在同种异体骨微孔表面黏附、增殖的情况。
1.2.5 检测各组同种异体骨内黏附细胞表达ALP的活性 在培养和诱导的第3、5、7、9、11、13、15、17天,每组分别随机抽取8个标本。D-Hank’s液漂洗去除未黏附的细胞后,逐次使用ALP活性测定试剂盒测定ALP的活性。使用酶标仪在520 nm波长处测定吸光度A值,利用表格记录每个时间点各组的光吸收值,以间接检测向成骨细胞方向分化的细胞活力。
1.3 统计学处理

2 结果
2.1 BMSCs在同种异体骨内的增殖情况
MTT比色试验结果显示:BMSCs在各组同种异体骨微孔表面的生长曲线呈抛物线样,从第3天至第17天,细胞数量一直持续上升,到第11天左右进入平台期,增速开始减慢。100 mg/mL组、30 mg/mL组、1 mg/mL组、0.1 mg/mL组和0.025 mg/mL组的细胞数量较多,增殖速度快,但各组之间比较差异无统计学意义(P>0.05);而0.01 mg/mL组和空白对照组的BMSCs增殖相对较慢,每个时间点的数量均少于其余各组,差异具有统计学意义(P<0.05),见图1。

图1 BMSCs在同种异体骨微孔表面的增殖情况
2.2 细胞表达ALP的活性比较
BMSCs经成骨诱导、培养后,从第3天至第17天,各组表达ALP的活性持续增加,至第11天左右进入平台期,活性增速减慢,呈抛物线样。100 mg/mL组、30 mg/mL组、1 mg/mL组、0.1 mg/mL组和0.025 mg/mL组表达ALP的活性较高,但各组之间比较差异无统计学意义(P>0.05);而0.01 mg/mL组和空白对照组细胞表达ALP的活性较低,每个时间点的值均小于其他各组,差异具有统计学意义(P<0.05),见图2。
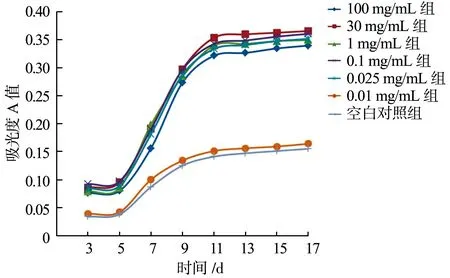
图2 BMSCs表达ALP的活性比较
3 讨论
在组织工程研究中,为提高组织工程骨对细胞的亲和力,优化骨传导能力,常常对其微孔表面进行改性[9-10]。然而,临床上所使用的同种异体骨在很多病例中难以修复骨缺损区,并且长期不被吸收[11-12]。其中,同种异体骨对细胞的亲和力不足是重要因素[13],这与其未经过表面改性,骨传导能力未得到优化有关[14-15]。
载玻片表面覆盖多聚赖氨酸后,其细胞黏附力明显增强,组织切片不易脱落[16-17]。受此启发,本课题组在前期研究中使用多聚赖氨酸对同种异体骨进行表面改性,发现表面改性后的同种异体骨对细胞的亲和力显著增加,即骨传导性得到明显提高[5-7]。此外,也有学者使用多聚赖氨酸对其他人工骨进行表面改性,并取得了良好的结果[18-19]。有研究报道多聚赖氨酸具有细胞毒性,可抑制细胞生长的特性,本课题组通过探索多聚赖氨酸溶液用于同种异体骨表面改性的最佳浓度,以期既能将细胞毒性控制在最低,又能发挥其最佳作用。
本课题组在着手研究之前,查阅了相关文献,并参照玻片包被方法所使用的多聚赖氨酸溶液的浓度[17,20-21],最终选择浓度为100 mg/mL、30 mg/mL、1 mg/mL、0.1 mg/mL、0.025 mg/mL和0.01 mg/mL的多聚赖氨酸溶液分别对兔同种异体骨进行表面改性。MTT比色试验和细胞表达ALP活性的结果显示,经100 mg/mL、30 mg/mL、1 mg/mL、0.1 mg/mL和0.025 mg/mL多聚赖氨酸溶液表面改性后的同种异体骨微孔表面的细胞亲和力均得到显著增强,细胞易在其表面黏附与增殖,均显著优于0.01 mg/mL组和空白对照组。此外,本研究结果还发现,100 mg/mL组、30 mg/mL组、1 mg/mL组、0.1 mg/mL组和 0.025 mg/mL组细胞增殖的数量及表达ALP的活性无明显差异,提示以上浓度的多赖氨酸溶液对细胞的增殖和活力影响相似。100 mg/mL、30 mg/mL的多聚赖氨酸溶液浓度较高,但高浓度的多聚赖氨酸未影响细胞黏附、增殖和分泌等活力,由此推断,多聚赖氨酸的细胞毒性很小,细胞相容性良好。因此,从经济、有效方面考虑,本研究推荐对同种异体骨进行表面改性的多聚赖氨酸溶液最佳浓度为0.025 mg/mL。
本研究使用的多聚赖氨酸溶液浓度差异很大,呈指数级,然而,并未发现多聚赖氨酸具有细胞毒性、抑制细胞生长等现象。分析可能有以下原因:①多聚赖氨酸的细胞毒性并没有其他报道所称的那么大,其细胞相容性良好;②本研究的实验方法尽可能与临床运用相一致,而与所报道的方法不一致,故得出的结论亦不同[22-24]。
综上所述,多聚赖氨酸的细胞毒性较低,利用其对同种异体骨进行表面改性的最佳浓度为0.025 mg/mL,本研究结果为提高同种异体骨在临床应用中的效果提供了重要的实验依据。但本研究是体外实验,细胞周围的环境与体内环境不同,故得出的结果尚不能完全代表体内的实际情况。拟在今后的研究中采取动物体内植入的方法,进行更加深入地观察与分析。

