抗仔猪腹泻重组复合多价疫苗的抗原制备及其条件优化
张恒慧,尤建嵩,贺东亮,邹栋良,赵肖琼,李晓宇,李淑英,徐永平,*
(1. 太原工业学院环境与安全工程系,山西太原030008;2. 大连理工大学生物工程学院,辽宁大连116024;3. 大连赛姆生物工程技术有限公司,辽宁大连116023)
仔猪腹泻影响畜牧业的发展,我国每年因仔猪腹泻导致的死亡率约15%,造成的直接经济损失达10 亿元[1-2]。饲料行业使用大量的饲用抗生素防治仔猪腹泻,导致一系列的细菌耐药性、抗生素残留等,从而影响国民健康和养殖业的高质量发展[3]。2020年,农业农村部已全面禁止饲料中添加抗生素药物。用于防治仔猪腹泻的新型“抗生素替代”方案的研究和应用已经迫在眉睫[4-5]。仔猪腹泻的发病机理是由于产肠毒素大肠杆菌依赖菌毛黏附在肠道继而大量增殖后分泌肠毒素引发的级联反应[6-7]。因此,以腹泻发生过程的两大类抗原肠毒素和菌毛为作用靶点,通过疫苗产生相应抗体的手段可以有效地阻断腹泻的发生,是替代抗生素防治仔猪腹泻的重要潜在方案之一[8]。
本团队在前期的工作中将STa、STb 和LTB 3 种主要肠毒素基因重组连接,去掉肠毒素基因中编码毒性结构域序列,有效保留表达免疫原性的序列,通过原核表达体系构建表达重组三价肠毒素SLS的重组菌[9]。本研究的在前期工作的基础上,研发包含重组三价肠毒素抗原及主要菌毛抗原的复合多价疫苗的抗原的制备工艺条件、提高疫苗中抗原的纯度以及降低抗原的制备成本,从而优化抗原的生产工艺,为疫苗后续的生产及临床免疫试验提供参考。
1 材料与方法
1.1 菌种
三价肠毒素STa-LTB-STb 融合重组菌BL21 由大连理工大学ABTNL 实验室提供;大肠杆菌F4ac 标准菌株C83902 由中国兽药监察所提供;大肠杆菌F5 标准菌株C83914由中国兽药监察所提供。
1.2 试验试剂
改良Minca 培养基(青岛海博生物技术有限公司);TSB 培养基(美国Sigma 公司);酵母粉、蛋白胨(英国Oxoid公司);异丙基-β-D-硫代吡喃半乳糖苷(IPTG)(南京奥生化学技术有限公司);N-三(羟甲基)氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、氨基乙酸、乙二胺四乙酸(EDTA)、过硫酸铵(北京奥博星生物技术有限公司);TEMED(美国Amresco 公司);尿素(ultra)(加拿大Bio Basic Inc.);二硫苏糖醇(DTT)(中国医药上海化学试剂公司);低分子量标准蛋白[宝生物(大连)有限公司]提供;硫酸卡那霉素(Kan)(浙江金华康恩贝生物制药有限公司)。
TE1 缓冲液:10 mmol/L Tris·Cl(pH 值7.0)、1 mmol/L EDTA;TE2 缓 冲 液:50 mmol/L Tris·Cl(pH 值8.0)、10 mmol/L EDTA(pH 值8.0)、100 mmol/L NaCl、0.5%TritonX-100;TE3 缓冲液:50 mmol/L Tris·Cl(pH 值8.0)、1 mmol/L EDTA(pH 值8.0)、100 mmol/L NaCl、4 mol/L 尿素;包涵体溶解缓冲液A:50 mmol/L Tris·Cl(pH 值8.0)、1 mmol/L EDTA(pH 值8.0)、100 mmol/L NaCl、8 mol/L 尿素、10 mmol/L DTT;包涵体溶解缓冲液B:50 mmol/L KH2PO4、1 mmol/L EDTA(pH值8.0)、50 mmol/L NaCl。
1.3 试验仪器
TP600 型PCR 仪[宝生物工程(大连)有限公司];10C型电泳仪、31D 型电泳槽、9405B 型脱色摇床(北京六一仪器厂);PHS-3C 型精密pH 计(上海精密科学仪器);0.45 μm 滤膜(Φ10 cm)(上海市新亚净化器件厂);5804R型低温冷冻离心机(德国Eppendorf);303-4A 型电热恒温培养箱(上海阳光实验仪器公司);FA1004型电子天平(上海越平科学仪器公司)。
1.4 试验方法
1.4.1 菌毛蛋白PCR鉴定
根据表达ETEC 主要菌毛抗原的基因序列,从结构基因中选取保守序列作为目的片段,同时参考文献报道,使用primer 5.0 设计F4 菌毛蛋白基因和F5 菌毛蛋白基因的PCR 引物[10]。上述引物的合成均由宝生物工程(大连)有限公司完成。不同菌毛蛋白基因PCR引物见表1。

表1 不同菌毛蛋白基因PCR引物Tab.1 PCR primers of different fimbria genes
分别将采样的ETEC菌种和F4标准菌株进行纯培养,菌悬液经过离心和PBS洗涤后获得菌体沉淀,再加入超纯水吸混均匀,在100 ℃水浴锅中煮沸10 min,迅速0 ℃冰浴5 min,4 ℃10000 r/min离心10 min,取上清,制备DNA模板[11]。采用20 μL PCR 体系,以各菌株DNA 为模板,分别采用F4菌毛蛋白和F5菌毛蛋白基因的特异性引物进行反应,PCR反应体系成分见表2。
为降低非特异性扩增,提高引物结合率,对PCR 反应条件进行了优化,具体PCR反应条件见表3。
PCR 结束后,通过琼脂糖凝胶电泳来对结果进行观察。每个样品取5 μL PCR 扩增产物与1 μL 6×loading buffer混匀后,上样至1.5%的琼脂糖凝胶,在100 V恒压下电泳40 min。以DNA Marker DL2000为参照,紫外灯下观察扩增片段的大小并分析结果。
1.4.2 重组三价肠毒素蛋白(SLS)的诱导表达、粗提和纯化
将冻存的重组菌BL21 接种于含卡那霉素(Kan)浓度为25 mg/L 的LB 培养基在37 ℃恒温摇床中活化培养12 h;将活化后的种子液以2%的接种量接种于含Kan(终浓度25 mg/L)的LB 培养基中37 ℃振荡培养至菌悬液OD600nm为0.6左右时,根据培养液体积加入IPTG至终浓度为1 mmol/L,继续培养菌体5 h左右,进行重组蛋白的诱导表达[12]。将重组蛋白诱导表达完全的菌液离心收集菌体细胞,加入等体积PBS缓冲液洗涤菌体,重复操作3次后在菌体沉淀中加入原菌液体积1/50倍的TE1缓冲液,吹打均匀至没有凝块,在冰水浴中将菌悬液超声破碎30 min(破碎5 s、暂停5 s),将破碎混合液冷冻离心收集沉淀,即为SLS 重组蛋白粗提物。在重组蛋白粗提物中加入TE2 缓冲液进行洗涤纯化,用移液枪吹洗均匀至没有凝块,在摇床上振荡洗涤20 min,之后4 ℃、7000 r/min 离心20 min,收集沉淀;在沉淀中加入TE3 缓冲液,在摇床上振荡洗涤20 min,随后4 ℃、7000 r/min 离心20 min,收集纯化后的重组蛋白沉淀[13]。

表2 PCR反应体系成分Tab.2 PCR system components

表3 PCR反应条件Tab.3 PCR reaction conditions
1.4.3 重组蛋白空间(三级及以上)结构和抗原性的恢复和方法优化
经过重组表达的蛋白质,在原核表达系统中以包涵体的形式存在,其天然构象被破坏,如若发挥重组肠毒素蛋白的免疫原性,需要经过体外变性和复性处理来恢复其空间结构和天然构象。将纯化后的重组蛋白沉淀重悬至包涵体溶解缓冲A液中,漩涡振荡混合均匀,于37 ℃摇床振荡孵育使重组蛋白颗粒变性溶解;加入3倍体积的包涵体溶解缓冲B 液,用10 mol/L KOH 调节pH 值至9.8,室温下静置30 min 用浓HCl 将溶液pH 值调至8.0,室温下静置40 min 将溶解液离心取上清,4 ℃保存待用。包涵体蛋白在含有8 mol/L 尿素的溶解缓冲A 液的作用下,分子内氢键被破坏,二级以上空间结构发生改变,从而变性溶解。为恢复重组肠毒素的天然构象,需要除去其中添加的变性剂[14]。
本试验分别对比研究常规透析方法以及多重优化方法对重组蛋白复性的效果。首先根据文献报道,采用常规透析方法进行重组蛋白的复性,将变性溶解的重组蛋白溶液稀释至0.5 g/L,依次加入尿素浓度为2.0、1.0、0.5、0 mol/L 4 个梯度的透析液中,4 ℃下透析复性,每个梯度持续12 h;最后两次透析复性液中不加甘油,最终获取纯化、复性后的重组蛋白溶液,SDS-PAGE验证并检测纯化、复性后重组蛋白及其纯度,并用BCA法测取蛋白浓度[15]。
重组蛋白复性效果的好坏关系着重组蛋白能否有效恢复空间构象以及蛋白的纯度、浓度和得率,直接影响后续疫苗使用的效果。在常规透析方法的基础上,本试验对复性条件进行优化,建立稀释-透析-超滤离心多重去除尿素的方法,对重组蛋白进行复性,以提高重组蛋白的纯度和得率。将重组蛋白稀释溶液依次加入尿素浓度为6、4、2、1、0 mol/L 5个梯度的透析液中,4 ℃下透析复性,前4个梯度持续12 h,最后1个梯度持续24 h,再用截留分子量为3 kDa的超滤离心管在4 ℃、5000 r/min条件下对透析液离心处理10 min,检测重组蛋白的纯度和浓度。
1.4.4 F4菌毛蛋白的表达、提取和纯化
本试验分别采用改良Minca培养基、TSB培养基和LB培养基分别培养F4+标准菌株,考察培养基类型的不同对菌毛表达量的影响并且优化F4 菌毛的表达;菌毛的提取和纯化采用热振荡法和等电点沉淀法,经过提纯获得纯化的F4 菌毛蛋白。将F4+标准菌株依次接种于3 种培养基,37 ℃培养36 h 后离心收集菌体,用无菌PBS 溶液洗涤菌体,重复操作3次后将洗涤完成的菌液在60 ℃水浴中温浴30 min,之后立即漩涡振荡10 min,于11000 r/min 离心15 min 后取上清,用0.22 μm 滤膜过滤,收集滤液即为F4菌毛粗提物[16]。用2.5%柠檬酸将菌毛粗提物调pH 值至3.92,4 ℃静置2 h;4 ℃、11000 r/min离心30 min,弃上清,用无菌PBS溶解沉淀,重复操作3次后用SDS-PAGE检测提取液中菌毛蛋白的含量及纯度[17]。
1.4.5 F5菌毛蛋白的表达、提取和纯化
采用F4菌毛蛋白优化后的方法研究F5菌毛蛋白的表达和提取过程。菌毛蛋白纯化过程中,调节F5 菌毛蛋白粗提液pH 值为9.75,再静置离心收集沉淀,最后用无菌PBS溶解沉淀获得F5菌毛蛋白提取液,并检测溶液中菌毛蛋白的含量及纯度[18]。
2 结果与分析
2.1 菌毛类型的PCR检测结果(见图1、图2)
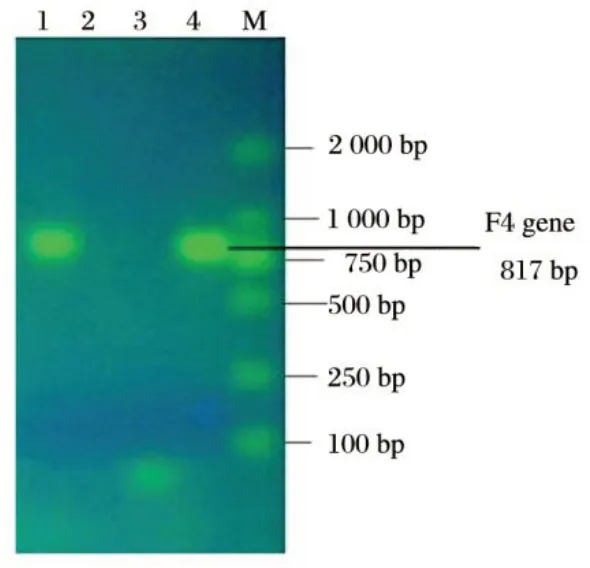
图1 F4菌毛基因扩增结果Fig.1 Results of PCR with F4 gene primer

图2 F5菌毛基因扩增结果Fig.2 Results of PCR with F5 gene primer
由图1可知,采用F4菌毛基因引物对几株大肠杆菌进行PCR 扩增,电泳结果显示F4+菌株在分量子约为817 bp处出现目的条带,而F5+菌株却未出现扩增产物,表明此基因为表达F4 菌毛蛋白抗原的基因,且为F4 菌株独有的特异性抗原。由图2可知,使用F5菌毛基因引物进行PCR扩增后,电泳结果显示F5+菌株在480 bp处扩增出目的条带,F4+菌株未出现扩增产物,表明此基因为表达F5 菌毛蛋白抗原的基因,且为F5+菌株独有的特异性抗原。
2.2 SLS 诱导表达及提纯的SDS-PAGE 检测(见图3、图4)
由图3 可知,对比IPTG 诱导表达前后的全菌电泳图谱,外源基因经IPTG诱导表达后重组蛋白得到大量表达,通过超声破碎获得的重组蛋白以非水溶性的包涵体形式存在,含量占粗提物总蛋白的39.6%;采用常规方法对粗蛋白进行提纯复性后重组蛋白水溶性增加,但是获得的重组蛋白含量较低,经Gel-Pro Analyzer 4.0分析复性后的蛋白溶液中目的蛋白含量仅为11.2%,提纯方法有待优化。
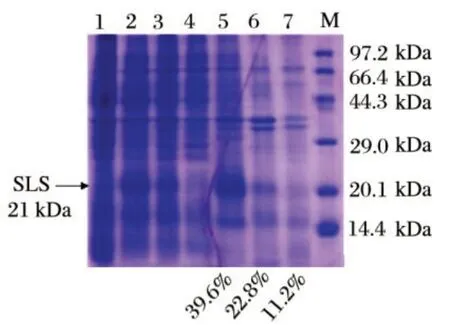
图3 重组三价肠毒素蛋白SLS诱导表达及常规方法提纯的电泳结果Fig.3 SDS-PAGE results of inducible expression and purification of SLS in routine method
由图4可知,泳道6采用优化后的提纯方法,重组蛋白的纯度非常高且无杂带,Gel-Pro Analyzer 4.0分析结果为接近100%,而且同体积菌悬液中重组蛋白的得率也比常规方法有所提高。
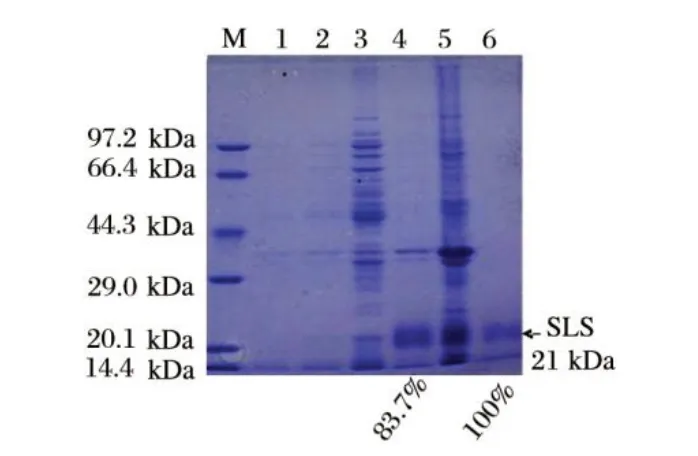
图4 重组三价肠毒素蛋白诱导表达及提纯的优化结果Fig.4 SDS-PAGE result of inducible expression and purification of SLS in optimized method
2.3 F4菌毛的表达和纯化(图5~图7、表4)
在菌毛蛋白抗原的制备过程中,菌毛蛋白的表达量是影响蛋白收率的重要因素。由图5可知,F4菌毛蛋白出现在全菌SDS-PAGE 电泳的28.1 kDa 条带处,经Gel-Pro Analyzer 4.0 软件分析,在相同条件下使用改良Minca培养基培养的F4+标准菌株的F4菌毛表达量要高于LB培养基,计算得目的条带的累积光密度(IOD值)在改良Minca 培养基全菌液中为9.44%高于LB 培养基中的6.61%;菌毛蛋白经温浴、振荡脱落离开菌体,获得粗蛋白溶液,电泳结果显示,改良Minca培养基培养的菌体制的粗提液中菌毛蛋白含量要远高于LB培养基。由图6可知,相同条件下改良Minca 培养基中全菌液目的蛋白含量为59.3%高于TSB 培养基中的48.0%,而且粗提物中菌毛蛋白的含量也更高。因此在改良Minca 培养基中生长的ETEC 菌株菌毛蛋白的表达量要高于LB 培养基和TSB 培养基,而且更利于菌毛蛋白的提取。
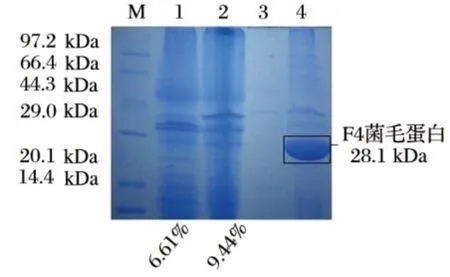
图5 改良Minca培养基和LB培养基表达F4菌毛蛋白的对比效果Fig.5 Comparation of F4 proteins expressed in modified Minca broth and LB broth

图6 改良Minca培养基和TSB培养基表达F4菌毛蛋白的对比效果Fig.6 Comparation of F4 proteins expressed in modified Minca broth and TSB broth
经过热振荡法制得的菌毛蛋白粗提液,采用等电点沉淀法对其进行纯化。F4 菌毛蛋白纯化过程的SDS-PAGE 结果见7。
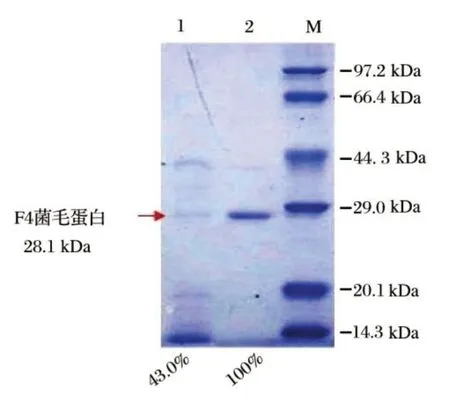
图7 F4菌毛蛋白的纯化(改良Minca培养基)Fig.7 Purification of F4 protein cultured in modified Minca broth
由图7 可知,F4 菌毛蛋白粗提液在pH 值为等电点4.0 下沉淀纯化后,获得纯度很高的菌毛蛋白溶液,电泳结果显示几乎只有目的条带。利用Gel-Pro Analyzer 4.0 软件对F4 菌毛蛋白纯化前后的SDSPAGE 结果进行分析,结果见表4。F4 菌毛蛋白目的条带大小约为28.1 kDa,而且目的蛋白的纯度由纯化前的43.0%上升至纯化后的约100%,纯化效果良好。

表4 Gel-Pro Analyzer 4.0对F4菌毛蛋白纯化分析结果Tab.4 Analysis of purification of F4 protein with Gel-Pro Analyzer 4.0
2.4 F5菌毛的表达和纯化(见图8)
根据几种表达菌毛培养基的优化筛选结果,选用改良Minca 培养基培养F5+标准菌株来制备F5 菌毛蛋白抗原。利用热振荡法获得的F5 菌毛蛋白粗提液,在其等电点9.75 下进行沉淀纯化。由图8a 可知,改良Minca 培养基中生长的F5 全菌电泳结果显示,F5 菌毛蛋白的含量为20%,菌毛表达比较丰富;由图8b 可知,等电点沉淀法获得的F5 菌毛蛋白纯化效果较好,制备了纯度较高的F5 抗原蛋白。
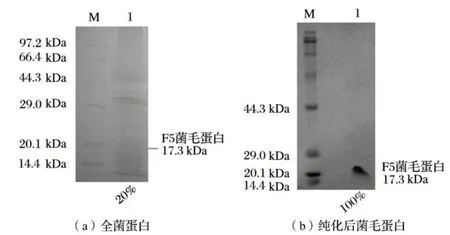
图8 改良Minca培养基培养标准F5+菌株以及菌毛蛋白的纯化Fig.8 F5+ETEC cultivated in modified Minca broth and F5 protein purified
3 讨论
目前,国内外已有的关于仔猪腹泻疫苗大致可以分为:灭活或者减毒的全菌疫苗、菌毛蛋白单价或多价疫苗、类毒素疫苗、能够重组表达单一或多种菌毛和肠毒素的基因工程疫苗及其他新兴疫苗等[19]。无论何种类型的疫苗,其主要抗原还是菌毛和肠毒素。运用基因工程的手段,对几种肠毒素基因进行改造,并导入受体细胞,获得去掉肠毒素致病性并保留其免疫原性的重组肠毒素蛋白,可以作为制备多价疫苗肠毒素抗原的有效途径[20]。再通过菌毛蛋白的高效表达、提取和纯化,可以用来制备肠毒素菌毛复合疫苗的菌毛蛋白抗原。多价复合疫苗的免疫保护将针对腹泻发生的细菌吸附和分泌毒素2个关键致病步骤,包含耐热及不耐热性肠毒素及主要菌毛类型的抗原,将探索预防不同类型ETEC致仔猪腹泻的广适性疫苗。
重组蛋白的表达、提取和纯化是基因工程下游最关键的步骤,直接影响着能否获得大量目的蛋白。以质粒为载体、大肠杆菌为宿主细胞的原核表达体系,通常在表达载体中使用lac启动子,并且采用β-半乳糖苷酶的底物IPTG作为诱导剂,可以按照需求控制菌体的增殖和目的蛋白诱导表达的平衡,通过选取合适的诱导时间以及诱导剂用量,让外源蛋白重组三价肠毒素得以大量的表达。外源蛋白经重组表达后以包涵体的形式存在于细胞内,需经破碎、离心后,再洗涤去除核酸、金属离子等杂质后,溶解于尿素溶液中;在尿素作用下,重组表达的包涵体沉淀氢键被打开,三级结构和四级结构被破坏,溶解性增加;但是想要纯化后的重组三价肠毒素具备免疫原性,需要除去尿素,恢复天然构象。文献报道采用常规透析方法可以对重组蛋白进行纯化除去尿素,但是本研究前期结果表明提纯效率不够高,方法有待优化。经过多次方法改进和试验分析,建立了稀释-透析-超滤离心多重去除尿素的方法,并且获得较好的重组蛋白提纯效果,方便疫苗抗原的制备[21]。
一个完整的大肠杆菌抗原成分复杂,可分为菌体抗原(O)、鞭毛抗原(H)和表面抗原(K)[22]。大肠杆菌表面生长的菌毛就是表面抗原的一种,在不同的培养基条件下,菌毛的表达和生长量有所不同。本研究采用几种大肠杆菌常用的培养基LB培养基、TSB培养基及改良Minca培养基分别对ETEC菌株进行培养;对比相同培养条件下,不同培养获得的菌毛蛋白的表达量有所不同。其中改良Minca培养基中培养的菌株菌毛的表达量最高,其他2种培养基获得的菌毛表达量较差。从培养基配方的差异进行分析,改良Minca培养基中添加锰、镁、铁等微量元素,这些微量元素很有可能就是促进菌体表面菌毛蛋白表达量增加的原因。因此,在提取菌毛蛋白作为抗原的过程中,可以采用改良Minca培养基来培养菌体,以获得表达量较大的菌毛蛋白。
4 结论
试验结果表明,采用优化后的纯化方法,能够有效地提高重组三价肠毒素抗原制备过程中纯度和产率;在制备菌毛抗原的过程中,使用改良Minca培养基来培养产肠毒素大肠杆菌,可以促使F4和F5菌毛蛋白更高效地表达;经恒温振荡、等电点沉淀提取纯化的菌毛抗原蛋白纯度较好,蛋白纯度由粗蛋白的43%提高到约100%,为后续疫苗的制备和免疫效力的临床试验提供数据支持和技术参考。

