适于制备参考菌株用沙门氏菌的鉴定和特性研究
黄巾凌,孟令缘,盛焕精,崔生辉,闫韶飞,李凤琴,杨保伟*
(1 西北农林科技大学食品科学与工程学院 陕西杨凌712100 2 中国食品药品检定研究院 北京102629 3 国家食品安全风险评估中心 北京100022)
沙门氏菌可引起食物中毒,导致肠胃炎、伤寒及副伤寒,是一类重要的食源性致病菌,在公共卫生学上具有十分重要的意义。目前,抗生素仍然是对付包括沙门氏菌在内诸多病原菌的首选。然而,随着抗生素的广泛使用,沙门氏菌的耐药问题日趋严重,给人类和动物健康带来极大威胁[1-3]。长期以来,大量学者以及政府部门对食源性沙门氏菌的药敏性、耐药菌株携带的编码基因做了广泛的调查和监测[4-6],然而仍缺乏在耐药基因检测中用作参比的标准样品。为了更好、更快、更精准地了解介导食源性致病菌携带的耐药基因和相关耐药机制,检测过程标准菌株的使用非常必要。
参考物质(Reference material,RM)是一种已经确定具有1 个或多个特性值的物质或材料,各国管理机构对参考物质的定义和要求表述各有不同。作为高度均匀、良好稳定和量值准确的测量标准,参考物质具有复现、保存和传递量值的基本功能。微生物标准物质是食品类标准物质中特殊的一类,我国微生物标准物质的研制起步较晚,能用于检验检测机构的相关标准物质较少[7-8]。目前已研制出的微生物标准物质主要应用于食源性致病菌的鉴定、病毒和转基因成分检测[9-10],而关于介导相关耐药机制的耐药基因检测用微生物标准物质的研制,仍处于空白,急需开展此类标准物质的研究,以保证食源性致病菌携带的耐药基因检测结果的准确性。
本研究遵循参考菌株研制规范,对前期研究中得到的部分菌株采用多种方法鉴定和研究,以期为参考菌株的制备提供菌株材料。
1 材料与方法
1.1 材料
1.1.1 菌株 118 株沙门氏菌分别于2008、2010、2011、2012年和2013年采集自广东、北京、福建、上海、陕西、河南和四川等地农贸市场和超市的零售食品及医院的临床生物样品(人粪)。沙门氏菌标准菌株(Salmonella Typhimurium)LT2、药敏性测定用质控菌株大肠杆菌 (Escherichia coli)ATCC25922、大肠杆菌(Escherichia coli)ATCC35218 和粪肠球菌 (Enterococcus faecalis)ATCC29212 均为中国药品生物制品检定研究院惠赠。
1.1.2 培养基 LB 琼脂培养基、MHA 培养基,北京陆桥技术股份有限责任公司;XLT4 培养基及其添加液,美国BD 公司。
1.1.3 抗生素 阿莫西林-克拉维酸(Amoxicillin-Clavulanic,AMC)、头孢曲松(Ceftriaxone,CRO)、萘啶酮酸(Nalidixic acid,NAL)、环丙沙星(Ciprofloxacin,CIP)、头孢西丁(Cefoxitin,FOX)、头孢噻呋(Ceftiofur,TIO)、氨苄西林(Ampicillin,AMP)、四环素(Tetracycline,TET)、氯霉素(Chloramphenicol,CHL)、阿米卡星(Amikacin,AMK)、庆大霉素(Gentamicin,GEN)、磺胺异噁唑(Sulfisoxazole,SSS)、卡那霉素(Kanamycin,KAN)、链霉素(Streptomycin,STR)、复方新诺明(Trimethoprim-Sulfamethoxazole,SXT),美国Sigma 公司。
1.1.4 主要试剂和仪器
1.1.4.1 试剂 Taq DNA 聚合酶、10×PCR buffer(Mg 2+free)、MgCl2、dNTP mixture、DL2000 DNA marker、Loading buffer、Gel red,宝生物工程 (大连)有限公司。
1.1.4.2 仪器与设备-80 ℃超低温冰箱 (MDF-3286S),日本SANYO 公司;-40 ℃超低温冰箱(DW-FL208),中科美菱低温科技有限责任公司;4℃冰箱(BCD-205TA),青岛海尔股份有限公司;SW-CJ-1CU 超净工作台,苏州安泰空气技术有限公司;GNP-9080 隔水式恒温培养箱、DGX-9023电热恒温鼓风干燥箱,上海精宏实验室设备有限公司;SB4200DT 微量移液枪,德国Effendorf 公司;LDZX-50KBS 立式压力蒸汽灭菌锅,上海申安医疗器械公司;HH-4 数显恒温水浴锅,北京科伟仪器有限公司;Milli-QSynthesis 超纯水机,德国Millipore 公司;XS204 百分之一天平,瑞士METTLER TOLEDO 公司;BHW-8C 恒温加热器,上海博通股份有限公司;Mycircle 基因扩增仪、GELDOCXR 凝胶成像系统,美国Bio-rad 公司;Hema9600 基因扩增仪,珠海黑马医学仪器有限公司;PJ21C-AN 微波炉,美的集团;DYY-6C 电泳仪,北京六一生物科技有限公司;自动微生物分析系统(VITEK 2 COMPACT 60),法国梅里埃梅里埃公司;AUTO flex 飞行质谱(MALDI-TOF-MS),德国Bruker 公司。
1.1.5 PCR 扩增和测序用引物 19 种β-内酰胺类抗生素耐药相关编码基因PCR 扩增和测序用引物由北京奥科鼎盛生物科技有限公司合成(表1)。

表1 PCR 扩增和测序用引物Table 1 Primers for PCR amplification and sequencing
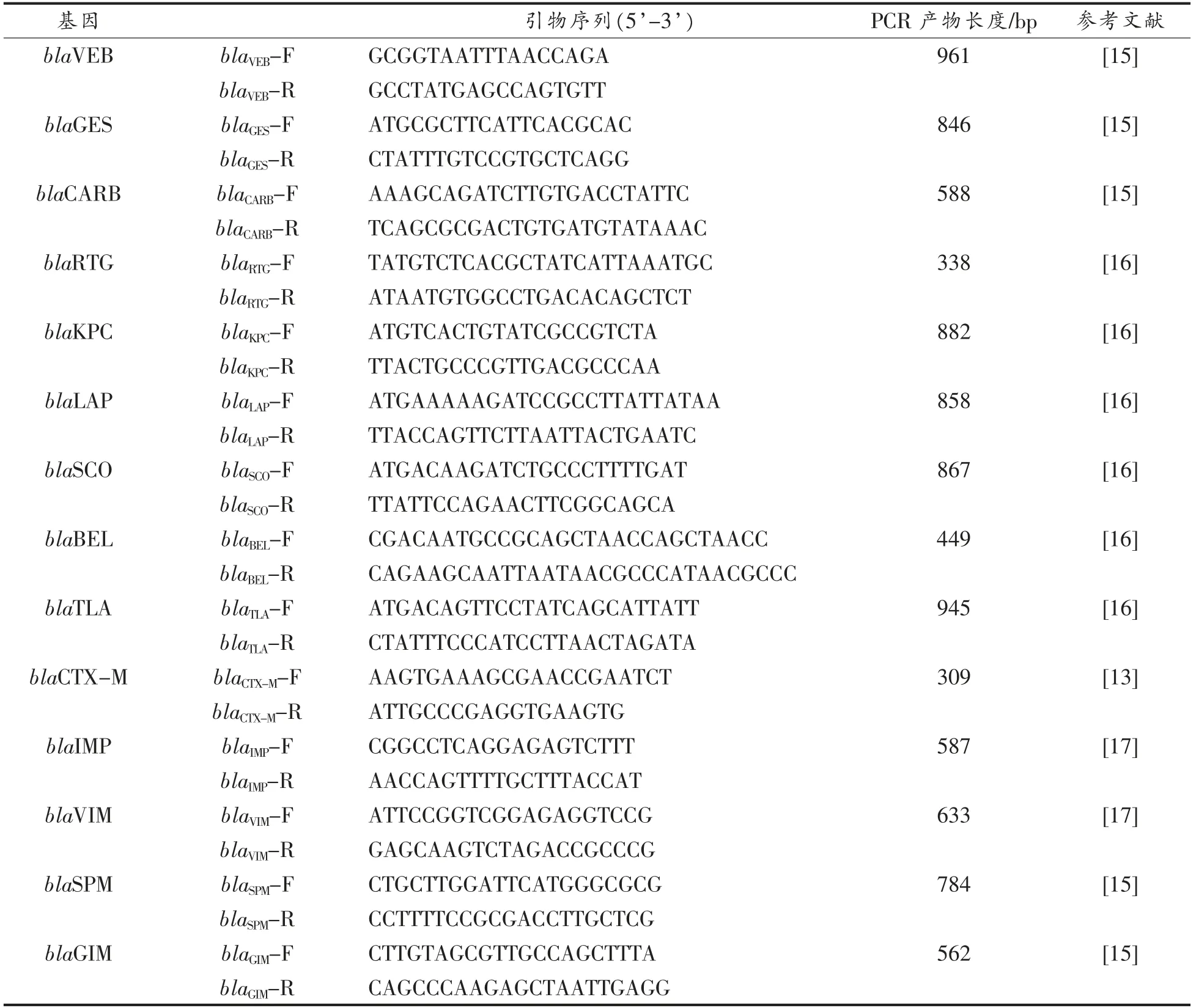
(续表1)
1.2 试验方法
1.2.1 沙门氏菌鉴定
1.2.1.1 革兰氏染色 取洁净载玻片,于玻片中央加一小滴无菌水。接种环火焰灼烧灭菌,冷却后从LB 琼脂培养基的单菌落上挑取少量沙门氏菌与玻片上的水滴混匀,涂成直径10~15 mm 稀薄而均匀的圆形菌膜,自然干燥后将玻片有菌的一面向上,在酒精灯外焰上加热固定[18]。在涂片上滴加适量草酸铵结晶紫染色液,初染60 s,水洗;除尽水滴后在涂片上滴加碘液,媒染60 s,水洗,除尽水滴;再在涂片上滴加乙醇,脱色25~30 s,水洗,除尽水滴;在细菌涂片上滴加番红染色液,复染30~60 s,水洗;自然干燥后镜检。染色中使用金黄色葡萄球菌 ATCC29213 和大肠杆菌ATCC25922 分别作为革兰氏阳性菌和革兰氏阴性菌的质控菌。
1.2.1.2 VITEK 生化鉴定 VITEK 生化鉴定在国家食品安全风险评估中心完成。鉴定时将沙门氏菌接种于LB 琼脂培养基,37 ℃培养24 h 后,挑取新鲜培养的菌落,制备菌悬液,接种VITEK COMPACT 2 菌种鉴定卡。依照操作说明书方法鉴定。
1.2.1.3 MALDI-TOF-MS 鉴定 MALDI-TOFMS 鉴定在国家食品安全风险评估中心完成。将沙门氏菌接种于LB 琼脂培养基,37 ℃培养18~24 h后,挑取新鲜培养的菌落,按照质谱鉴定操作说明,将待鉴定菌株涂布于MALDI-TOF-MS 靶板上,在靶孔加上HCCA 基质(1 μL/孔),待基质晾干后,将靶板放入质谱仪工作室进行鉴定。
1.2.1.4 16S rDNA 基因扩增、序列测定和分析采用煮沸法制备PCR 用DNA 模板[19]。PCR 反应条件为:94 ℃,10 min;94 ℃,1 min;退火温度下1 min;72 ℃,1 min;35 个循环;72 ℃,10 min。PCR 反应的退火温度因扩增基因引物序列组成而定。2 μL PCR 产物经琼脂糖凝胶电泳检测后,在凝胶成像系统拍照留存。阳性PCR 产物在低温条件下送至上海桑尼生物科技有限公司测序,测序数据通过BLAST 在线软件进行分析和对比(http://www.ncbi.nlm.nih.gov/BLAST/)。
1.2.2 药敏性测定 采用临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)[20]推荐的琼脂稀释法测定15 种抗生素对沙门氏菌的最小抑菌浓度 (Minimum Inhibitory Concentrations,MICs),按照CLSI 规定的标准判读药敏结果,确定耐药表型。供试抗生素名称、使用浓度范围和耐药折点如表3所示。药敏性测定中使用大肠杆菌ATCC25922 和ATCC35218,粪肠球菌ATCC29212 作为质控菌株。
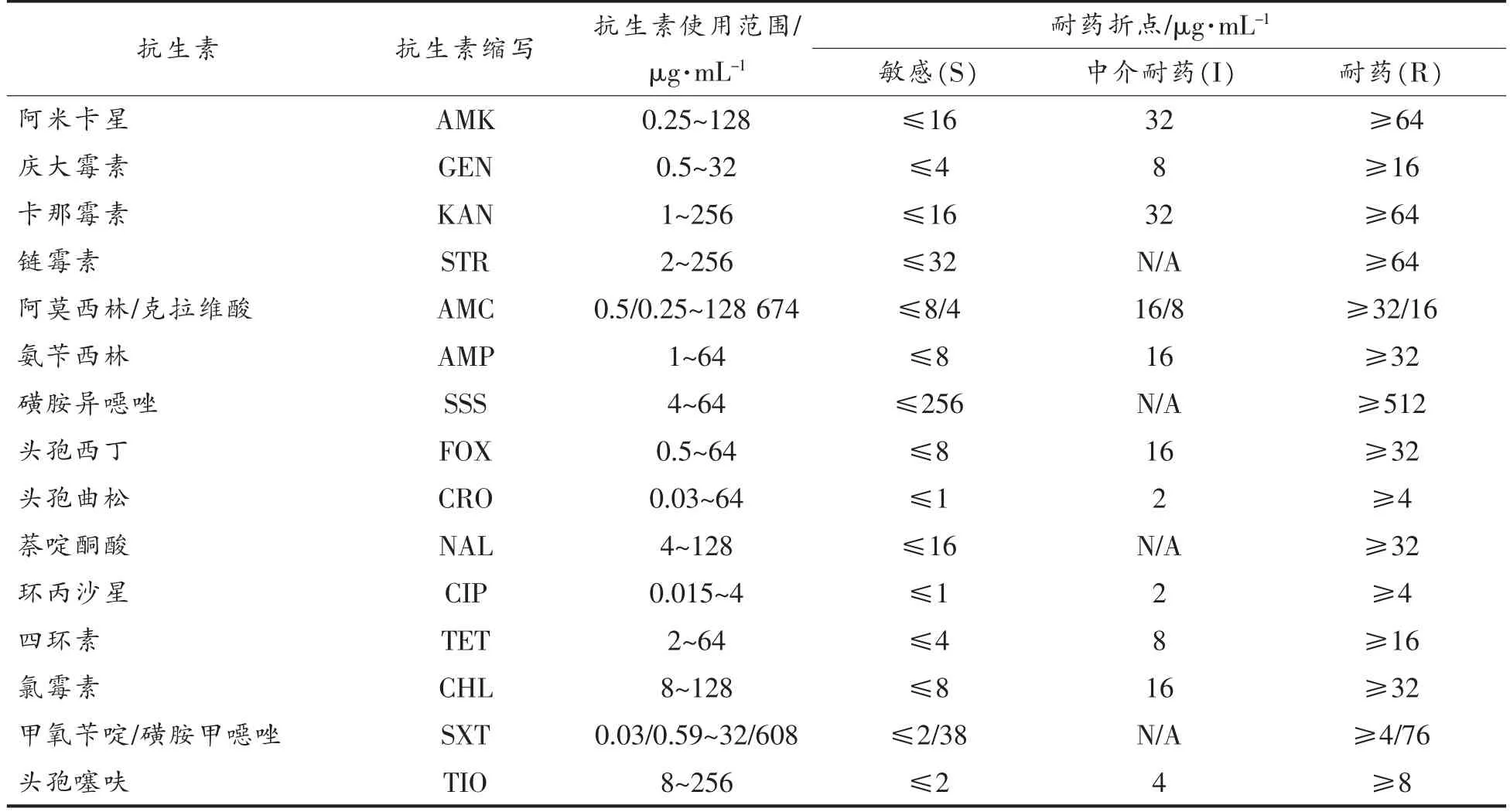
表2 抗生素种类、使用范围和耐药折点Table 2 The category,concentration range and breakpoint of the antibiotic used for susceptibility test
1.2.3 菌株传代培养及目标基因遗传稳定性测定基于沙门氏菌的基因型、携带的与β-内酰胺类抗生素耐药相关基因的种类及耐药表型等结果,从118 株沙门氏菌中挑选出12 株代表性沙门氏菌进行传代培养,随机选择其1,3,6,9,12,15 代菌株,检测其β-内酰胺类抗生素耐药相关编码基因的遗传稳定性。具体方法:将冻存管内保藏的原代菌株划线接种于LB 琼脂培养基,37 ℃恒温培养18~24 h,即为1 代菌株;从每个1 代菌种培养物中随机挑取3~5 个单菌落,分别划线接种于另一LB 琼脂培养基中继续培养。同时从该3~5 个单菌落中取菌,制做PCR 模板,对目标基因进行扩增和序列分析,检测在传代过程中目标基因有无丢失或发生变异。重复此步骤传代至15 代,以检测目标基因的遗传稳定性。
1.2.4 数据统计分析 利用Microsoft Office Excel 2010 对试验所得数据进行处理和作图,使用IBM SPSS Statistics 20.0 进行多因素方差分析(Duncan 法,P<0.05)和多元回归分析。
2 结果与分析
2.1 菌株鉴定
2.1.1 形态学鉴定 118 株沙门氏菌在XLT4 培养基上生长良好,菌落呈黑色,具有金属光泽(图1a)。革兰氏染色结果为粉红色短杆状细胞,革兰氏阴性(图1b)。
2.1.2 生化鉴定
2.1.2.1 VITEK COMPACT 2 鉴定 Vitek 鉴定结果表明118 株菌均为沙门氏菌,其中44(37.29%)株鉴定结果为99%可能性,43(36.44%)株为98%可能性,且二者无显著性差异(P>0.05),然而以上2 种可能性的菌株比例显著(P<0.05)高于可能性在95%~97%之间的菌株 (31,26.27%)(图2,表3)。1 株沙门氏菌被鉴定为肠炎沙门氏菌,达到种鉴定水平,其余117 株均达到属鉴定水平。
2.1.2.2 MALDI-TOF MS 鉴定 MALDI-TOF MS鉴定结果表明118 株菌均为沙门氏菌,全部可鉴定至属水平(表3),其中1 株菌的鉴定图谱如图3所示。
2.1.3 16S rDNA 鉴定 16S rDNA 基因PCR 扩增、测序和Blast 在线比对分析结果表明118 株菌均为沙门氏菌,可鉴定至属水平(表3)。118 株沙门氏菌16S rDNA 序列同源性在98.50%~99.90%之间。
2.2 沙门氏菌药敏性
沙门氏菌对氨苄西林、磺胺异噁唑和头孢噻呋的耐药最为普遍,耐药菌株比例间无显著性差异(P>0.05;比例均为100.00%);对四环素和萘啶酮酸等7 种抗生素的耐药率均在50%以上,然而对不同抗生素耐药的菌株比例间存在显著性差异。耐阿米卡星、庆大霉素和阿莫西林/克拉维酸的菌株比例较低,对环丙沙星和头孢西丁比较敏感(表4)。
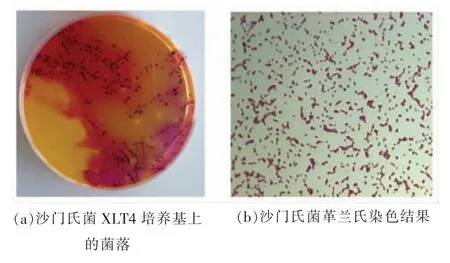
图1 菌株的生长形态与革兰氏染色结果Fig.1 Growth morphology and Gram staining result of the strain
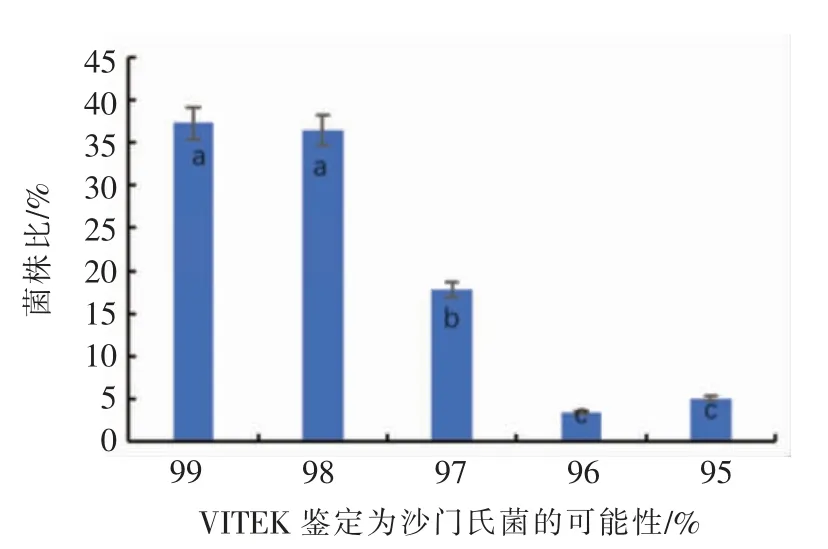
图2 VITEK COMPACT 2 生化鉴定结果(n=118)Fig.2 VITEK COMPACT 2 biochemical identification results (n=118)
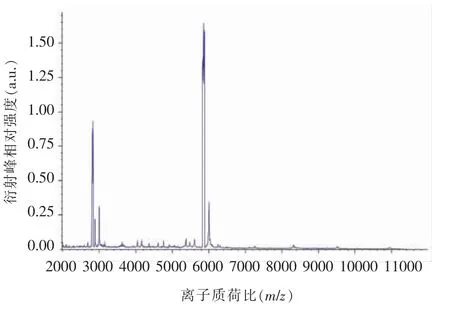
图3 1 株沙门氏菌MALDI-TOF MS 鉴定图谱Fig.3 MALDI-TOF MS identification spectrum of one strain of Salmonella isolate

表3 3 种试验鉴定结果分析Table 3 Analysis of 3 kinds of experimental identification results
2.3 β-内酰胺类抗生素耐药相关基因及其遗传稳定性
2.3.1 沙门氏菌中与β-内酰胺类抗生素耐药相关基因的检出率 在118 株沙门氏菌中共检出8种与β-内酰胺或/和超广谱β-内酰胺(Extended spectrum β-lactams,ESBLs) 类抗生素耐药相关的编码基因,分别为:blaTEM-1、blaTEM-116、blaOXA-1、blaC-TX-M-3、blaCTX-M-55、blaCTX-M-123、blaCTX-M-64和blaCTX-M-15。其中,76(64.41%)株沙门氏菌携带blaTEM-1,携带其它基因的菌株及相应的检出率分别为blaCTX-M-55(50.85%)、blaOXA-1(16.10%)、blaCTX-M-3(15.25%)、blaCTX-M-15(1.69%)、blaTEM-116(1.69%)、blaCTX-M-123(0.85%)和blaCTX-M-64(0.85%)。blaTEM-1检出率最高,显著高于blaTEM-116、blaOXA-1、blaCTX-M-3、blaCTX-M-55、blaCTX-M-123、blaCTX-M-64和blaCTX-M-15阳性菌株的检出率(P<0.05),见图4。
2.3.2 blaTEM-1、blaOXA-1和blaCTX-Ms遗传及表达稳定性 12 株携带β-内酰胺酶编码基因的代表性沙门氏菌涵盖爱丁堡、肠炎、汤普森、舒卜拉、印第安纳、乌普萨拉和阿伯尼等7 种血清型,每个血清型的沙门氏菌至少携带2 种β-内酰胺类抗生素耐药相关编码基因。菌株传代、目标基因PCR 扩增及序列比对分析结果表明,传代过程中目标基因未丢失,未发生任何基因变异,证明blaTEM-1、blaOXA-1和blaCTX-Ms基因在菌株1~15 代遗传过程中可非常稳定的存在(图5)。
3 讨论
诸多食品安全风险中,微生物污染已成为全球公认的首要威胁,基于这一问题,很多国际组织相继制定了食品中微生物的限量标准与检测方法[1-3]。在我国,随着国家对食品安全问题的日益重视,食品检验方法也逐渐趋于标准化,先后制定了GB4789 系列食品安全国家标准[21]。由于食品安全检验工作的重要性,因此检验过程和结果需要更加规范化,而作为检验标尺的参考物质则成为聚焦点。此外,我国食品安全战略对微生物鉴定、分型、耐药和溯源类参考物质也有着迫切需求[22-23]。
然而,食品微生物类参考物质目前却基本停留在由菌种保藏机构提供纯菌种的初级阶段,且这些菌种保藏机构均未将食品微生物作为主要收藏对象,致使与食品监督抽验和中毒等相关的重要微生物资源严重缺失。国外权威机构,如:法国梅里埃公司和欧盟联合实验室,虽已开始制备Bioball 微球等定量或定性微生物参考物质,然而由于生物安全问题,这些参考物质在国际共享过程中出现许多困难[24-25]。我国《食品安全国家标准食品微生物学检验总则》(GB 4789.1-2016)[26]中明确要求定期使用阳性对照对检验过程进行质量控制,同时在《检测和校准实验室能力认可准则在微生物检测领域的应用说明》(CNAS-CL09-2013)[27]中也明确要求使用微生物标准物质或者质控样品对微生物检验进行质量控制。因此,对食品中微生物及相关特性检测用标准物质的研发势在必行。

表4 沙门氏菌的药敏性(n=118)Table 4 Antibiotic susceptibility of Salmonella(n=118)
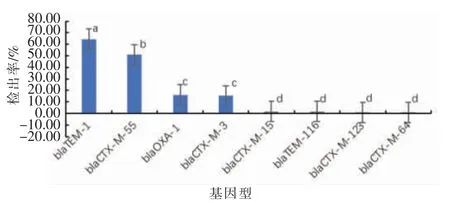
图4 8 种基因在沙门氏菌中的检出率(n=118)Fig.4 Detection rates of eight genes in Salmonella (n=118)
近几年,我国虽在食品、环境和临床等领域研发了多项参考物质[28-32],建立了国家参考物质资源共享平台,然而由于微生物自身易受污染、变化快、内部代谢机制复杂的特点,使得平台上适用于食品微生物检测的参考物质较少。另外,由于微生物为活体物质,参考物质制备时必然具有其特殊性,即:均匀性和稳定性难控制,制备程序和工艺复杂,定值和不确定度评估困难,因此,相对来讲我国目前关于微生物类参考物质的研究总体较少。据文献报道,骆海朋等[9]、瞿洪仁等[10]已研制出阪崎克罗诺杆菌和单增李斯特氏菌标准物质。国内少数机构也逐步开展了带有食品基质的微生物参考品研究,然而由于参考物质溯源性不强,不确定度评价模式单一等严重缺陷,导致同一样品的检测值参差不齐,无法为食品检验数据提供技术保障。

在食源性致病菌的研究中,要对微生物某一特性进行检测,其编码基因往往被作为靶标。而用作该靶标检测的标准菌株不仅必须携带该编码基因,而且该编码基因必须在菌株传代、培养、贮藏和交换过程能够稳定存在。围绕这一目标,本研究的最终目的是筛选出可用于β-内酰胺类抗生素抗性菌株相关耐药机制检测用参考菌株制备的候选菌株,因此对这些菌株的鉴定、菌株特性及其携带相关基因遗传稳定性的研究极其重要。本试验根据微生物参考菌株制备要求及相关流程,首先对118 株不同来源的沙门氏菌采用4 种方法进行鉴定,并检测其药敏性,结合前期获得的样品来源、采样时间、采样地点,基于脉冲场凝胶电泳(Pulse field gel electrophoresis,PFGE) 的基因型和中国医学细菌保藏管理中心(CMCC)标准菌株编号等信息,最终筛选出12 株代表性沙门氏菌作为制备参考菌株的潜在菌株。试验结果表明,这12 株沙门氏菌的相关特性均符合标准物质制备要求,具有进一步制备β-内酰胺类抗生素抗性菌株相关耐药机制检测用参考菌株的条件,完全满足制备用于β-内酰胺类抗生素抗性编码基因检测用标准菌株的可能性。后期,将进一步对其进行冷冻干燥、瓶间菌数不确定度及贮藏稳定性试验,最终形成已定量的即用型活体菌株,获得国家级标准物质证书,用于快检和临检。

图5 bla 基因的稳定遗传性Fig.5 The stable inheritability of bla genes

