高产胞外多糖嗜热链球菌的筛选及胞外多糖的结构分析
陈海燕,李嘉雯,李 婷,刘 洋,田佳乐,丹 彤
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室 呼和浩特010018)
乳酸菌胞外多糖(Lactic acid bacteria extracellular polysaccharide,LAB EPS) 是乳酸菌在生长代谢过程中分泌到细胞壁外,常渗于培养基的一类水溶性多糖[1],属于微生物胞外多糖的一种。其可以作为细胞结合的多糖附着在菌体表面,称为荚膜多糖(Capsular polysaccharide,CPS),或者作为释放的胞外多糖分泌到周围的培养基中形成黏液,即称为黏液多糖(Slimpolysaccharide,SPS)[2]。迄今为止报道的大多数产生EPS 的菌株产生SPS,而一些LAB 菌株可以同时产生CPS 和SPS[3-4]。
目前,虽有很多关于动物、植物和真菌多糖的研究报道[5-8],但来自嗜热链球菌的EPS 特别受到关注,主要因为它们 “普遍被认为是安全的”(GRAS)菌株和它们对人类的有益影响[9-10]。嗜热链球菌能够改善原料的风味、香气、质地和安全性,更重要的是其代谢产物中EPS 具有的特殊生理功能,如抗肿瘤,抗氧化、免疫刺激活性[11-13]以及作为增稠剂代替非食品级生物(黄原胶、结冷胶、支链淀粉等)的潜在用途,而使其广泛应用于各个领域[14]。EPS 类型多样,结构复杂,不仅决定自身的溶解度、分布、支化度和链构象等物理性质,还是研究其构效关系和结构修饰的基础。
当前,关于LAB EPS 的分离、提取及结构分析成为研究热点。本研究从传统发酵乳制品分离得到的442 株嗜热链球菌中筛选的1 株高产EPS嗜热链球菌MGD1-4 为研究对象,通过乙醇沉淀、DEAE-52 纤维素离子交换柱层析、Sepharose CL-6B 分子筛层析、高效液相色谱(High performance liquid chromatography,HPLC)、红外光谱(Infrared spectrum,IR)及核磁共振(Nuclear magnetic resonance,NMR)等方法对菌株所产EPS 进行分离、纯化和结构分析,探明其分子结构及理化性质,为深入解析EPS 结构与功能关系打下基础,为乳酸菌资源开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 嗜热链球菌 (Streptococcus thermophilus)MGD1-4,由本实验室提供。为筛选出的高产胞外多糖菌株,呈冻干粉末状,-80 ℃保藏。
1.1.2 试剂 DEAE-Cellulose 52,Coolaber 公司;Sepharose CL-6B,美国Sigma 公司;透析袋(8000-14000 DA),Solarbio 公司;氯化钠、氢氧化钠、无水乙醇,天津市汇杭化工科技有限公司;三氯乙酸、浓硫酸、盐酸、苯酚、亚铁氰化钾、乙酸锌、3-甲基-1-苯基-5-吡唑啉酮(PMP)、三氯甲烷均为分析纯级试剂。
1.1.3 设备与仪器 超净工作台,上海智城分析仪器制造有限公司;CBS-B 型程控多功能全自动部分收集器、DHL-BN 型电脑恒流泵、TH-500A梯度混合器,上海青浦沪西仪器厂;SCIENTZ-10N型真空冷冻干燥机,宁波新芝生物科技股份有限公司;DL-6M 型高速冷冻离心机,cence 湘仪集团;UV-1700 型紫外分光光度计,日本SHIMADZU 公司;ELEOS System 凝胶色谱仪 【配有Waters 515 泵,激光检测器(LS) 和示差检测器(DRI)】,美国Wyatt 公司;TM 4000Plus 型扫描电镜,日本HITACHI 公司;IR Affinity-1 型傅里叶变换红外光谱仪,日本SHIMADZU 公司;Agilent 1200 高效液相色谱仪,美国Agilent 公司;Bruker AV-500 型核磁共振仪,德国Bruker 公司。
1.2 方法
1.2.1 嗜热链球菌的活化 取-80 ℃保存的MGD1-4 菌株活化后以2%接种量接入M17 液体培养基[15],37 ℃恒温培养36 h,传代2 次,4 ℃备用,使菌株活力最高。
1.2.2 高产胞外多糖嗜热链球菌的筛选 将活化3 代后的嗜热链球菌MGD1-4 以2%的接种量接种于50 mL M17 液体培养基,37 ℃培养36 h,发酵液沸水浴灭活 (30 min),冷却至室温;离心(12 000×g,30 min) 除去菌体和酶解蛋白等杂质;取上清液,边搅拌边加入80.0%三氯乙酸溶液至终含量为4.0%,4 ℃静置过夜,离心(12 000×g,30 min)除去剩余的变性蛋白;取上清液边大力搅拌边加入3 倍体积95%的冰乙醇,4 ℃静置24 h,再次离心(12 000×g,30 min)取沉淀,用适当去离子水将其复溶,溶液透析48 h,每8 h 换1 次水,然后将透析液称量、定容、稀释,测定其多糖含量。
1.2.3 EPS 含量的测定 采用苯酚浓硫酸法[16]测定EPS 含量。
1.2.4 嗜热链球菌MGD1-4 粗多糖的制备 将活化3 代后的MGD1-4 按2%的接种量接种于大量(约10 L)M17 液体培养基,37 ℃培养36 h,然后以1.2.2 节方法制备粗多糖,透析液经冷冻干燥得EPS 粗品。
1.2.5 嗜热链球菌MGD1-4 粗多糖的分离纯化
1.2.5.1 DEAE-Cellulose 52 离子交换色谱分级纯化[17]将100 g 室温浸泡过夜,经酸碱处理且去离子水反复清洗至pH 值呈中性的DEAE-Cellulose 52 装填于规格为1.6 cm × 50 cm 的色谱柱中,用去离子水充分平衡1 d(流速1.0 mL/min)。每次称取100 mg 粗EPS 溶于5 mL 去离子水(质量浓度20 mg/mL),用0.45 μm 滤膜过滤后上样。分别用去离子水和0~1 mol/L NaCl 缓冲溶液线性洗脱(流速0.8 mL/min),每管8 min。以苯酚-硫酸法(A490nm)检测各管的多糖含量,绘制洗脱曲线。根据峰型收集相同组分,以流动的去离子水透析去除残留的NaCl 和小分子物质,冷冻干燥,多次累积纯化得到初步的EPS 纯化组分。
1.2.5.2 Sepharose CL-6B 凝胶柱层析纯化 使用去离子水反复清洗Sepharose CL-6B,浸泡至充分溶胀。将处理好的Sepharose CL-6B 装入1.6 cm×50 cm 色谱层析柱,用去离子水充分平衡。分别称取初步纯化的多糖单一组分30 mg 溶于3 mL 去离子水(质量浓度10 mg/mL)中,用0.45 μm滤膜过滤后上样。去离子水洗脱 (流速0.4 mL/min),分步收集(8 min/管)。按1.2.5.1 节方法逐管检测,分别合并收集单一峰组分,用去离子水透析,真空冷冻干燥。
1.2.6 嗜热链球菌MGD1-4 EPS 分子质量测定 凝胶色谱仪操作方法:打开仪器电源,待仪器各部分自检完成后设定各参数。将溶解的多糖样品经0.22 μm 滤膜过滤,上机检测。
凝胶色谱仪检测条件:检测器为激光检测器(LS)和示差检测器(DRI),流动相为0.2/1000 的叠氮化钠,色谱柱为Shodex OHpak 系列SB-806与SB-803 串联,流速1 mL/min,柱温40 ℃,进样量500 μL。
1.2.7 嗜热链球菌MGD1-4 EPS 红外光谱分析取各EPS 组分纯品2 mg,加入200 mg 干燥后的KBr 粉末,用“KBr 压片法”在400~4 000 cm-1范围红外扫描,扫描分辨率为4 cm-1。
1.2.8 嗜热链球菌MGD1-4 EPS 各组分扫描电镜观察 取纯化的EPS 组分各1 mg,以片状形式均匀粘贴于含有导电胶的样品铜台上,置真空喷锻仪内镀一层导电金,取出后用扫描电镜在不同倍数下观察多糖各组分结构。
1.2.9 嗜热链球菌MGD1-4 EPS 单糖组成分析分别称取一定量纯化的多糖组分,用30 mL 去离子水溶解,缓慢加入亚铁氰化钾溶液和乙酸锌溶液各5 mL,再次加去离子水至80 mL,室温振荡1 h,离心,干燥滤纸过滤,溶液定容100 mL。分别取适量样品加入0.5 mL 4 mol/L 三氟乙酸(Trifluoroacetate,TFA),在120 ℃条件下水解2 h,氮气吹干,分别加入0.3 mol/L NaOH 和0.5 mol/L PMP(甲醇溶解)各0.5 mL,70 ℃水浴60 min,冷却至室温,然后加入0.5 mL 0.3 mol/L HCl 和0.5 mL 三氯甲烷,振荡摇匀后静置20 min,弃下层氯仿层,萃取3 次,将水层经0.45 μm 滤膜过滤除去不溶物,做高效液相色谱分析。
高效液相色谱分析条件:Agilent 1200 高效液相色谱仪,检测波长245 nm,色谱柱为SHISEIDO C18(4.6 mm×250 mm×5 μm),紫外检测器,流速1.0 mL/min,柱温25 ℃,进样量10 μL。
1.2.10 核磁共振分析 取充分干燥的MGD1-4 EPS 纯化组分EPS-1a 和EPS-3a 各30 mg,加入500 μL D2O,待溶解完全后依次加入核磁管,用500 MHz AVANCE 型核磁共振仪分析1D NMR,包括1H NMR 和13C NMR。以四甲基硅烷(TMS)为内标,25 ℃检测,化学位移(δ)用10-6表示。
2 结果与分析
2.1 高产胞外多糖嗜热链球菌的筛选
采用苯酚浓硫酸法测定442 株嗜热链球菌液体培养基中EPS 产量,最终筛选出1 株高产胞外多糖嗜热链球菌MGD1-4。利用分光光度计在波长490 nm 处测定吸光度,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制葡萄糖标准曲线:y=0.025x+0.0208(R2=0.9979)。该菌株胞外多糖含量为404.663 mg/L。
2.2 DEAE-Cellulose 52 离子交换色谱分级纯化结果
菌株MGD1-4 的粗多糖经DEAE-52 离子交换柱分离得到4 个组分(EPS-1、EPS-2、EPS-3 和EPS-4)(图1)。其中EPS-1 和EPS-2 是由去离子水洗脱得到的产物,说明二者不带电荷,为中性多糖;后2 个组分是以不同浓度的NaCl 为流动相的洗脱产物,即带有负电荷的酸性多糖或带有酸性基团的糖复合物[18-19]。由于EPS-2 和EPS-4 在收集过程中糖含量太少,难回收,因此分别收集2 个主要峰EPS-1 和EPS-3 对应的洗脱液,用去离子水透析脱盐,冷冻干燥后二者的得率分别为15.10%和27.08%。密封冷冻保存待进一步纯化。

图1 MGD1-4 粗EPS 经DEAE-Cellulose 52离子交换色谱柱梯度洗脱曲线Fig.1 Stepwise elution curve of crude EPS from MGD1-4 on DEAE-Cellulose 52 chromatography column
2.3 Sepharose CL-6B 凝胶柱层析纯化结果
将第1 步收集到的2 个组分(EPS-1、EPS-3)用Sepharose CL-6B 凝胶柱分离、纯化。由图2可知,分离后的2 个组分均呈单一对称峰,表明二者均为单一且相对分子质量均一的组分,同时命名为EPS-1a 和EPS-3a,冷冻干燥,计算得率分别为37.93%和38.46%。
2.4 各EPS 纯化组分的纯度鉴定及分子质量测定
如图3所示,多糖组分EPS-1a 和EPS-3a 经凝胶色谱仪的双检测器检测后均呈现单一对称峰,该结果与Sepharose CL-6B 凝胶柱层析的纯化结果一致,说明2 个多糖组分均为单一多糖。二者的重均分子质量分别为1.572×105u 和3.825×105u。

图2 EPS-1a(a)和EPS-3a(b)经Sepharose CL-6B色谱柱的洗脱曲线Fig.2 Elution curves of EPS-1a(a) and EPS-3a(b)on Sepharose CL-6B chromatography column
2.5 EPS-1a 和EPS-3a 的红外光谱分析
如图4a 所示,EPS-1a 在3 329.98 cm-1处出现的强而宽的吸收峰为羟基的O-H 伸缩振动;在2 940.43 cm-1处是烷基C-H 键的伸缩振动吸收,表明EPS-1a 是多糖类物质。在1 648.84 cm-1处出现的吸收峰是羧基C=O 键的非对称伸缩振动。在1 400 cm-1和1 300 cm-1之间的弱吸收峰是羧基C=O 键的对称伸缩振动,说明EPS-1a 含有羧基基团。另外,在1 145.51~1 028.36 cm-1间的3 个吸收峰是吡喃糖环的特征吸收峰,与多糖骨架C-O-H 和C-O-C 的伸缩振动相对应。858.17 cm-1处的吸收峰是吡喃环的α-型端基的C-H 变角振动,说明EPS-1a 含有吡喃糖环残基和α-型糖苷键。在931.45 cm-1处出现D-葡萄吡喃糖C-O-C 的非对称伸缩振动吸收峰。

图3 EPS-1a(a)和EPS-3a (b)的GPC 图谱Fig.3 GPC chromatogram of EPS-1a(a)and EPS-3a(b)
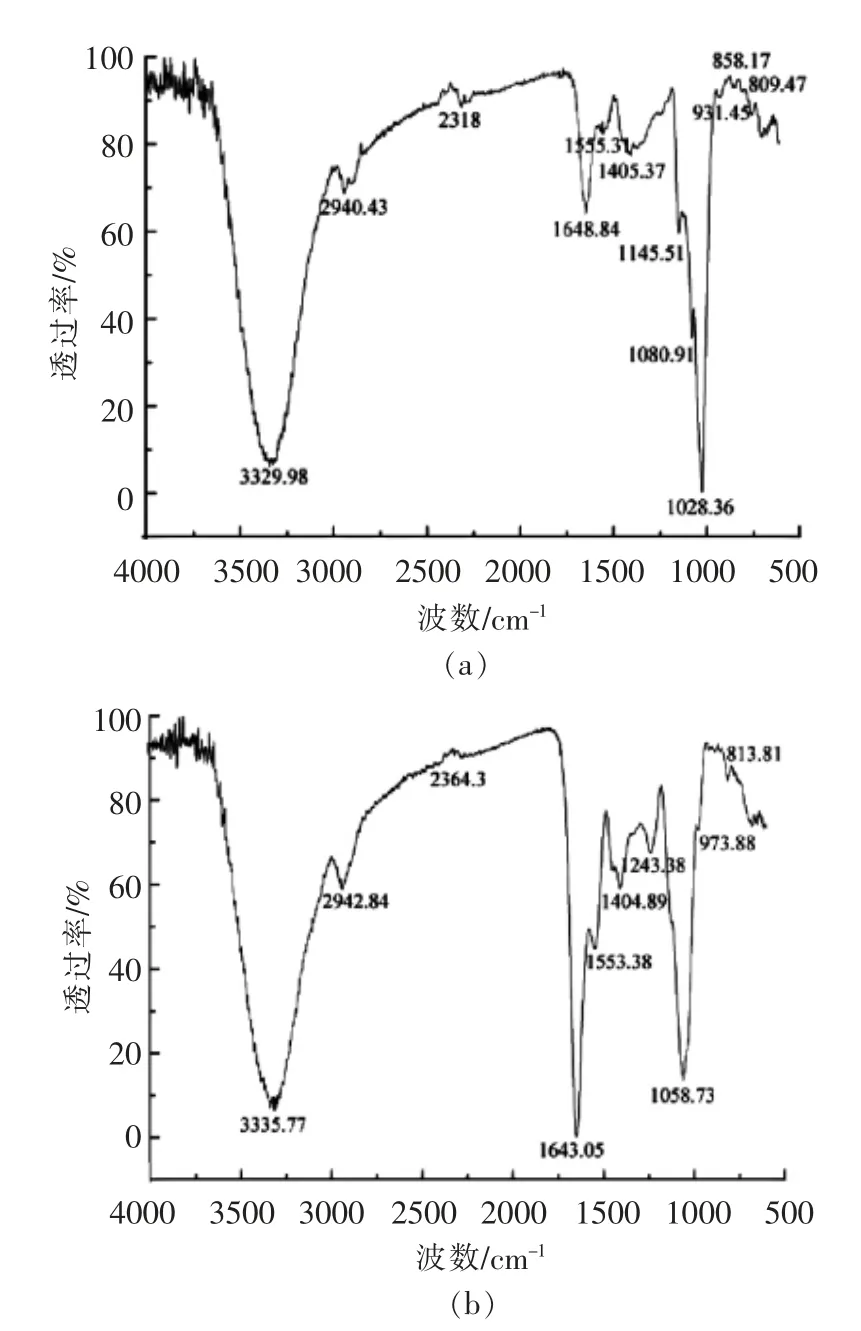
图4 EPS-1a(a)和EPS-3a(b)的红外光谱图Fig.4 FT-IR spectrum of EPS-1a (a)and EPS-3a (b)
如图4b 所示,EPS-3a 在3 335.77 cm-1处出现的强而宽的吸收峰是由羟基的O-H 键伸缩振动而引起;在2 942.84 m-1处的峰是烷基C-H 键的伸缩振动吸收,在1 400 cm-1左右为C-H 的弯曲振动吸收峰;在1 500 cm-1左右的吸收峰为CO 键伸缩振动的结果;在1 643.05 cm-1处出现的强吸收峰是羧基的C=O 键的非对称伸缩振动;在1 300 cm-1处出现的弱吸收峰是羧基的C=O 键的对称伸缩振动;1 200~1 000 cm-1范围出现吡喃糖环的3 个特征吸收峰;1 126.38 cm-1和1 058.73 cm-1是吡喃糖苷的特征吸收峰,这两处的吸收是C-O-C 结构中C-O 键或C-O-H 的弯曲振动;813.81 cm-1处出现的峰可能为α-D-半乳吡喃糖的特征吸收峰。
2.6 多糖组分EPS-1a 和EPS-3a 的扫描电镜结果
由图5可知,在3 个倍数的扫描电镜下看到的EPS-1a 组分(如图5a,5b,5c),聚集状态呈现松散的多孔网状且高度分支结构,分布杂乱无章、不规则性,形态似树枝的枯叶与枯干。相比EPS-1a,EPS-3a 组分(如图5d,5e,5f)多糖表面光滑且有光泽,二者形态特征有所不同,该组分由多个含有圆滑小球的细长的杆组成,总体结构以光滑的片状连接,即使增加放大倍数,其微观结构表面仍光滑,形态均一,分布规整。

图5 EPS-1a (a,b,c)和EPS-3a (d,e,f)的扫描电镜图Fig.5 SEM images of EPS-1a (a,b,c)and EPS-3a (d,e,f)
2.7 EPS-1a 和EPS-3a 的单糖组成分析
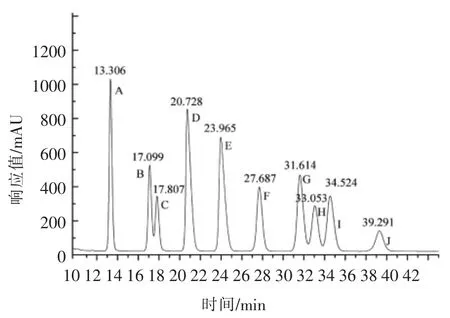
图6 单糖标准品的液相色谱图Fig.6 Liquid chromatogram of monosaccharide reference
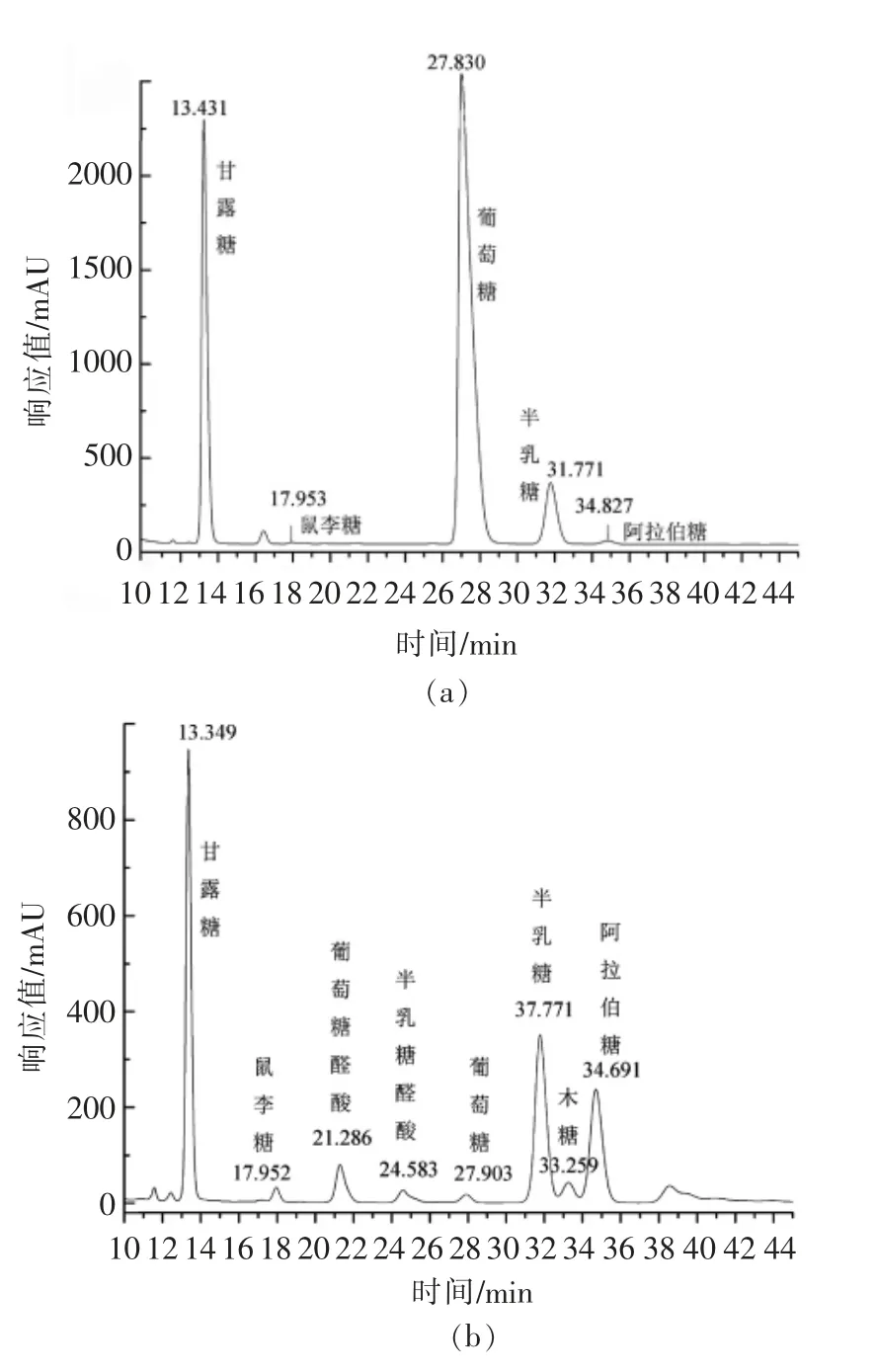
图7 EPS-1a(a)和EPS-3a(b)的单糖组成分析图Fig.7 Analysis of monosaccharide composition of EPS-1a(a) and EPS-3a(b)
如图6所示为标准单糖色谱图,可以看出,单糖标准样品在该色谱条件下均得到较好的分离,根据保留时间从小到大排序为:甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖。将经酸水解得到的样品衍生物做高效液相色谱分析,结果如图7所示。根据图中所示结果并结合单糖标准品在色谱峰上的出峰顺序及保留时间,可以得到EPS-1a(图7a)主要由葡萄糖(RT=27.830 min)、甘露糖(RT=13.431 min)和半乳糖(RT=31.771 min)组成,占总糖量90%以上,且三者的物质的量比为3.62∶1∶2.99,同时含有少量的鼠李糖(RT=17.953 min)和阿拉伯糖(RT=34.827 min)。此外,在保留时间21.378,24.184,32.957 min 和39.448 min 处,分别含有极少量的葡萄糖醛酸、半乳糖醛酸、木糖和岩藻糖,这4 种糖的峰面积和强度非常小,几乎在图中无法显示。EPS-3a(图7b)主要由甘露糖(RT=13.349 min)、半乳糖(RT=31.771 min)和阿拉伯糖(RT=34.691 min)构成,占总糖量80.6%,其物质的量比为1.19∶1∶1.08,另含有少量的木糖 (RT=33.259 min)、葡萄糖醛酸(RT=21.286 min)、岩藻糖(RT=39.156 min)和鼠李糖(RT=17.952 min)以及微量的葡萄糖 (RT=27.903 min)、半乳糖醛酸(RT=24.583 min)和核糖(RT=17.220 min),其物质的量比为10.46∶5.97∶5.73∶5.73∶2.44∶2.35∶1。
2.8 多糖组分EPS-1a 和EPS-3a 的核磁共振分析
2.8.11H NMR 分析 图8a 为EPS-1a 的1H NMR 谱图,图中4.7 ppm 附近的谱峰为水峰,3.2~4.0 ppm 间谱峰为C2~C6 上质子信号堆集产生,不易解析[17]。在4.8~5.5 ppm 范围,存在明显的2个S 峰(single)和一个D(double)峰,信号分别为5.465,5.331,5.250 ppm,且这3 个峰中包含EPS-1a 糖链的多个糖残基。根据谱图中异头信号的化学位移和耦合常数值,可推测糖残基均为α 构型。结合前期单糖组成的结果可得所有糖残基可能是甘露糖、葡萄糖和半乳糖的几种α-型糖苷键。图8b 为EPS-3a 的1H NMR 谱图,图中3 种明显的峰的化学位移分别是5.478,5.190,5.060 ppm,即2 个S 峰和1 个M(multiple)峰。根据氢谱中异头信号的化学位移和耦合常数值,可判断3 个峰包含的糖残基均为α 构型,这与前期红外光谱预测结果一致,结合单糖组成的结果可推测糖残基可能是甘露糖、半乳糖和阿拉伯糖的几种α-型糖苷键。
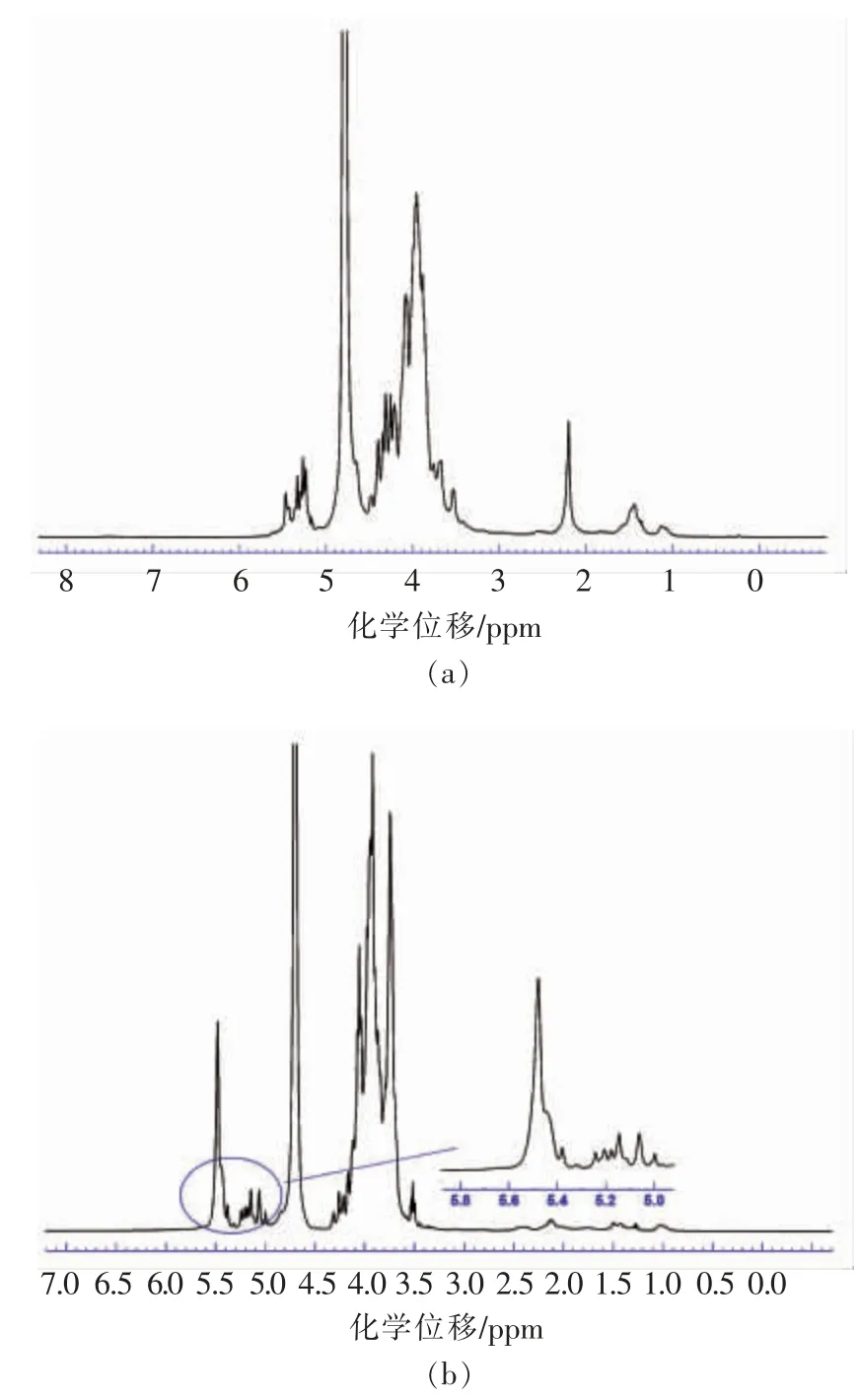
图8 EPS-1a (a)和EPS-3a (b)的500-MHz 1H NMR 谱图Fig.8 500-MHz 1H NMR spectrum of EPS-1a(a)and EPS-3a(b)
2.8.213C NMR 分析 图9a 是多糖组分EPS-1a的13C NMR 图谱,在化学位移100~105 ppm 范围显示3 个明显的S 峰,体现3 种异头碳的化学位移(δ),即表示甘露糖、葡萄糖和半乳糖残基的3种α-型构型,糖残基的C-1 信号的化学位移分别是104.54,102.30,100.71 ppm。此外在化学位移170~180 ppm 范围无明显的吸收峰,表明EPS-1a中无糖醛酸和蛋白质或含量很少,不易检出。图9b 为EPS-3a 的13C NMR 谱图,其中异头碳的δ表示甘露糖、半乳糖和阿拉伯糖残基的α-构型,糖残基C-1 信号的δ 分别是104.51,102.27,100.66 ppm。
3 讨论
目前,随着LAB EPS 的生理活性逐渐被人们认识和接受,一些研究学者致力于乳酸菌产生EPS 的研究,开始追求更多具有益生功能的EPS[20-21]。大量文献[17,22]报道LAB EPS 所表现出的抗氧化、抗肿瘤等多种生物活性及功能与其结构密切相关,因此对LAB EPS 进行分离、纯化是结构鉴定的基础,阐明其结构与功能间的关系是开发和利用LAB EPS 的关键。本试验将嗜热链球菌MGD1-4 在液体培养基中所产EPS 经DEAECellulose 52 离子交换色谱柱纯化得到4 个组分,2 个为中性多糖,2 个为酸性多糖。选取其中主要组分,经Sepharose CL-6B 凝胶柱层析分离得到组分EPS-1a 和EPS-3a,经纯度鉴定2 个组分均为较纯的单一多糖,分子质量分别为1.572×105u和3.825×105u,前者的多分散性系数PDI=2.902,说明其分子质量分布范围广,大多分布于2.6×104~5.0×104u 和5.0×104~2.6×105u 范围,分别占55.0%和33.2%,其余大分子多糖占11.8%;相比前者,EPS-3a 的PDI 值为1.727,更接近1,说明该组分分子质量分布更为均一,分布范围较窄[23]。红外光谱分析得2 个组分均有多糖的特征官能团如吡喃糖、羟基、羰基等,因此,可通过该方法鉴别EPS 中不同的单糖,识别呋喃糖和吡喃糖,初步确定糖苷键构型,识别主要的取代基。另有文献[24]报道,类似EPS-1a 所示结构可通过形成水化聚合物一致矩阵来改善产品的理化特性,如黏度、持水力等,并使其在化妆品和食品领域能够得到广泛应用,这可能与多糖内部分子质量排布、一级结构和性质有关;而EPS-3a 表面光滑、形态均一的基本结构特性是制备可塑性膜材料所需要具备的条件[25]。同时,通过高效液相色谱分析发现EPS-1a主要由葡萄糖、甘露糖和半乳糖组成,EPS-3a 主要由甘露糖、半乳糖和阿拉伯糖组成,而1D NMR研究表明,EPS-1a 和EPS-3a 的糖环形式均为吡喃糖环,且糖苷键构型均为α 型。因LAB EPS 的结构复杂多样,包含丰富的生物学信息,故当前对其结构的研究停留在初级结构方面,无法确立其构效关系。为更好地了解这些组分的结构与生物活性间的相关性,今后将通过高级结构进一步确定其构型,这对EPS 的结构解析具有重要的现实意义。此外,许多学者[26-28]对阿拉伯糖在人体肠道内糖代谢作用以及食品和药品方面的使用功能做了大量研究,该菌株在这些方面的应用还需进一步开发。

图9 EPS-1a (a)和EPS-3a (b)的500-MHz 13C NMR 谱图Fig.9 500-MHz 13C NMR spectrum of EPS-1a(a)and EPS-3a(b)

