氟代六元氮杂环化合物与水分子弱相互作用的理论研究
陈 玲,林珍义,肖 瑶,曾 义
(西华大学理学院,四川 成都 610039)
六元氮杂环化合物作为一类典型的杂环芳香化合物在工业和药物等领域有着重要的应用。常见的含一个和两个氮原子的六元杂环化合物包括吡啶(Pyridine,Py)、哒嗪(Pyridazine,Pa)、嘧啶(Pyrimidine,Pm)和吡嗪(Pyrazine,Pz)(图1)。这些化合物自身六元环上的π 电子和氮原子上的孤对电子lp (lone pair)可以作为电子供体与一些常见小分子发生弱相互作用而形成H···N 氢键复合物(Hydrogen bond,HB)或者H···π 复合物[1 − 2]。氟原子由于强电负性和低极化率,其取代能在很大程度上影响这些分子的化学性质,使分子上方的π 电子云出现正的静电势“π-hole”,从而调节和改变六元氮杂环化合物与小分子之间的弱相互作用。

图1 含氮六元杂环化合物
2016 年Calabrese 等[3]运用脉冲射流傅里叶变换微波光谱法研究了五氟吡啶(C5F5N,5FPy)与水分子的转动光谱,首次发现了5FPy···H2O 的lp···π 复合物(图2(a))。在这个复合物结构中,水分子位于5FPy 平面上方。他们在MP2/6-311++G(d,p)的计算水平上还找到了一个OH···N 的氢键复合物(图2(b)),计算结果也显示lp···π 复合物为更稳定结构。该课题组之前还在三氟氯乙烯(C2F3Cl)与水分子[4]和氨分子[5]的转动光谱实验中检测到了C2F3Cl···H2O 和C2F3Cl···NH3的lp···π复合物。Evangelisti 等[6 − 9]在研究六氟苯与水的转动光谱时也从实验上确认了类似的C6F6···H2O 的lp···π 稳定构型,而其他单氟苯、对二氟苯和1,2,3,4-四氟苯等不同氟原子取代的苯与水的光谱实验确认报道的是平面型的氢键复合物结构。相对卤代烃与水分子弱相互作用的大量研究,其他氟代六元氮杂环与水分子弱相互作用的实验光谱研究和理论研究都相对较少。为此,本文采用密度泛函理论来系统研究五氟/四氟吡啶C5NF5-nHn(n=0,1)和四氟/三氟二嗪C5N2F4-nHn(n=0,1)与水分子之间的弱相互作用,考察不同氟原子取代下,氟代六元氮杂环化合物与水分子可能形成的lp···π 和氢键复合物的竞争效应,寻找出稳定构型并计算出相互作用能(Interaction Energy,IE),并从分子水平进行电子结构的进一步分析。
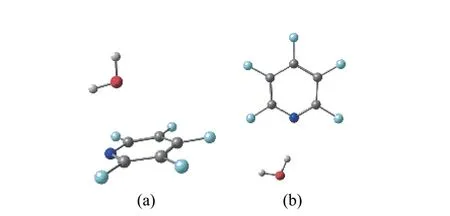
图2 5FPy···H2O 的lp···π (a)和氢键复合物(b)
1 计算方法
文中所有结构的几何构型均采用密度泛函M062X 方法[10]和aug-cc-PVTZ 基组进行优化。并对优化得到的结构进行相同计算水平上的振动频率分析,所有的频率均为正值,说明为局域极小点。几何构型优化的收敛判据为“opt=tight”,计算积分使用(99,590)的积分网格。对文中复合物结构使用Boys-Bernardi 平衡方法(CP)的基组重叠误差(BSSE)[11]来进行相互作用能校正。我们课题组[12]运用该方法M062X/aug-cc-pVTZ 已经系统研究了全卤代不饱和烯烃C2ClnF4-n(n=0~4)与甲醛、二甲醚、氨和三甲胺之间的lp···π 和卤键弱相互作用,计算得到的复合物相互作用能与实验报道值吻合较好。对所有优化结构的电子密度采用AIM2000 软件进行AIM 分析[13]。所有计算都在高斯09 软件下完成[14]。
2 结果与讨论
五氟/四氟吡啶与水分子形成的lp···π 和氢键复合物结构列于图3 和图4,四氟/三氟二嗪与水分子形成的lp···π 和氢键复合物结构列于图5 和图6。
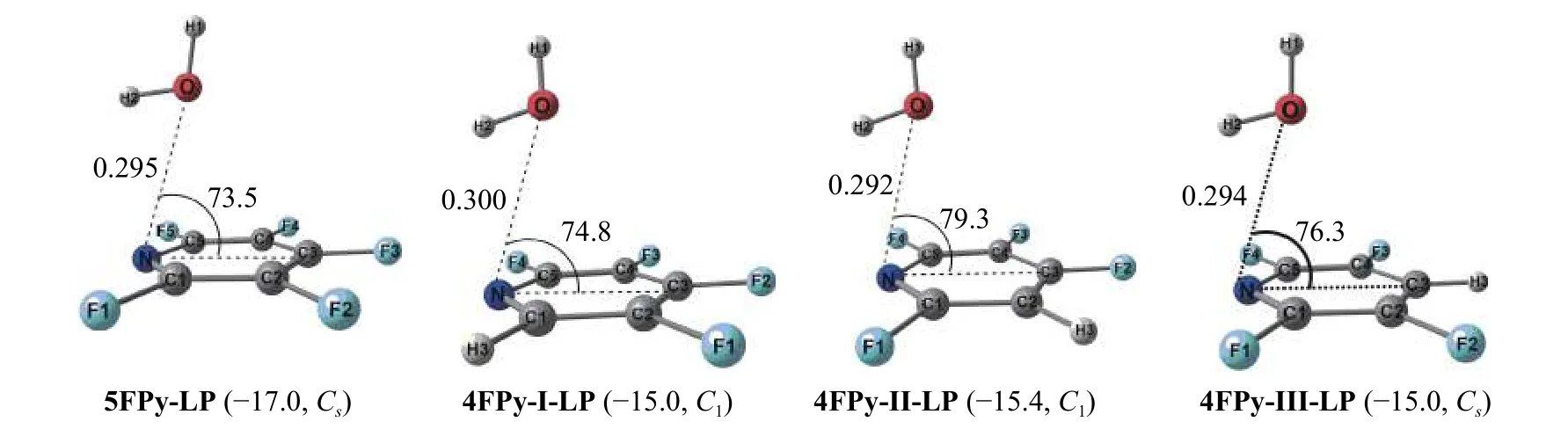
图3 五氟/四氟吡啶与水分子形成的lp···π 复合物,括号里为IE 值(kJ mol−1)和复合物的对称性
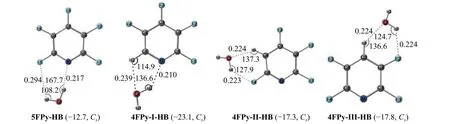
图4 五氟/四氟吡啶与水分子形成的氢键复合物,括号里为IE 值(kJ mol−1)和复合物的对称性

图5 四氟/三氟二嗪与水分子形成的lp···π 复合物,括号里为IE 值(kJ mol−1)和复合物的对称性
2.1 氟代吡啶与水分子形成的lp···π 和氢键复合物
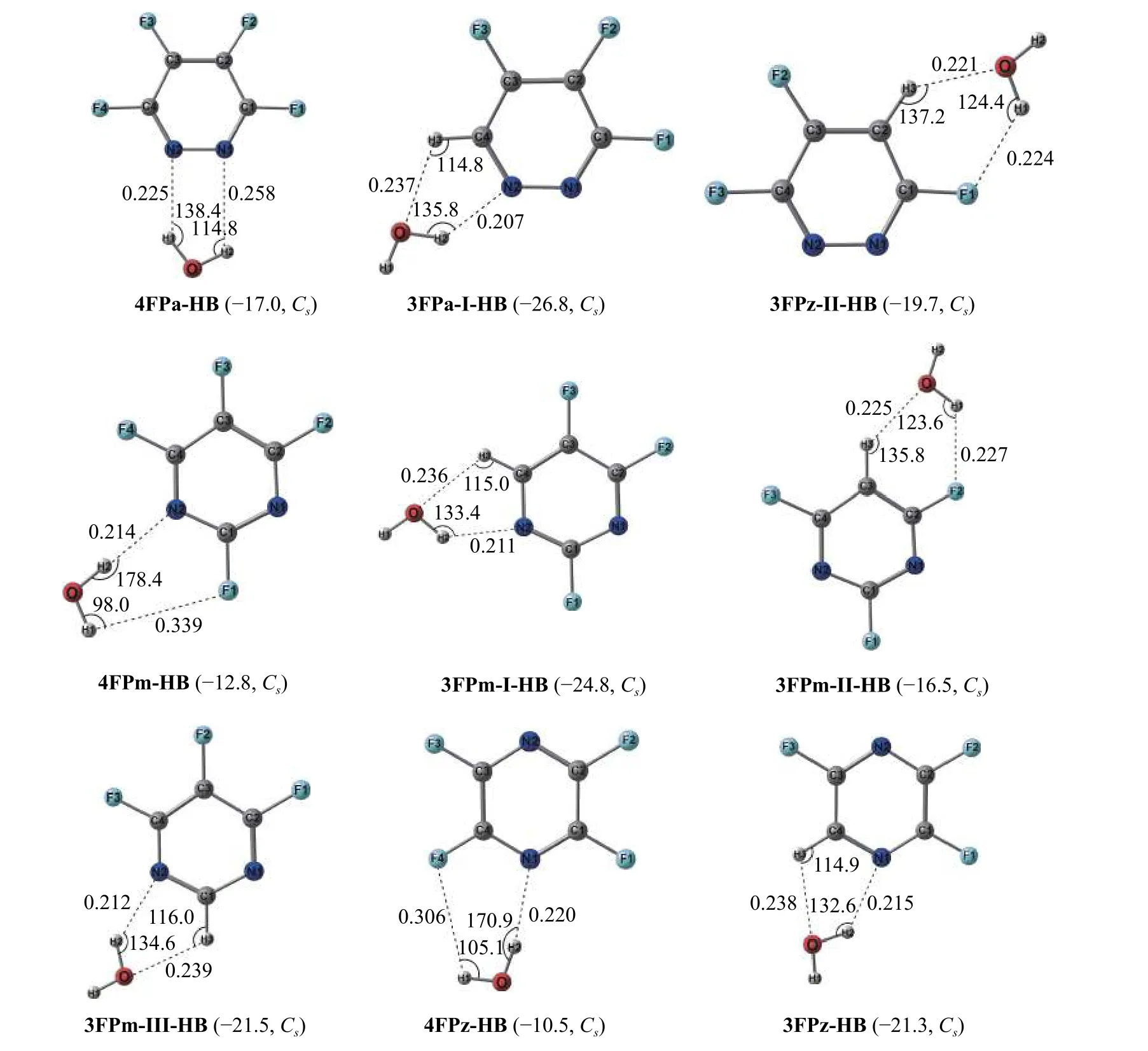
图6 四氟/三氟二嗪与水分子形成的氢键复合物,括号里为IE 值(kJ mol−1)和复合物的对称性
对于四氟吡啶可能的3 种同分异构体分别用4FPy-I,4FPy-II 和4FPy-III 进行表示。图3 显示,5FPy-LP 的IE 值为−17.0 kJ mol−1,而4FPy-I-LP,4FPy-II-LP 和4FPy-III-LP 的IE 值约为−15 kJ mol−1左右,从这里可以看出氟原子个数的减少会使其相应lp···π 复合物的IE 值降低。这4 个结构的O··N 距离比较接近,均在0.3 nm 左右。4FPy-ILP、4FPy-II-LP 和4FPy-III-LP 的∠ONC3 键角分别为74.8°、79.3°和76.3°,大于5FPy-LP 的73.5°。∠ONC3 键角越大说明水分子的氧原子偏离吡啶六元环的程度加深,这样不利于形成lp···π 复合物。
而在五氟/四氟吡啶与水分子形成的氢键复合物(图4)中,相对于氟原子的个数对于氢键复合物的影响,其吡啶环上氢原子的位置对氢键复合物IE 值的影响更为显著。5FPy-HB 的IE 值为−12.7 kJ mol−1。4FPy-I-HB、4FPy-II-HB 和 4FPy-IIIHB 中水分子的氧原子是与吡啶环上的氢原子和氮/氟原子形成C―H···O 和O―H···N/F 双氢键,其IE 值显著增大,分别为−23.1、−17.3 和−17.8 kJ mol−1,对应的C―H···O 和O―H···F 氢键距离在0.22 nm 左右。而5FPy-HB 的中的O―H···F 氢键距离较大,为0.294 nm,这会在一定程度上削弱其氢键,使其IE 值下降。可见当吡啶从全氟取代变为四氟取代后,其相应的氢键复合物IE 值明显大于相应的lp···π 复合物。因此对吡啶而言,全氟取代是其lp···π 复合物比氢键复合物稳定的前提条件之一。
2.2 氟代二嗪与水分子形成的lp···π 和氢键复合物
对于三氟二嗪C5N2F3H,由于环上氢原子位置的不同,三氟哒嗪有2 种同分异构体,3FPa-I 和3FPa-II;三氟嘧啶有3 种同分异构体,3FPm-I、3FPm-II 和3FPm-III-LP;三氟吡嗪只有1 种结构3FPz。
由图5 可知,对全氟取代的二嗪与水分子的lp···π 复合物,六元环上氮原子的增加增强了其水分子与配体环上π-hole 的弱相互作用,其4FPa-LP、4FPm-LP 和4FPz-LP 的IE 值分别为−21.2、−19.2 和−19.5 kJ mol−1,O···N 距离略大于5FPy-LP,尤其4FPz-LP 由于两个氮的对位结构使得到的4FPz-LP 结构中水分子位于吡嗪环的上方中央,其两个O··N 距离较长,为0.312 nm 和0.318 nm。但是4FPa-LP、4FPm-LP 和4FPz-LP 中的∠ONC2 键角约为63°~69°,明显小于5FPy-LP(73.5°),这有利于增强C5N2F4···H2O 的lp···π 弱相互作用。对于三氟取代的C5N2F3H··H2O 的lp···π 复合物,环上氢原子的取代对于3FPa-ILP 和3FPa-II-LP 的几何构型影响较小,相应复合物的IE 值略微减小,约为−19 kJ mol−1。3FPm-ILP、3FPm-II-LP 和3FPm-III-LP 的∠ONC2 键角随着氢原子的取代增加了4°~8°,其IE 值也减小为−16.5~−15.4 kJ mol−1。3FPz-LP 的O··N 距离增加为~0.323 nm,其IE 值下降为−16.4 kJ mol−1。
全氟取代的C5N2F4··H2O 氢键复合物(图6)中,4FPa-HB、4FPm-HB 和4FPz-HB 的IE 值分别为−17.0、−12.8、−10.5 kJmol−1,都明显小于各自三氟取代的C5N2F3H··H2O 氢键复合物。可见环上氢原子的取代有利于水分子和配体的平面氢键作用,尤其是当环上氢原子在氮相邻位置时所形成的氢键复合物:3FPa-I-HB、3FPm-I-HB、3FPm-IIIHB 和3FPz-HB 氢键作用明显增强,其相应IE 值为−26.8、−24.8、−21.5 和−21.3 kJ mol−1。而其他的氢键复合物3FPa-II-HB 和3FPm-II-HB IE 值下降为−19.7 和−16.5 kJ mol−1,这就使得对应的lp···π 复合物3FPa-II-LP(IE:−19.3 kJ mol−1)和3FPm-IILP(IE:−16.9 kJ mol−1)与氢键复合物成为了竞争性复合物。计算表明,对于氢原子不与环上氮原子相邻的氟代二嗪,非全氟取代下的lp···π 复合物也具有在实验上被检测确认的可能性。
2.3 静电势分析
为了从电子水平进一步阐释氟代氮杂环化合物与水分子的lp···π 和氢键弱相互作用,我们分析研究了13 种氟代氮杂环化合物的静电势图(图7)。图7 显示,全氟取代的5FPy、4FPa、4FPm 和4FPz 分子上方的π 电子云显示深蓝色(蓝色代表静电势为正值,红色代表静电势为负值),说明形成了十分集中明显的“π-hole”,有利于与水分子的氧原子形成lp···π 复合物。而对于四氟吡啶(4FPy-I、4FPy-II 和4FPy-III)、三氟哒嗪(3FPa-I 和3FPa-II)、三氟嘧啶(3FPm-I、3FPm-II 和3FPm-III)和三氟吡嗪(3FPz) 环上方为淡蓝色,说明“πhole”正的静电势降低,进而lp···π 作用有所减弱。而氢原子的一端显示明显的深蓝色区域,即为“σhole”,十分有利于氢键复合物的形成。

图7 13 种氟代氮杂环化合物的静电势图(蓝色代表正值,红色代表负值)
2.4 AIM 分析
对文中的氟代氮杂环化合物与水分子的lp···π 和氢键复合物进行了AIM 分析。图8 中蓝色圆圈标注的即为复合物结构中lp···π 和氢键作用的键关键点(bond critical point,BCP)。表1 列出了这些结构关键点的电子密度(ρBCP,au)及其拉普拉斯(∇2ρBCP,au)值。由表1 可知,五氟/四氟吡啶的lp···π 复合物,ρBCP约为0.009 au,∇2ρBCP约为0.04 au 左右,不同氟原子取代对lp···π 复合物的ρBCP和∇2ρBCP影响不明显。而在氢键复合物中,氟原子的取代对这2 个数值的影响则较为明显。5FPy-HB 的AIM 分析显示该结构只有1 个OH···N 氢键的BCP,而其他的四氟吡啶氢键复合物则有2 个氢键作用BCP。其中4FPy-I-HB 的ρBCP和∇2ρBCP最大,分别为0.030 (H···N:0.020 vs.H···O:0.010)和 0.122 (H···N:0.074 vs.H···O:0.048)。四氟/三氟二嗪与水分子lp···π 复合物的ρBCP在0.008~0.010 au 之间,∇2ρBCP约为0.04 au 左右。相应氢键复合物的ρBCP和∇2ρBCP变化情况与四氟吡啶氢键复合物较为类似,3FPa-I-HB、3FPm-I-HB 和3FPz-HB 的ρBCP和∇2ρBCP都相对较大,对应于各自最大的IE 值。
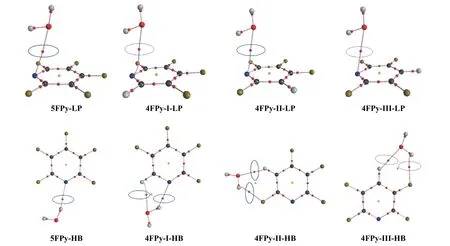
图8 氟代吡啶与水分子形成复合物的AIM 图(蓝色圆圈标注的是lp···π 和氢键作用的BCP)
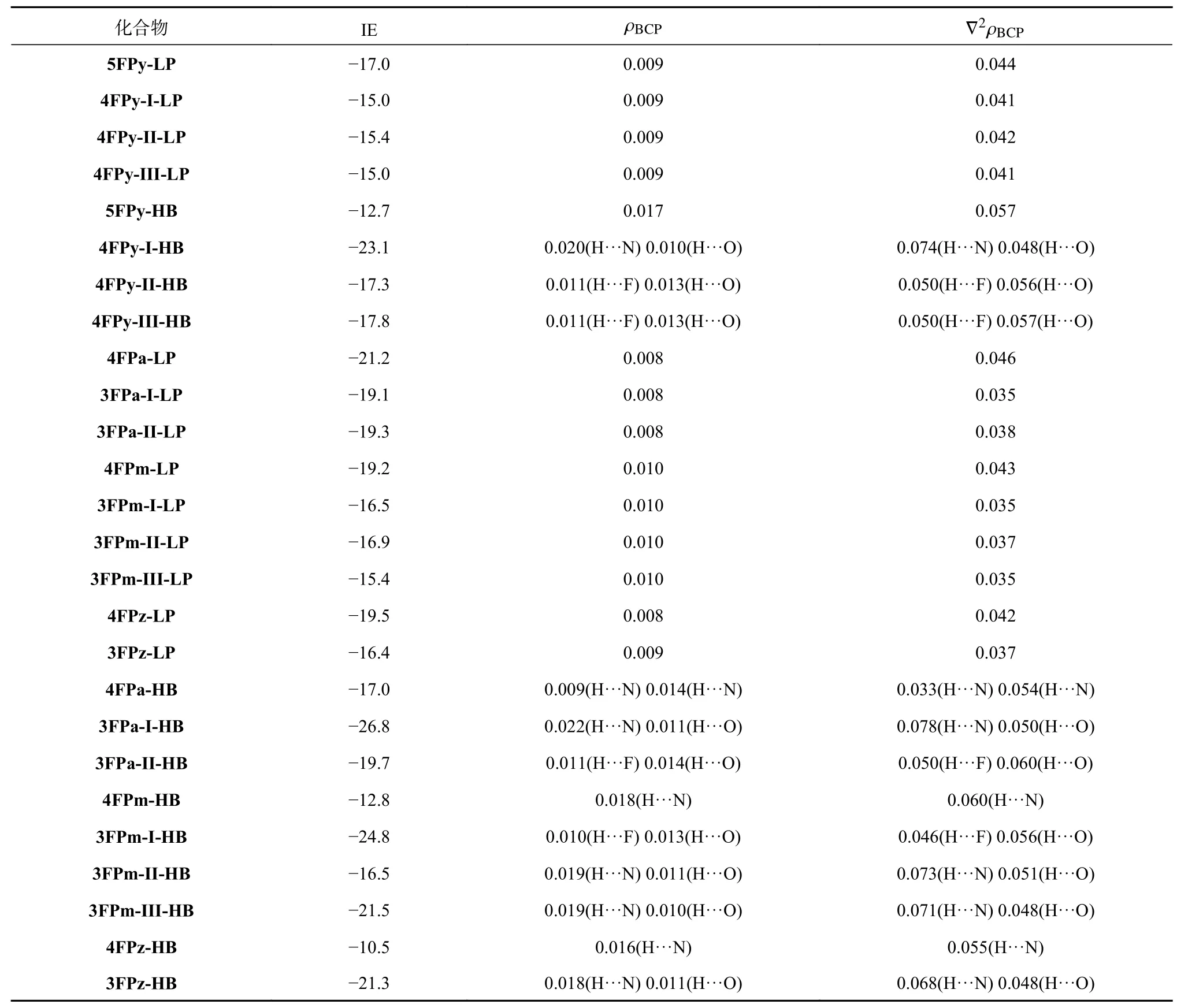
表1 所有复合物结构的IE 值(kJ mol−1),BCP 处的电子密度(ρBCP,au)及其拉普拉斯(∇2ρBCP,au)值
3 结论
本文采用密度泛函M062X/aug-cc-PVTZ 计算水平研究了五氟/四氟吡啶C5NF5-nHn(n=0,1)和四氟/三氟哒嗪、嘧啶和吡嗪C5N2F4-nHn(n=0,1)与水分子可能形成的lp···π 和氢键复合物。研究结果发现,对于环上含一个氮的吡啶分子,全氟取代是形成更稳定lp···π 复合物的前提条件,5FPy-LP 的IE 为−17.0 kJ mol−1,大于5FPy-HB (~−12.7 kJ mol−1)。四氟吡啶随着氢原子在环上的取代,3 种同分异构体的lp···π 复合物IE 值均下降,约为−15 kJ mol−1,而氢键复合物IE 值明显增加,在−23.1~−17.3kJ mol−1之间。全氟二嗪随着环上氮原子的增加,其与水分子的lp···π 复合物4FPa-LP、4FPm-LP 和4FPz-LP 稳定性得到增强,IE 值增大为−21.2~−19.2 kJ mol−1,且大于各自的氢键复合物(−17.0~−10.5 kJ mol−1)。不同于氟代吡啶,在三氟二嗪的同分异构体中,当环上的氢原子不与氮原子相邻时,其相应的三氟哒嗪和三氟嘧啶与水分子的lp···π 复合物与相应氢键复合物具有相当的竞争性,其IE 值十分接近:3FPa-II-LP (−19.3 kJmol−1) vs.3FPa-II-HB (−19.7 kJ mol−1),3FPm-II-LP(−16.9 kJ mol−1) vs.3FPm-II-HB (−16.5 kJ mol−1),在实验上都有被检测确认的可能。

