超声波辅助碱法提取美藤果分离蛋白及其加工性质研究
李云嵌,杨曦,刘江,吴娟,王振兴,张雪春
(西南林业大学 生命科学学院,云南 昆明,650224)
美藤果(Plukenetiavolubilis),又名印加果、南美油藤、星油藤等,是一种原产于南美的大戟科多年生藤本油料植物[1],近年来在我国云南、贵州等地大量种植。美藤果仁中含有约30%的蛋白质,含量仅次于大豆,其必需氨基酸含量高达10.6%,且含有所有人体必需氨基酸,是一种优质的植物蛋白资源[1-3]。美藤果榨油后的果饼中蛋白质含量较高,但果饼大多作为动物饲料和肥料,造成美藤果资源的极大浪费。目前,美藤果蛋白常用的提取方法有碱溶酸沉法、酶法除杂浓缩法、反胶束法、水提法等[4],其中碱溶酸沉法因操作简单、成本低等优点得到广泛应用,但单一采用该方法往往提取率较低,故结合酶或超声波辅助提取可提高美藤果蛋白的提取率。
超声波辅助提取技术是一种绿色分离提取新技术,相比碱法等传统的蛋白质提取方法而言,具有提取率高、时间短、溶剂消耗量小、成本低等优点[5],目前超声波已被广泛应用到蛋白质的提取制备中[3,6-9]。本文从脱脂美藤果饼中提取分离蛋白,并研究其加工性质,为美藤果资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
脱脂美藤果饼,西双版纳印奇生物资源开发有限公司提供,经粉碎,过60目筛后备用;牛血清白蛋白,上海伯奥生物科技有限公司;福林酚试剂、NaH2PO4、Na2HPO4、NaCl、盐酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、三羟甲基氨基甲烷[Tris(hydroxymethyl)methyl aminomethane,Tris]、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等,均为分析纯。
5804R多功能台式高速冷冻离心机,Eppendorf中国有限公司;XMTD-7000电热恒温水浴锅,北京市永光明医疗有限公司;UB-7 pH计,丹佛仪器(北京)有限公司;F50酶标仪,帝肯(上海)贸易有限公司;SB25-12DTDS超声波清洗机,宁波新艺超声设备有限公司;UV-1000紫外可见分光光度计,北京莱伯泰科仪器;FJ200-SH型数显高速分散均质机,上海标本模型厂。
1.2 试验方法
1.2.1 超声波辅助提取美藤果分离蛋白
取脱脂美藤果饼40 g,按液料比17∶1 (mL∶g)加入0.14 mol/L NaCl溶液混匀,再以2 mol/L NaOH溶液调pH至10,于43 ℃、220 W超声处理16 min,离心(4 000 r/min,20 min),取上清液用2 mol/L HCl溶液调pH至4.9,在同样条件下离心,沉淀以1∶3(g∶mL)的比例使用去离子水水洗2遍,冻干得美藤果分离蛋白备用[10]。按公式(1)计算美藤果分离蛋白得率:

(1)
式中:m1,美藤果分离蛋白质量,g;m0,脱脂美藤果饼质量,g。
1.2.2 单因素试验
在超声波辅助提取美藤果分离蛋白工艺试验中,固定提取pH条件为10,对4个因素:超声温度、超声时间、超声功率、液料比分别进行单因素试验,考察各因素对美藤果分离蛋白得率的影响。
1.2.3 响应面试验
在单因素试验基础上,运用Design-Expert 8.0.6软件,依据Box-Behnken设计原理,以Y(美藤果分离蛋白得率)为响应值,选取A(超声时间)、B(超声功率)、C(超声温度)、D(液料比)为自变量,设计响应面优化试验,试验因素水平表见表1。

表1 试验因素水平表Table 1 Test factors and levels
1.2.4 美藤果蛋白组分的分离和理化性质测定
采用Osborne分离法[11]从脱脂美藤果饼中提取分离得到美藤果清蛋白和球蛋白,按照GB 5009.3—2016《食品中水分的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.5—2016《食品中蛋白质的测定》分别测定美藤果分离蛋白、清蛋白和球蛋白的水分、粗脂肪和粗蛋白含量。
1.2.5 等电点的测定
取脱脂美藤果饼40 g,按液料比17∶1 (mL∶g)加入0.14 mol/L NaCl溶液混匀,以2 mol/L NaOH溶液调pH至10,于43 ℃、220 W超声处理16 min,离心(4 000 r/min,20 min)后取等量上清液,用2 mol/L HCl溶液分别将pH调至4.4、4.6、4.8、4.9、5.0、5.1、5.2,在同样条件下离心,取上清液适度稀释后用福林酚法[12]测定其蛋白质量浓度,绘制蛋白质量浓度与pH的关系曲线,曲线中蛋白质量浓度最低点对应的pH即为样品的等电点[13]。
1.2.6 溶解性的测定
取0.4 g冻干蛋白样品分散于40 mL 50 mmol/L pH 7的磷酸钠缓冲液中,并分别用2 mol/L的NaOH溶液和HCl溶液调pH为2~12,室温搅拌30 min后,于8 000 r/min离心15 min,采用福林酚法[12]测定上清液中蛋白质含量,采用凯氏定氮法测定样品中蛋白质含量[14]。按公式(2)计算蛋白溶解性:

(2)
1.2.7 起泡性和起泡稳定性的测定
取蛋白样品,以50 mmol/L pH 7磷酸盐缓冲液配制体积分数为1%的溶液,分别用2 mol/L的NaOH溶液和HCl溶液调pH至2、7、10,搅拌30 min后,取20 mL于15 000 r/min均质分散1 min,测定0和60 min的泡沫体积[15]。按公式(3)和(4)计算起泡性和起泡稳定性:

(3)
(4)
式中:V1,0 min量筒中样品体积,mL;V2,60 min量筒中样品体积,mL。
1.2.8 乳化性及乳化稳定性的测定
取蛋白样品,以10 mmol/L pH 7磷酸盐缓冲液配制体积分数为1%溶液,分别用2 mol/L的NaOH溶液和HCl溶液调pH为2、7、10,搅拌30 min后,与5 mL大豆油混合,于15 000 r/min均质分散1 min制成乳状液,立即从底部吸取100 μL乳状液与15 mL质量分数为0.1%的SDS溶液混合,摇匀后于500 nm处测定吸光值A0,10 min后测定吸光值A10[16]。按公式(5)和式(6)计算乳化性和乳化稳定性:

(5)

(6)
式中:N,乳液稀释倍数;A0,0 min时的吸光度;A10,10 min时的吸光度;φ,油相比例;C,初始蛋白质量浓度,g/mL;θ,油相体积分数,0.25。
1.2.9 巯基含量的测定
取蛋白样品分别溶解于缓冲液A(10.4 g Tris,6.9 g甘氨酸,1.2 g EDTA,加水定容至1 000 mL,pH 8)和缓冲液B(96 g尿素溶于缓冲液A中,加水定容至200 mL,pH=8)中配成1 mg/mL溶液,以3 000 r/min离心15 min,取5 mL上清液与0.05 mL Ellman试剂(0.2 g DTNB溶于50 mL缓冲液A中)反应15 min,于412 nm测定吸光度值,其中缓冲液A用于游离巯基的测定,缓冲液B用于总巯基的测定[17]。按公式(7)计算游离巯基和总巯基含量:

(7)
式中:A,吸光度;D,稀释倍数;C,蛋白质量浓度,mg/mL;V,所取蛋白溶液的体积,mL;13 600,黄色物质DTNB在pH 8情况下的摩尔消光系数,mol/(L·cm)。
1.2.10 数据统计分析
所有试验均进行3次平行试验,采用Excel 2010、Origin 2018、Design-Expert 8.0.6、SPSS 25对数据进行处理、绘图、方差分析、响应面分析和显著性分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 超声温度对美藤果分离蛋白得率的影响
如图1所示,超声温度在25~45 ℃时,蛋白得率随超声温度的升高而增大,45 ℃时达到最大,为20.65%,当超声温度继续升高时,蛋白得率呈下降趋势。

图1 超声温度对美藤果分离蛋白得率的影响Fig.1 Effect of ultrasonic temperature on the yield of protein isolate from P.volubilis
说明适当地升温有利于蛋白质的溶解,但温度过高可能会破坏维持蛋白质空间构象的次级结构,引起其构象的解体和内部疏水基团的暴露,从而促进蛋白质分子间的相互结合,降低蛋白质的溶出率[18]。因此,选择超声温度为45 ℃左右。
2.1.2 超声时间对美藤果分离蛋白得率的影响
如图2所示,超声时间在0.5~15 min时,蛋白得率随超声时间的延长而增大,15 min时达到最大,为20.35%,当超声时间继续延长时,蛋白得率呈下降趋势。原因可能是随着超声时间的延长,空化作用增大,此时细胞膜的通透性增强,细胞破碎程度也随之增大,进而导致蛋白的溶出量增多;但当超声时间过长时,细胞膜进一步破裂,杂质溶出量增多[19],此外,超声时间过长会使液体温度过高,导致蛋白质变性,从而降低蛋白质得率。因此,选择超声时间为15 min左右。

图2 超声时间对美藤果分离蛋白得率的影响Fig.2 Effect of ultrasonic time on the yield of protein isolate from P.volubilis
2.1.3 超声功率对美藤果分离蛋白得率的影响
如图3所示,超声功率在100~200 W时,蛋白得率随超声功率的增大而增大,200 W时达到最大,为19.88%,当功率继续增大时,蛋白得率呈下降趋势。原因可能是随着超声功率的增大,超声波的空化作用增强,细胞破碎程度增加,使更多的蛋白质溶解[20],但当超声功率过大时,蛋白质变性形成沉淀,降低蛋白质得率。因此,选择超声功率为200 W左右。

图3 超声功率对美藤果分离蛋白得率的影响Fig.3 Effect of ultrasonic power on the yield of protein isolate from P.volubilis
2.1.4 液料比对美藤果分离蛋白得率的影响
如图4所示,液料比在5∶1~40∶1 (mL∶g)时,蛋白得率随液料比的增大而增大,其中液料比在5∶1~15∶1 (mL∶g)时,呈大幅度上升趋势,在液料比为15∶1 (mL∶g)时,蛋白得率为15.99%;进一步增大液料比时,上升趋势减缓。原因是随着液料比的增大,溶液的黏度降低,分子扩散速度加快,溶解度升高,蛋白得率也随之升高。但液料比过大不利于蛋白质提取后的废液处理,造成蛋白质的浓度偏低,不利于蛋白质的回收,且成本过高[18]。因此,选择液料比为15∶1 (mL∶g)左右。

图4 液料比对美藤果分离蛋白得率的影响Fig.4 Effect of liquid to material ratio on the yield of protein isolate from P.volubilis
2.2 响应面优化试验
2.2.1 响应面试验设计及结果
以美藤果分离蛋白得率为指标,选取A(超声时间)、B(超声功率)、C(超声温度)、D(液料比)为自变量,设计出响应面试验设计方案及结果见表2。

表2 响应面试验设计方案及结果Table 2 Response surface test design and results

续表2
2.2.2 模型的建立及显著性分析
运用Design Expert 8.0.6软件对美藤果分离蛋白得率试验结果进行数据分析,得到二次多项式回归方程为:Y=20.99-0.22A+0.88B-0.27C+1.84D+1.18AB+0.23AC-0.86AD-0.735BC+0.075BD-0.41CD-2.14A2-2.31B2-1.41C2-2.65D2。
回归模型方差分析如表3所示,模型的P<0.000 1,说明模型极其显著,失拟项不显著(P=0.252 3>0.05),相关系数R2=0.904 5,因此,该方程可以较好地反映美藤果分离蛋白提取过程中各因素与响应值的关系并预测最佳提取条件。由P值可知,B、D影响显著,交互项AB显著,二次项均显著,其余不显著。由F值可知,4个因素对美藤果分离蛋白得率的影响顺序为:D>B>C>A。
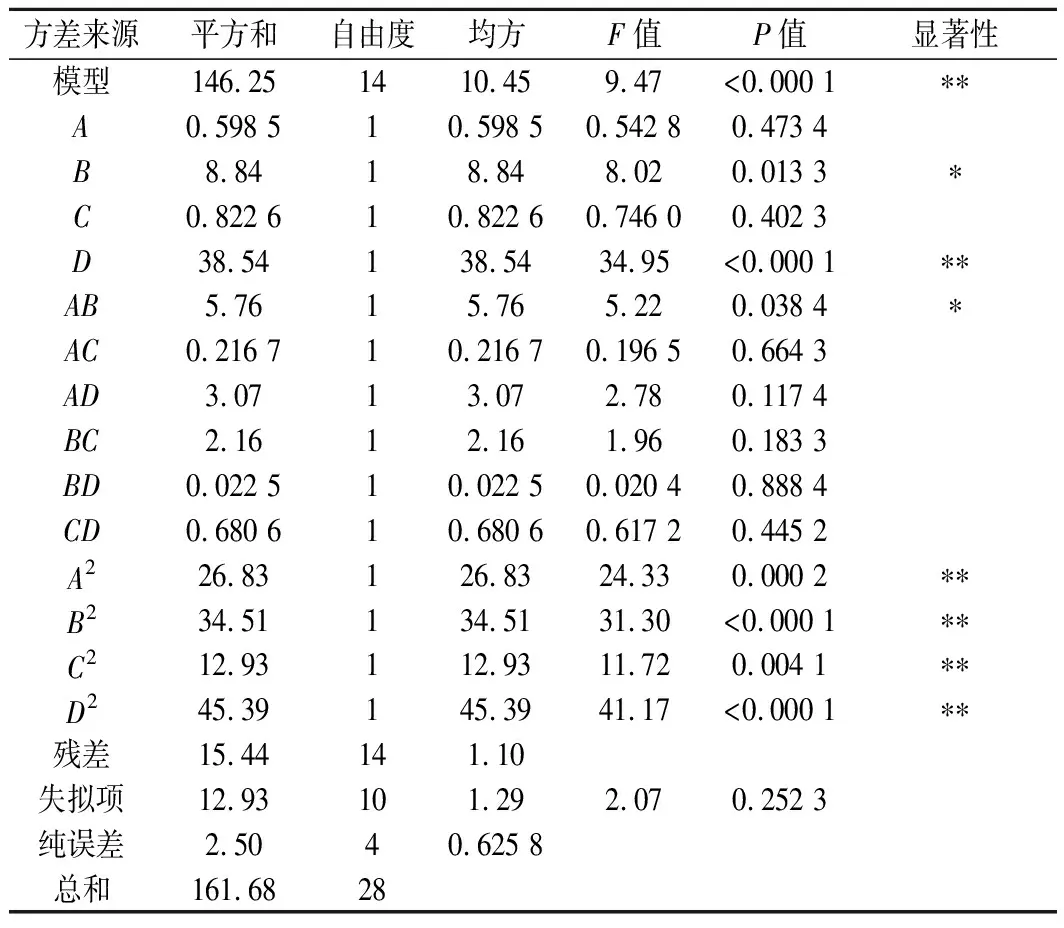
表3 回归模型方差分析表Table 3 Regression model variance analysis
2.2.3 响应面分析
运用Design Expert 8.0.6软件并分析响应面优化试验结果,得到响应曲面图。由图5可知,所有的响应曲面图均呈凸面,等高线图呈圆形或椭圆形。根据两因素交互作用的等高线呈椭圆形,说明交互作用极为显著,各因素响应曲线的陡峭程度反映出该因素对美藤果分离蛋白得率的影响程度,越陡峭,说明影响越大,综合分析可知:液料比对美藤果分离蛋白得率的影响最显著,其次是超声功率,超声时间,最后是超声温度。

图5 四个因素之间交互作用对美藤果分离蛋白得率影响的等高线图及响应面图Fig.5 Contour map and response surface graph of the interaction among four factors on the yield of protein isolate from P.volubilis
2.2.4 响应面验证试验
通过拟合得出最佳提取工艺参数为超声时间16.47 min、超声功率220.96 W、超声温度42.89 ℃、液料比16.9∶1 (mL∶g),该条件下美藤果分离蛋白的预计得率为21.47%,为了操作方便,实际取值超声时间16 min、超声功率220 W、超声温度43 ℃、液料比17∶1 (mL∶g),该条件下美藤果分离蛋白的得率为21.23%,与模型预测值相接近,说明该模型可用于超声波辅助碱法提取美藤果分离蛋白的工艺条件优化。
2.3 美藤果分离蛋白等电点
如图6所示,pH 4.9时溶液中美藤果分离蛋白质量浓度最低,此时蛋白质分子颗粒在溶液中没有相同电荷的排斥,蛋白质分子颗粒极易碰撞、凝聚并产生沉淀,溶解度最小,因此pH 4.9为美藤果分离蛋白的等电点。

图6 美藤果分离蛋白等电点Fig.6 Isoelectric point of protein isolated from P.volubilis
2.4 美藤果蛋白组分的基本理化指标
由表4可知,所提取的美藤果分离蛋白、清蛋白和球蛋白的水分和粗脂肪含量较低,而粗蛋白含量较高,其中美藤果分离蛋白的粗蛋白含量接近90%,其他杂质含量较少,可用于下一步的理化性质测定。

表4 美藤果饼及所提取蛋白组分的理化指标 单位:%
2.5 美藤果蛋白组分的溶解性
如图7所示,随着pH的增大,美藤果分离蛋白、清蛋白和球蛋白的溶解性均呈先降低后升高的变化趋势,在等电点附近溶解性最低,其中美藤果分离蛋白的变化趋势最明显,呈“V”形,与亚麻籽分离蛋白[21]、核桃分离蛋白[22]等的溶解性曲线相似。美藤果分离蛋白在pH 2~3和pH 10~12范围内具有较好的溶解性,其原因可能是分离蛋白在强酸和强碱条件下发生解离,溶出了更多的蛋白质,从而具有较好的溶解性[13]。相比采用碱溶酸沉法提取的美藤果分离蛋白[23],本文所提取的该蛋白具有较高的溶解性。

图7 美藤果分离蛋白、清蛋白和球蛋白的溶解性Fig.7 Solubility of protein isolate,albumin and globulin from P.volubilis
2.6 美藤果蛋白组分的起泡性和起泡稳定性
蛋白质起泡性指蛋白质在一定条件下产生泡沫的量,起泡稳定性则指所形成泡沫的稳定性,起泡性是蛋糕、面包、冰淇淋等食品加工过程中的一项重要指标。如图8-a可知,美藤果分离蛋白的起泡性在pH 10时最好,为51.11%,但总体上低于清蛋白,高于球蛋白;如图8-b可知,美藤果分离蛋白的起泡稳定性在pH 10时最大,为71.52%,且均维持在65%以上;这是因为蛋白质的起泡性在很大程度上取决于它的溶解性,而pH的变化改变了蛋白质的荷电状态,从而影响蛋白质的起泡性和泡沫稳定性[24]。

a-起泡性;b-起泡稳定性图8 美藤果分离蛋白、清蛋白和球蛋白的起泡性和起泡稳定性Fig.8 Foaming and foaming stability of protein isolate,albumin and globulin from P.volubilis注:图中小写字母表示同一种蛋白在不同pH条件下的组内差异显著(P<0.05),下同
2.7 美藤果蛋白组分的乳化性和乳化稳定性
乳化性和乳化稳定性是直接反应蛋白质乳化特性的重要指标。如图9-a和9-b可知,美藤果分离蛋白的乳化性和乳化稳定性低于清蛋白,高于球蛋白,且在pH 10的条件下最大,分别为45.72 m2/g和29.29 min。蛋白质的乳化过程较复杂,受溶解性、分子质量和表面疏水性等多个因素的影响,美藤果分离蛋白在pH 10的条件下具有较高的溶解性,这可能是其具有较好乳化性和乳化稳定性的原因[18]。

a-乳化性;b-乳化稳定性图9 美藤果分离蛋白、清蛋白和球蛋白的乳化性和乳化稳定性Fig.9 Emulsifying and emulsifying stability of protein isolate,albumin and globulin from P.volubilis
2.8 美藤果蛋白组分的巯基含量
蛋白质的巯基和二硫键含量是其分子构象中起稳定性的重要化学键,两者之间的相互作用可使蛋白分子间发生凝聚等变化[25]。如图10可知,美藤果分离蛋白的总巯基和游离巯基含量较高,分别为8.04和3.86 μmol/g。巯基和二硫键可由氧化还原反应相互转化,二硫键具有锁定作用,使蛋白质中的大部分疏水性氨基酸包裹在分子内部,导致蛋白质的表面活性较差[26-27]。因此,通过一些物理化学方法适度打开美藤果分离蛋白的二硫键可提高蛋白表面活性[27]。
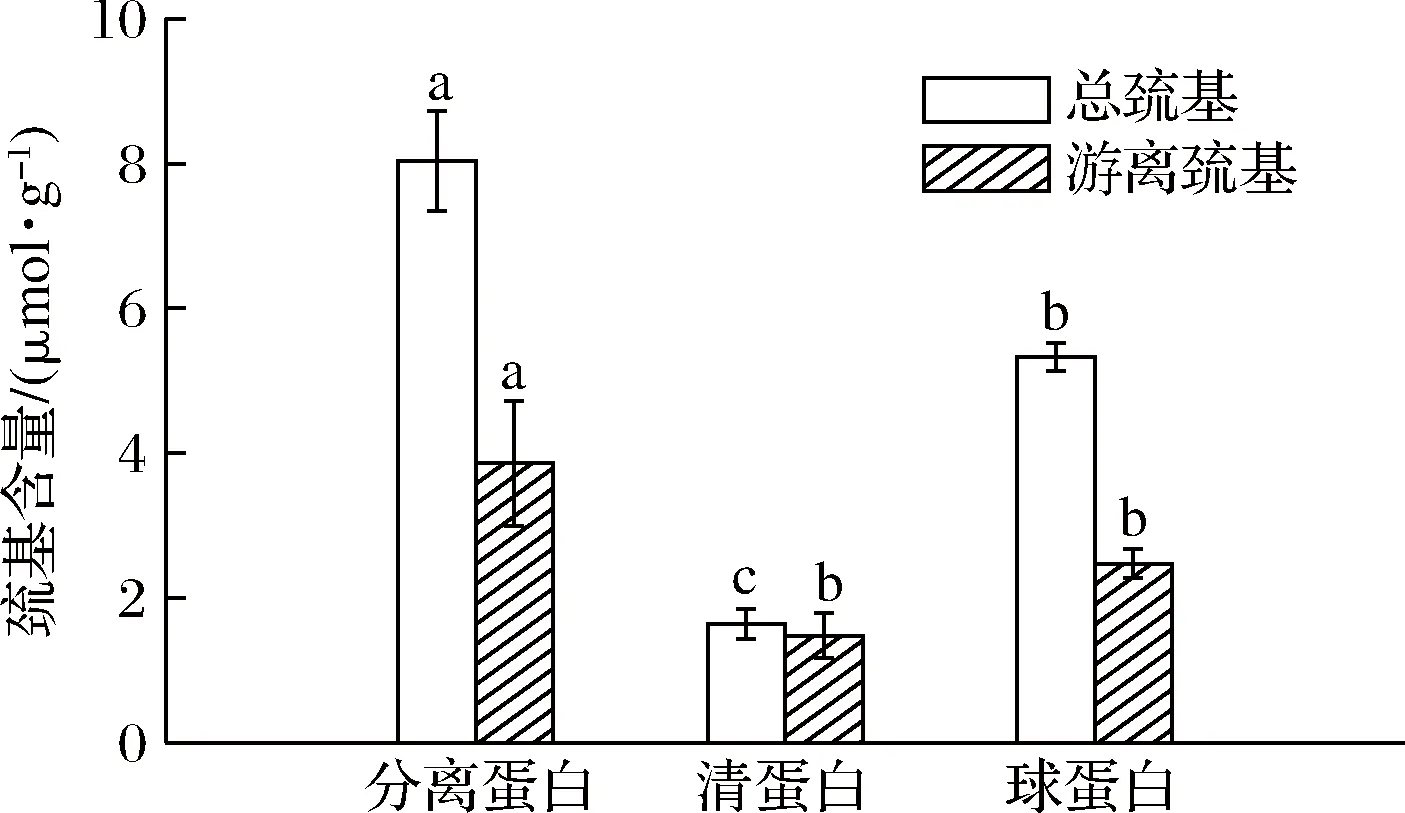
图10 美藤果分离蛋白、清蛋白和球蛋白的巯基含量Fig.10 The content of sulfhydryl group in protein isolate,albumin and globulin from P.volubilis注:图中小写字母表示巯基含量在不同蛋白之间的差异显著(P<0.05)
3 结论
以脱脂美藤果饼为原料,采用超声波辅助碱法提取美藤果分离蛋白,通过单因素试验和响应面法得到美藤果分离蛋白的最佳提取工艺条件为:pH 10、超声时间16 min、超声功率220 W、超声温度43 ℃、液料比17∶1 (mL∶g),此时蛋白得率为21.23%,相比传统碱溶酸沉法提取蛋白质而言,得率显著提高。另外,该得率与模型预测值21.47%相接近,说明该模型能够用于超声波辅助碱法提取美藤果分离蛋白的工艺条件优化。
通过比较美藤果分离蛋白、清蛋白和球蛋白的加工性质,发现分离蛋白的溶解性低于清蛋白和球蛋白,其溶解性曲线随pH增大呈“V”形,在pH 2~3和pH 10~12具有较好的溶解性,与碱溶酸沉法提取的美藤果分离蛋白相比,本文提取的该蛋白溶解性较高;分离蛋白的起泡性低于清蛋白,高于球蛋白,在pH 10时最大,为51.11%,起泡稳定性低于球蛋白,但均维持在65%以上;乳化性和乳化稳定性低于清蛋白,高于球蛋白,在pH 10时最大,分别为45.72 m2/g和29.29 min;总巯基和游离巯基含量高于清蛋白和球蛋白,分别为8.04和3.86 μmol/g。因此,美藤果分离蛋白的提取及加工性质研究具有一定意义,可为其在食品工业等领域的应用提供理论依据。

