水分逆境对发草脯氨酸及其代谢途径的影响
罗巧玉 ,王彦龙 ,陈志 ,马永贵 ,任启梅 ,马玉寿 *
(1. 青海大学农牧学院,青海 西宁 810008;2. 青海省青藏高原药用动植物资源重点实验室,青海师范大学生命科学学院,青海 西宁 810008)
近年来,由于人类活动加剧、地球环境不断变化,人为因素和自然因素致使高寒沼泽湿地健康状况受损[1−2]。保护湿地的生物多样性,优化湿地植物配置,是目前湿地研究的热点问题,对于维持湿地生态系统的稳定性等具有重要意义[3−4]。高寒沼泽湿地及边缘过渡带具有周期性淹水和出露交替的特征,水分条件经常发生极端干旱或淹水的变化[5]。既耐淹水又耐干旱的“共耐性”植物不多,所以淹露交替造成的过渡带生境的极端变化,导致很多水生和旱生植物均难以正常生长。发草(Deschampsia caespitosa)是禾本科(Gramineae)发草属多年生草本植物,广泛分布于高寒草甸、沼泽湿地等生境,具有适应性强、耐刈割、种子产量大、发芽率高等特性[6−7]。发草耐刈割的特性使其能在小型食草动物(例如草原鼠害)和家畜啃食后迅速进行补偿性生长,确保草地生产力的稳定,从而减少植被修复成本,提高修复效率;而发草种子产量和发芽率较高的特性,使其具有产业化的潜能。因此,发草是一种理想的退化高寒沼泽湿地植被恢复植物。目前,关于发草的研究仅见于其作为藏嵩草(Kobresia tibetica)、青藏苔草(Carex moorcroftii)群落的伴生种的调查,包括其分布与起源以及形态学特征等[8−9],对于水分胁迫下发草的抗逆性特征的研究尚未开展。
水分胁迫是指因水分过多或过少而明显抑制植物生长的现象[10−12]。干旱、淹水、冰冻、高温或盐渍等都能引起水分胁迫。在高寒沼泽湿地及边缘过渡带,周期性淹水和出露干旱对植物引起的水分胁迫是最常见的。水分胁迫下植物通过渗透调节物质维持一定的细胞膨压,使植物体茎叶挺立便于充分接受阳光,使气孔能正常张开以保证植物光合作用、蒸腾作用等生理过程的正常进行[13−14]。脯氨酸(proline,Pro)是一类广泛分布的重要渗透调节物质,其具有水溶性高、分子量小、在生理pH 范围内无静电荷等特点[13,15]。水分逆境条件下植物可以通过增加合成、减少降解和不同器官间的运输使Pro 在细胞内大量累积,防止渗透胁迫对植物造成伤害[16]。目前,关于植物 Pro 对干旱[15,17−18]、水涝[19−20]、盐[21−23]、冻融[14,24−25]等水分胁迫中的响应规律已有较多报道。但同一植物对干旱胁迫和水涝胁迫的耐受/抵御机制不完全相同,有关从干旱到水涝一系列水分梯度胁迫间发草Pro 积累以及Pro合成途径中酶活性、底物及中间产物变化等的比较研究尚未见报道。不同植物Pro 的主要合成部位有异,同一植物在不同胁迫下Pro 的合成部位及在叶片与根系间的转运方式也不尽相同[14,16,24]。因此,本研究以发草为供试植物,利用盆栽模拟水分胁迫,研究干旱、水涝胁迫下发草叶片及根系中Pro 积累状况及其代谢途径中关键酶和底物的动态变化,分析发草Pro 代谢对干旱胁迫和水涝胁迫的响应特点,探讨不同胁迫下发草叶片与根系中Pro 的积累、转运规律,为进一步研究发草耐受/抵御水分胁迫机制奠定基础,也为利用发草开展退化高寒沼泽湿地植被恢复工作提供一定的理论基础。
1 材料与方法
1.1 研究材料
土壤基质为河沙和壤土的混合物,其中河沙购买于建材市场,壤土取自青海省果洛藏族自治州玛沁县大武镇高寒草甸,沙和土以1∶1(V∶V)混合均匀。其理化性质为:碳2.67%,有机质1.45%,全氮0.31%,全磷0.26 mg·g−1,全钾 19.58 mg·g−1,pH 7.63,全盐 0.63%,电导率 225.52 μS·cm−1。
供试发草种子由青海大学畜牧兽医科学院草原研究所提供,是经过多年野生栽培驯化的新品系。挑选饱满一致、无病害的种子,用2% NaClO 对其进行表面消毒5~10 min,然后用蒸馏水漂洗3~5 次,漂洗干净的种子备用。
1.2 研究方法
1.2.1 试验设计 试验于青海师范大学城北校区进行。该试验点地处北纬36.742°,东经101.749°,海拔2390.6 m,夏季平均气温5~20 ℃。2018 年9 月将发草种子直接播种于装有3 kg 供试土壤的盆钵(直径20 mm,高25 mm)内,3~5 d 出苗。待幼苗稳定后进行定苗,每盆定苗10 株。期间对幼苗进行正常水分管理。冬季将植物转移至温室过冬,2019 年4 月中下旬天气转暖时将植物转移至室外露天培养。当发草植株长至25 cm 时,进行水分胁迫处理。水分处理过程中,原地搭建遮雨棚。雨棚两侧通风,不影响温度和湿度。雨棚内放置便携式气象仪(霍尔德HED−SQ,中国)监测实时气象数据。试验期间白天(20±2)℃,夜晚(5±2)℃。设置7 个土壤水分处理[26−27]:重度水涝胁迫(heavy waterlogging stress,HW,植株顶部被淹没在水下)、中度水涝胁迫(medium water⁃logging stress,MW,仅植株根颈部被淹,即积水厚度3 cm 左右)、轻度水涝胁迫(light waterlogging stress,LW,田间持水量的100%)、植物正常需水量(control check,CK,田间持水量的70%~80%)、轻度干旱胁迫(light dry stress,LD,田间持水量的50%~60%)、中度干旱胁迫(medium dry stress,MD,田间持水量的30%~40%)、重度干旱胁迫(heavy dry stress,HD,田间持水量的20%)。每个处理设10 个重复。试验采用完全随机设计,采用称重法和土壤水分传感器(ProCheck,美国)监测土壤含水量两种方式同时进行水分控制[26−28],每2 d 补充损失水分以控制土壤水分达到处理条件,每次浇水时间为18:00−19:00,并设置1 个无植物盆土作为对照,估计土壤表面蒸发水分量。水分胁迫处理共持续35 d。试验结束时将植株从花盆中取出,用大量自来水冲洗干净,用蒸馏水漂洗后拭干表面水分,将叶片和根系分别装入冻存管经液氮速冻,置于−80 ℃冰箱保存备用。
1.2.2 测定指标与方法 采用酸性茚三酮显色法[29]测定Pro 含量,参照Lutts 等[30]方法进行酶液提取。采用上海江莱生物科技有限公司生产的酶联免疫分析试剂盒测定谷氨酸(glutamate,Glu)(货号:JL48823)、鸟氨酸(ornithine,Orn)(货号:JL49459)、谷氨酰半醛(glutamic-γ-semialdehyde,GSA)(货号:JL50039)和 Δ1-吡咯琳-5-羧酸(Δ1-pyrroline-5-carboxylate,P5C)(货号:JL50033)的含量,以及Δ1-吡咯琳-5-羧酸脱氢酶(Δ1-pyrroline-5-carbox⁃ylate dehydrogenase,P5CDH)(货号:JL49227)和 Δ1-吡咯琳-5-羧酸还原酶(Δ1-pyrroline-5-carboxylate reductase,P5CR)(货号:JL49464)的酶活性,其测定方法详见试剂盒使用说明。采用 Garca 等[31]的方法测定 Δ1-吡咯琳-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)活性:在 100 mmol·L−1Tris−HCl(pH 7.2)缓冲液(包含25 mmol·L−1MgCl2,75 mmol·L−1Glu,5 mmol·L−1ATP,0.4 mmol·L−1NADPH)加入粗酶液启动反应,340 nm下测定吸光值的减少量。参照Charest 等[32]的方法测定鸟氨酸转氨酶(ornithine aminotransferase,δ-OAT)活性:在 0.2 mol·L−1Tris−KOH(pH 8.0)缓冲液(包含 5 mmol·L−1Orn,10 mmol·L−1α-酮戊二酸,0.25 mmol·L−1NADH)加入粗酶液启动反应,340 nm 下测定吸光值的减少量。参照Lutts 等[30]的方法测定脯氨酸脱氢酶(pro⁃line dehydrogenase,ProDH)活性:在 0.15 mol·L−1Na2CO3−HCl(pH 10.3)缓冲液(包含 15 mmol·L−1Pro,1.5 mmol·L−1NAD+)加入粗酶液启动反应,340 nm 下测定吸光值的增加量。以上指标每处理重复测定3 次。
1.3 数据分析
采用SPSS 22.0 软件对试验数据进行单因素方差分析(one-way ANOVA),采用LSD 法在显著水平为5%条件下进行比较,当P<0.05 时,差异显著。数据结果均用“平均值±标准差”表示,并用Excel 2007 软件作图。
2 结果与分析
2.1 水分胁迫对发草地上/地下部分Pro 含量的影响
水分胁迫下发草的生长受到抑制,随着水分胁迫程度加剧及胁迫时间增长,植物受到的抑制作用越明显。轻度干旱和中度干旱胁迫下发草的叶片由鲜绿柔软变绿变硬,叶面积变小,叶片数减少,根系长度增加,根冠比增大。重度干旱胁迫下发草叶片变成墨绿泛白状态,随着干旱胁迫时间增长,叶片不断萎蔫,处理21 d 后植株死亡。轻度水涝和中度水涝处理下发草叶片颜色变化不明显,但是新叶的形成受到抑制,叶片数变少,根系减少。重度水涝处理下随着胁迫时间增长,叶片发黄,根尖变褐变黑,叶片及枯落物腐烂发臭,处理28 d 后地上部分全部腐烂、部分根系腐烂。
对照发草地上部分 Pro 含量为 58.82 μg·g−1,干旱胁迫和水涝胁迫均使发草植物Pro 含量显著增加(P<0.05)。中度干旱处理下发草地上部分Pro 含量达到 142.10 μg·g−1,是对照的 2.4 倍;中度水涝处理下发草地上部分 Pro 含量达到 120.36 μg·g−1,约是对照的2.0 倍。不同的水分胁迫对发草根系的抑制作用与地上部分的抑制作用基本一致,相同的水分处理下发草根系和叶片中Pro 含量相差不大(图1)。上述结果表明,干旱到水涝的系列水分胁迫下发草地上部分和根系中Pro 含量均显著增加,从而参与渗透调节来抵制逆境。

图1 不同水分处理下发草地上/地下部分的Pro 含量Fig. 1 Proline content in the shoot/root of D. caespitosa un⁃der different water treatments
2.2 水分胁迫对发草地上/地下部分Pro 代谢底物和中间产物含量的影响
植物Pro 代谢途径包括Glu 途径和Orn 途径,Glu和Orn 分别是这两种代谢途径中的底物。对照和轻度水涝处理下发草地上部分Glu 含量很高,分别达到18.64 和 19.35 μg·g−1。但是中度水涝、轻度干旱和中度干旱处理下发草地上部分中Glu 含量显著下降(P<0.05),最低只有11.46 μg·g−1(图2)。对于根系而言,不同水分胁迫的抑制作用与对地上部分的抑制作用基本一致,相同的水分处理下发草根系中的Glu 含量大于地上部分的含量。对照发草地上部分Orn 含量最高,达到5.73 μg·g−1。干旱胁迫和水涝胁迫均使发草地上部分Orn含量显著下降(P<0.05),中度水涝条件下发草地上部分Orn 含量只有1.74 μg·g−1,约是对照的1/3(图2)。对于根系而言,轻度干旱胁迫与轻度水涝胁迫下Orn 含量与对照没有显著差别,但是中度干旱胁迫和中度水涝胁迫使植物Orn 含量显著降低(P<0.05)。相同的水分处理下发草根系中的Orn 含量与地上部分的含量相差不大。上述结果表明,干旱到水涝的系列水分胁迫下发草地上部分和根系中Glu 和Orn 含量均显著减少,从而参与Pro 代谢途径以生成更多Pro。
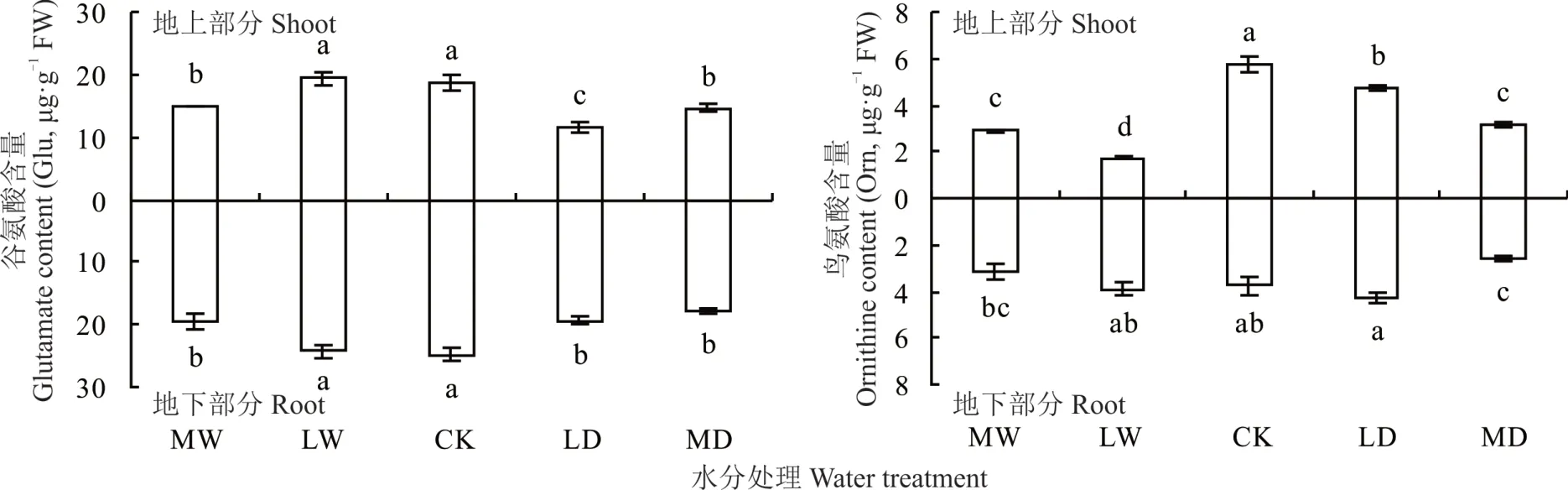
图2 不同水分处理下发草地上/地下部分Pro 代谢底物Glu 和Orn 的含量Fig. 2 Glu and Orn content in the shoot/root of D. caespitosa under different water treatments
GSA 和P5C 是植物Pro 合成途径中的中间代谢产物。对照发草地上部分GSA 含量最低,为1.26 μg·g−1。轻度水涝、轻度干旱和中度干旱处理下发草地上部分中GSA 含量显著升高(P<0.05),最高达2.65 μg·g−1。干旱胁迫及中度水涝胁迫下发草根系GSA 含量与对照没有显著性差异,轻度水涝胁迫下发草根系GSA 含量显著升高,为2.14 μg·g−1。相同水分处理下发草地上部分和根系中GSA 含量间没有显著差异(图3)。从图3 发现,干旱到水涝的系列水分胁迫下发草地上部分P5C 含量变化趋势与GSA 变化趋势一致。对于根系而言,对照P5C 含量与轻度干旱胁迫、轻度水涝胁迫间没有显著差别,但是中度干旱胁迫、中度水涝胁迫下P5C 含量均分别显著低于轻度干旱胁迫和轻度水涝胁迫(P<0.05)。上述结果表明,水分胁迫下Glu 和Orn 在酶的作用下生成大量GSA,而GSA 和P5C 可以自发地相互转化,因此GSA 含量的升高导致P5C 含量的升高。
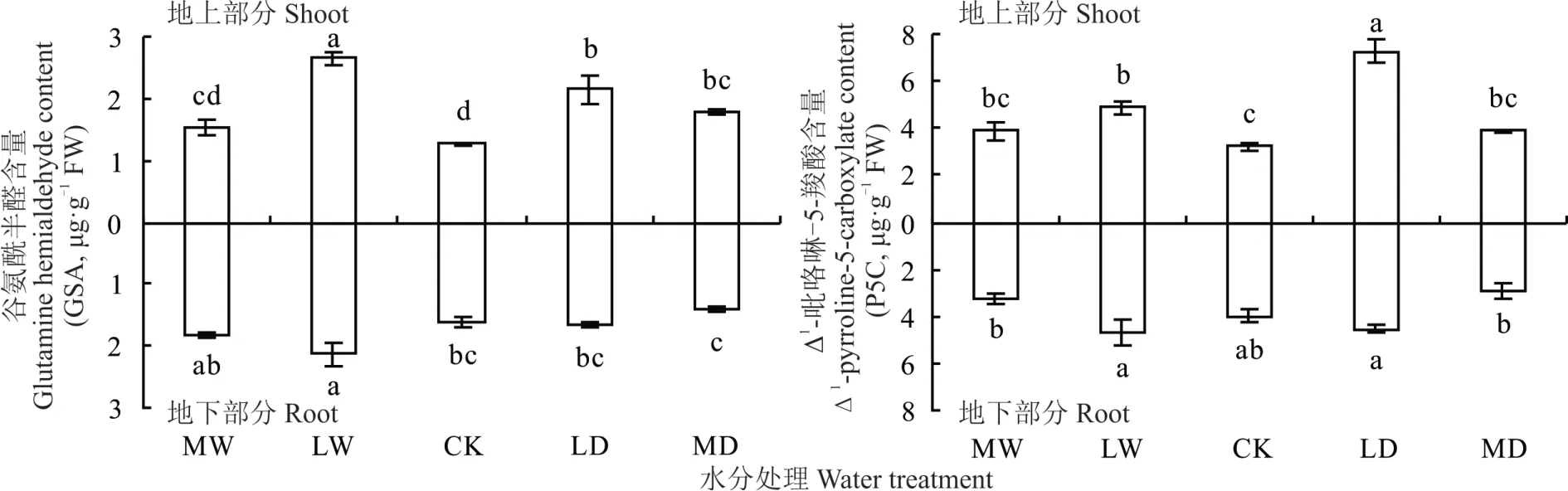
图3 不同水分处理下发草地上/地下部分Pro 代谢中间产物GSA 和P5C 含量Fig. 3 GSA and P5C content in the shoot/root of D. caespitosa under different water treatments
2.3 水分胁迫对发草地上/地下部分Pro 代谢关键酶活性的影响
P5CS、P5CDH、δ-OAT、P5CR 和 ProDH 是植物 Pro 合成途径中的关键酶。P5CS 是 Glu 途径中的限速酶,Glu 在P5CS 的催化作用下生成GSA,进而生成Pro。根据表1 可知,水涝胁迫和干旱胁迫下发草地上部分及根系中P5CS 活性均显著增强(P<0.05),地上部分与根系P5CS 活性相差不大。Glu 途径中Glu 生成GSA 是可逆反应,P5CDH 是逆反应的催化酶。水涝胁迫下发草地上部分P5CDH 活性没有显著变化,但是干旱胁迫显著抑制了P5CDH 活性(P<0.05)。对根系而言,水涝胁迫和干旱胁迫下P5CDH 活性均显著低于对照(P<0.05)。地上部分和根系中P5CDH 活性相差不大。δ-OAT 是Orn 途径中的关键酶,可将Orn 转化为GSA,进而合成Pro。对照发草地上部分δ-OAT 活性最低,仅为20.85 U·g−1,轻度干旱和轻度水涝处理下δ-OAT 活性显著增强(P<0.05)。对根系而言,水涝到干旱的系列水分胁迫均显著提高δ-OAT 活性(P<0.05)。发草地上部分δ-OAT 活性高于根系。P5CR 是Pro 生物合成通路上的一个关键酶,可将P5C 还原成Pro。对照中发草地上部分P5CR 活性最低,为11.35 U·g−1。水涝胁迫和中度干旱胁迫均显著提高P5CR 活性。根系中P5CR 活性变化趋势与地上部分基本一致,但地上部分P5CR 活性高于根系。ProDH 是Pro 降解反应的限速酶,将Pro 降解为P5C。在干旱胁迫下,发草地上部分ProDH 活性显著下降,以此来减缓Pro 的降解。干旱到水涝的系列水分胁迫对发草根系中ProDH 活性没有显著性影响。发草地上部分和根系中ProDH 活性没有显著性差异。
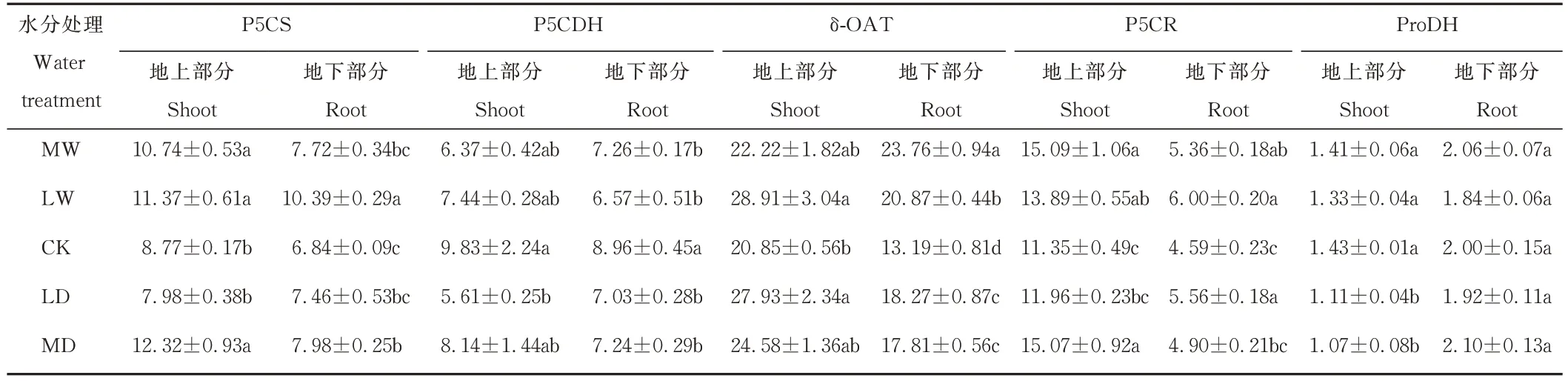
表1 不同水分处理下发草地上/地下部分Pro 代谢关键酶的活性Table 1 Activity of key enzymes in Pro metabolism in the shoot/root of D.caespitosa under different water treatments(U·g-1 FW)
2.4 发草地上/地下部分Pro 代谢中各代谢物、关键酶之间的相关性
对水分胁迫下发草地上部分Pro 代谢途径中Pro、Glu、Orn 等10 个指标进行Pearson 相关性分析(表2),结果表明:发草地上部分Pro 含量与P5CS 和P5CR 活性具有极显著正相关关系(P<0.01);Glu 含量与P5C 含量具有显著负相关关系(P<0.05),与 P5CS、P5CDH 和 ProDH 活性具有显著正相关关系(P<0.05);Orn 含量与 GSA含量具有极显著正相关关系(P<0.01),与P5C 含量和δ-OAT 活性具有显著正相关关系(P<0.05);GSA、P5C含量与δ-OAT 活性均具有显著正相关关系(P<0.05);P5CR 活性与P5CS 和P5CDH 活性分别具有极显著(P<0.01)和显著正相关关系(P<0.05)。
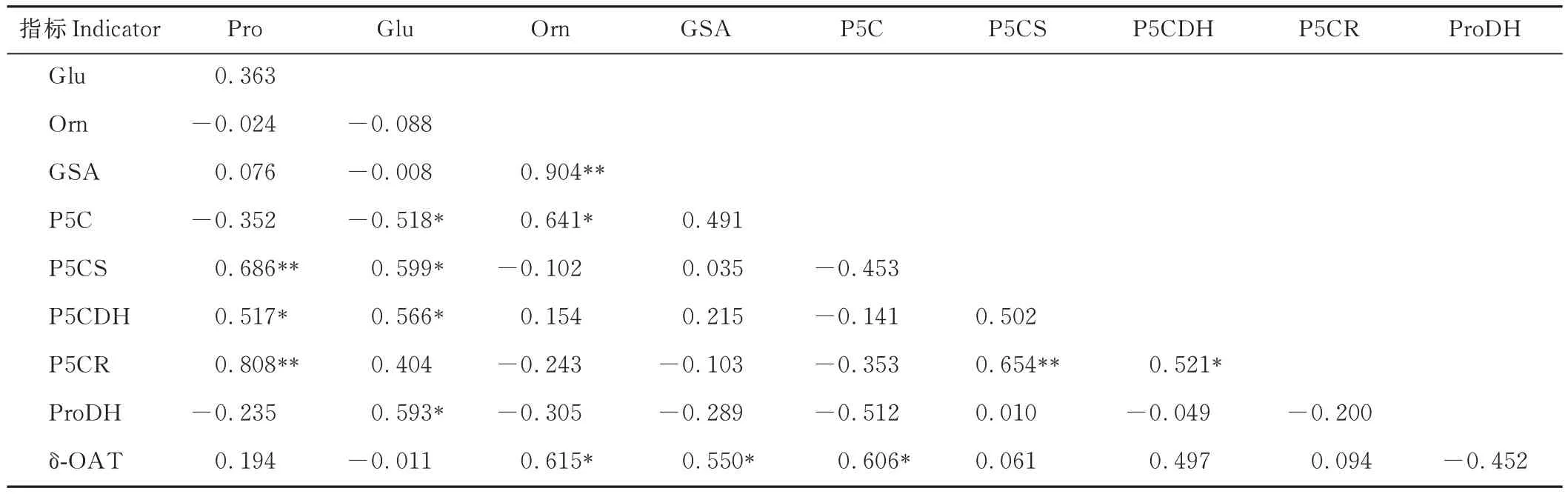
表2 发草地上部分Pro 代谢中各代谢物、关键酶之间的相关性Table 2 Correlation analysis of metabolites and key enzymes in Pro metabolism in the shoot of D.caespitosa
根据水分胁迫下发草地下部分Pro 代谢途径中各代谢物、关键酶之间的相关性分析(表3)发现,发草地下部分Pro 含量与P5CDH 活性具有极显著负相关关系(P<0.01);Glu 含量与Orn 和P5C 含量具有极显著负相关关系(P<0.01),与 P5CR 和 δ-OAT 活性具有显著负相关关系(P<0.05);Orn 含量与P5C 含量和 P5CR 活性具有极显著正相关关系(P<0.01),与 GSA 含量和 δ-OAT 活性具有显著正相关关系(P<0.05);GSA 含量与 P5CS 和
P5CR 活性均具有极显著正相关关系(P<0.01),与P5C 含量呈显著正相关关系(P<0.05),与P5CDH 活性存在极显著负相关关系(P<0.01);P5C 含量与P5CR 活性存在极显著正相关关系(P<0.01),与P5CDH 活性存在显著负相关关系(P<0.05)。

表3 发草地下部分Pro 代谢中各代谢物、关键酶之间的相关性Table 3 Correlation analysis of metabolites and key enzymes in Pro metabolism in the root of D.caespitosa
3 讨论
3.1 水分胁迫对发草Pro 含量变化的影响
植物通过调节体内各个系统来适应或缓解逆境对自身的伤害,而渗透调节是植物防御机制的第一道防线。渗透胁迫下,植物通过快速积累Pro、甜菜碱等渗透调节物质维持植物细胞膨压和生物活性分子构象[18−19]。Pro是分子透性最大、极易溶于水的相容性渗透剂和抗氧化剂,在抵抗渗透胁迫中发挥重要作用[17,24]。大量研究表明,植物受到干旱、水涝等水分胁迫时会通过积累Pro 来增强对逆境的抵抗能力[33−34],Pro 含量的多少与植物抗旱、抗盐性具有正相关关系[18−19]。本研究结果表明,干旱到水涝的系列水分胁迫下,发草地上部分和地下部分Pro 含量均显著升高(P<0.05),说明发草通过在地上部分和地下部分积累Pro 来缓解水分胁迫损伤。通常Pro帮助植物耐受/抵御水分胁迫是多种途径综合作用的结果:Pro 的积累可导致细胞渗透压浓度提高,进而驱使水分进入细胞或降低水分从细胞中流出,为细胞膨胀提供膨压,保护渗透平衡和亚细胞结构的稳定[23];Pro 和酶相互作用可以稳定蛋白质的结构,保持细胞膜完整性,防止膜蛋白变性[20];Pro 具有保护光复合物Ⅱ的作用[35],在光合作用中Pro 调节胞质酸碱度、提高光系统Ⅱ介导的光化学活性[36]。同时,Pro 是易于利用的能量资源,氧化1 分子Pro 可以产生30 个ATP,是逆境中植物的碳、氮和能量库[37]。因此,逆境中植物体内Pro 含量升高既可能是植物适应性的表现,也可能是植物细胞受损的表征[17−19]。本研究中发草植株内Pro 含量的升高是主动积累的过程,地上部分与根系积累的Pro 含量相差不大。李丹阳等[38]在研究玉竹(Polygonatum odoratum)的Pro 代谢途径时发现Pro 的积累主要发生在光合器官、生殖器官等代谢旺盛的部位,认为这是植物在渗透胁迫下的一种生态适应的“保命”策略,本研究结果与其不一致,可能是不同植物间存在的差异所致,有待进一步研究。
3.2 水分胁迫对发草Pro 代谢关键酶活性变化的影响
胁迫条件下Pro 的积累可能存在多种原因,一方面是Pro 合成代谢加快,另一方面是Pro 氧化分解速率降低[13]。Pro 的生物合成途径有 2 条,包括以 Glu 为前体的 Glu 途径和以 Orn 为前体的 Orn 途径[14]。这两种合成途径在 Pro 积累中的作用随物种、生境因素的不同而不同[18−20]。Glu 途径中 Glu 生成 GSA 是可逆反应,P5CS 是 Glu途径中的限速酶,P5CDH 是逆反应的催化酶[22−23]。δ-OAT 是 Orn 途径中的关键酶[24−25]。Pro 降解过程是合成过程的逆过程,PorDH 是Pro 降解过程中的限速酶[22−23]。因此,水分胁迫下,植物体内Pro 代谢关键酶活性变化直接决定着Pro 的合成和分解代谢。本研究中,干旱胁迫和水涝胁迫下,发草植株内Glu 途径中底物Glu 的含量和Orn途径中底物 Orn 的含量均显著下降(P<0.05),同时,P5CS 活性、δ-OAT 活性、P5CR 活性均显著增强(P<0.05),表明Pro 合成代谢中Glu 途径和Orn 途径共同加强。而P5CDH 和ProDH 活性显著降低(P<0.05),表明Pro 分解代谢受到抑制。这说明水分胁迫条件下发草根系和地上部分中Pro 含量升高是通过合成代谢的加强和分解代谢的抑制而主动积累的结果,这与Das 等[20]的研究结果相似。本研究中,水分胁迫下Glu 和Orn 分别在P5CS 和δ-OAT 作用下生成大量GSA,但P5CDH 的活性降低,所以只有少量的GSA 再次转变为Glu。同时GSA 和P5C 可以自发地相互转化,GSA 和P5C 的含量均升高。Pro 合成的2 条途径对渗透胁迫下Pro 积累的贡献还存在较多的争议。本研究中,水分胁迫下发草地上部分Glu 含量和Orn 含量均显著下降(P<0.05),根系中仅Glu 含量显著下降(P<0.05)而Orn 含量没有显著变化。相同的水分处理下地上部分Glu 含量小于根系。同时,地上部分δ-OAT 活性强于根系。这表明发草地上部分Pro 的积累由Glu 途径和Orn 途径协同作用,但根系中Pro 的积累以Glu 途径为主。根系中Glu 含量与Orn 含量具有极显著负相关(P<0.01),一方面可能是由于水分胁迫下植物体内P5CS 活性会受到Pro 反馈调节,而δ-OAT 活性则不受Pro 反馈抑制。另一方面,P5CS mRNA 和δ-OAT mRNA 的表达可能与植物体内氮素水平有关,渗透胁迫及低氮条件下以Glu 途径为主;非渗透胁迫及高氮时Orn途径占据主导地位[15,39−40]。本试验结果可能是发草地上部分氮素水平较高,水分胁迫时间(35 d)过长,所以激活了地上部分Orn 途径,但具体参与调控的机制有待进一步研究。
4 结论
干旱到水涝的系列水分胁迫下,发草通过提高其Pro 含量来缓解渗透胁迫造成的伤害。发草植株内Pro 含量的升高是主动积累的过程,地上部分与根系积累的Pro 含量差不多。地上部分Pro 积累是Glu 途径和Orn 途径共同作用的结果,但根系中以Glu 途径为主。

