小儿体外心肺复苏临床结果的回顾性研究
邓宇航,罗丹东,朱卫中,郭予雄,章晓华,温树生,陈寄梅,庄 建,周成斌
体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR)是对传统心肺复苏(conventional cardiopulmonary resuscitation,CCPR)不能恢复自主循环(restoration of spontaneous circulation, ROSC)或反复心脏骤停不能维持血流动力学稳定的患者,快速实施体外膜氧合(extracorporeal membrane oxygen⁃ation,ECMO)技术替代心肺功能,以保证重要脏器有效灌注与充足氧供[1]。 2009 年至2015 年间,体外生命支持组织(Extracorporeal Life Support Organi⁃zation, ELSO)的数据显示新生儿和儿科ECPR 的数量分别增加了35%和67%[2],与接受CCPR 的儿童相比,ECPR 插管儿童的神经系统预后更佳。 因此,当心脏骤停的病因被认为是“可能恢复或适合心脏移植”时,美国心脏协会(American Heart Associa⁃tion,AHA)建议对该心脏病患儿考虑使用ECPR[3]。对于小儿患者,国外各中心所报告的ECPR 出院生存率从14%到56%不等[4]。 与ECPR 生存相关的危险因素包括神经系统并发症,高乳酸和较长的ECMO 持续时间等[5]。 国内儿童ECPR 起步较晚,对于控制ECPR 生存相关危险因素的经验不足。 本文回顾单中心小儿ECPR 临床资料,探讨死亡与并发症的高危因素,以指导临床治疗。
1 资料与方法
1.1 临床资料 本研究是经广东省人民医院伦理审查委员会审核批准(GDREC2019775H)后进行的一项单中心回顾性研究。 该研究纳入了本院在2015 年1 月至2018 年12 月之间接受ECPR 的所有14 岁(不包含)以下患者。 ECPR 的定义是在院内心脏骤停的心肺复苏中使用ECMO。
当发生心脏骤停,经过CCPR 处理5~10 min 不能恢复ROSC 或恢复ROSC 但不能维持循环稳定,随时可能再次心脏骤停,启动ECPR 救治流程,告知家属,ECMO 团队组装ECMO 管路,外科建立插管。ECMO 管路主要有ECMO 套包(索林)或离心泵(美敦力)和膜肺(Medos)的组装管路。 插管地点分布在手术室、小儿ICU 或普通病房。 ECMO 持续时间定义为从插管开始到最终拔管的时间。 插管部位分为中央插管(胸骨正中切开,升主动脉/右房)、腹股沟插管(股静脉/动脉)或右颈部插管(颈内静脉/颈总动脉)。 采集ECMO 转流前后的生命体征,记录患儿ECMO 前24 h 内血气分析中最差的pH、乳酸(lactic acid, Lac)和HCO3-离子数值;收集ECMO转流后24 h 内的实验室检测指标,包括血红蛋白、血小板计数、淋巴细胞、胆红素、白蛋白和肌酐(cre⁃atinine,Cr)等。
1.2 ECMO 相关并发症的分类如下 ①严重出血并发症,定义为需要返回手术室止血或其他需要处理的出血事件。 ②严重血栓并发症,膜肺或管路中可见血栓,需要更换管路。 ③ECMO 期间病原体培养阳性,包括呼吸道分泌物、尿液、血液、伤口分泌物或胸骨培养物。 ④严重肾脏损害,需接受连续肾脏替代治疗(continuous renal replacement therapy,CRRT):启动CRRT 的标准包括少尿肾衰竭、尿毒症、严重电解质紊乱和代谢紊乱。 ⑤神经系统并发症:包括脑出血、脑梗塞、癫痫发作、脑死亡和脑循环障碍等,主要表现为昏迷、抽搐、四肢肌肉强直、瞳孔对光反射异常等体格检查异常。
主要结局是生存至出院,次要结局是生存至ECMO 脱机。 本研究评估了影响ECMO 生存和并发症的因素,特别是需要接受CRRT 治疗的肾脏并发症因素。
1.3 统计分析 计量资料采用t检验、均数±标准误(±s)表示,卡方检验用以比较分类变量。 运用单变量logistic 回归模型评估与ECPR 后出院生存相关的所有潜在因素,然后使用与出院生存率相关的所有临床因素和统计学上显着因素拟合多变量logistic 回归模型。 采用单变量logistic 回归模型评估与接受CRRT 相关的所有潜在因素,然后使用与CRRT 相关的统计学上显著因素拟合多变量logistic回归模型,并报告原始比值比(OR)。 所有统计分析均使用SPSS 23.0 版本进行,P<0.05 被认为有显著统计学意义。
2 结 果
2.1 一般特征 共有52 名患儿获得ECPR 支持被纳入研究,其中13 名为新生儿(≤28 d),30 名婴儿(28 d~1 岁)和9 名儿童患者(1 ~14 岁)。 其中19例(36.5%)患者存活至脱机,10 例(19.6%)存活至出院。 存活组和死亡组之间,包括性别、年龄、体重、身长、心肺转流(cardiopulmonary bypass, CPB)时间、主动脉阻断(aortic cross clamp,ACC) 时间、ECPR 前血压等没有统计学差异,见表1。
表1 ECPR 患儿的一般特征(±s)
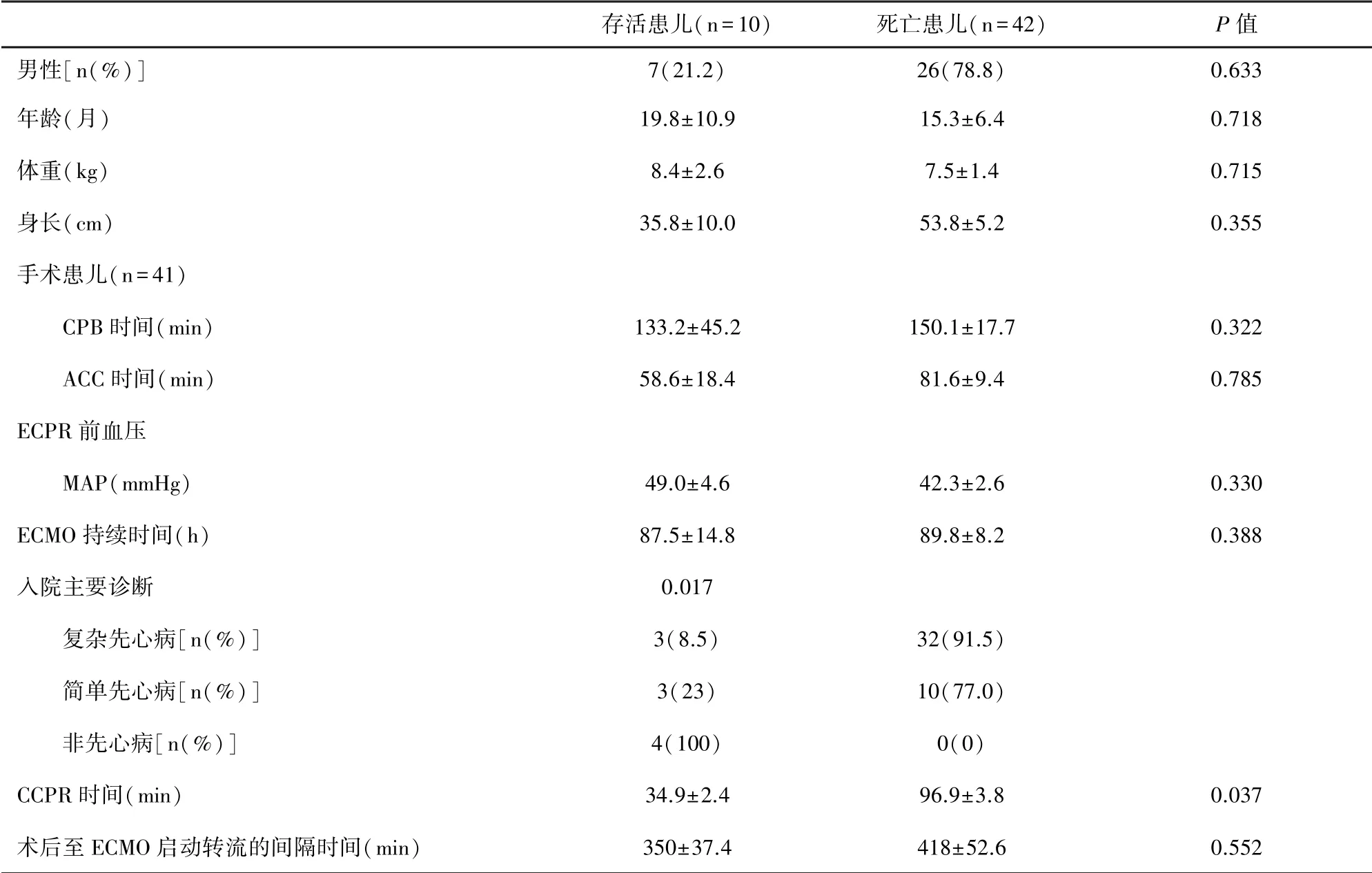
表1 ECPR 患儿的一般特征(±s)
注:CPB:心肺转流;ACC:主动脉阻断;ECPR:体外心肺复苏;MAP:平均动脉压;ECMO:体外膜氧合;CCPR:传统心肺复苏
存活患儿(n =10) 死亡患儿(n =42) P 值男性[n(%)] 7(21.2) 26(78.8) 0.633年龄(月) 19.8±10.9 15.3±6.4 0.718体重(kg) 8.4±2.6 7.5±1.4 0.715身长(cm) 35.8±10.0 53.8±5.2 0.355手术患儿(n =41)CPB 时间(min) 133.2±45.2 150.1±17.7 0.322 ACC 时间(min) 58.6±18.4 81.6±9.4 0.785 ECPR 前血压MAP(mmHg) 49.0±4.6 42.3±2.6 0.330 ECMO 持续时间(h) 87.5±14.8 89.8±8.2 0.388入院主要诊断 0.017复杂先心病[n(%)] 3(8.5) 32(91.5)简单先心病[n(%)] 3(23) 10(77.0)非先心病[n(%)] 4(100) 0(0)CCPR 时间(min) 34.9±2.4 96.9±3.8 0.037术后至ECMO 启动转流的间隔时间(min) 350±37.4 418±52.6 0.552
52 例ECPR 患儿的主要病种是先天性心脏病(简称先心病,n =48),其中复杂先心病(n =35)包括法洛四联症、陶-宾综合征、右心室双出口、左心发育不全综合征、先天性大血管转位等;简单先心病(n =13)主要有房间隔缺损、室间隔缺损等。 非先心病(n =4)病种包括爆发性心肌炎、新生儿败血症、先天性膈疝。 复杂先心病患儿存活率为8.6%,简单先心病存活率23%,非先心病患儿全部存活出院(P=0.017)。 存活与死亡患儿ECMO 支持时间没有显著差异。 单因素分析中,存活患儿相较死亡患儿的CCPR 时间更短(P=0.037)。
2.2 ECPR 插管地点和部位 ECPR 插管地点在手术室、心外ICU 以及普通住院病房(表2),心外ICU建立ECPR 的例数最多,在手术室插管开展ECPR的存活率高(P<0.05)。 根据患儿的年龄、体重、外周血管粗细以及手术方式等决定插管部位,然而ECPR 插管部位(中央、颈部、腹股沟)在存活率方面无显著统计差异。
2.3 ECPR 前的实验室指标 ECPR 前存活与死亡患儿的血红蛋白、血小板计数、淋巴细胞、胆红素、白蛋白和Cr 等数值没有统计学差异。 死亡患儿的肌酸激酶同工酶(creative kinase MB, CKMB)明显高于存活患儿(P=0.001)。 ECPR 前24 h 最差血气分析中,存活患儿的Lac、pH 和HCO3-值均低于死亡患儿(P<0.01),见表3。

表2 ECPR 的插管地点和部位[n(%)]
2.4 ECMO 的并发症 ECMO 的主要并发症如图1所示,分别包括肾功能不全、出血、神经系统并发症、感染和血栓。 其中肾功能不全是最常见的并发症,少尿是突出表现,均采用CRRT 治疗,主要方式包括血液透析和腹膜透析两种,其中腹膜透析14 例,血液透析5 例。 在本研究中,有3 名患儿因肾功能衰竭引起的严重高钾血症在ECPR 前接受CRRT 治疗,有19 例(70.3%)患儿是ECPR 后因少尿接受CRRT 治疗。 出血或血栓形成并发症在两组之间无明显差异。 7 名(13.4%)患儿在ECMO 期间有神经系统并发症表现,在存活与死亡患儿之间并无显著的统计学差异(P=0.505),3 名(5%)患者在ECMO 期间血培养阳性,无1 例患儿存活至出院。
表3 ECPR 前的实验室指标(±s)
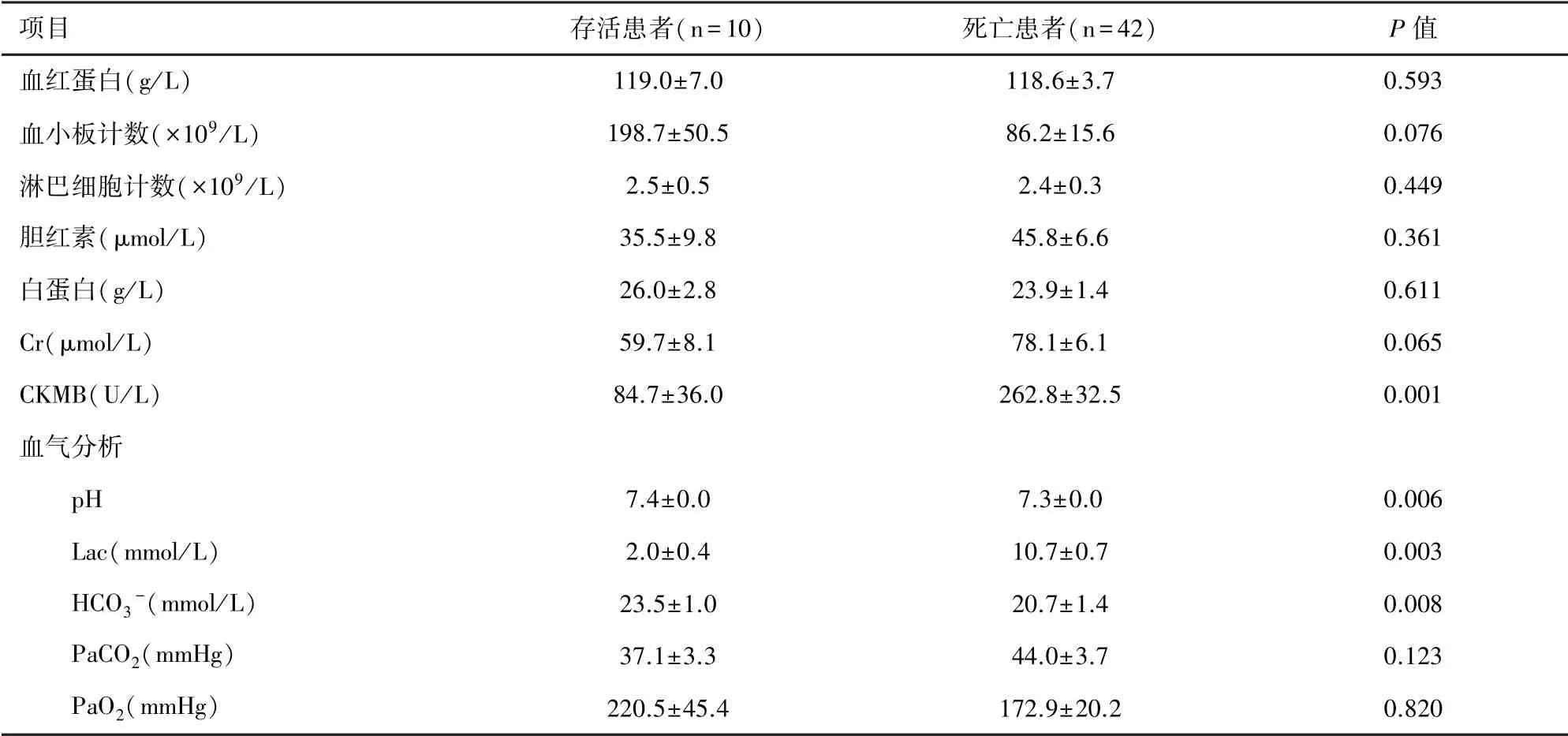
表3 ECPR 前的实验室指标(±s)
注:Cr:肌酐;CKMB:肌酸激酶同功酶;Lac:乳酸;PaCO2:动脉二氧化碳分压; PaO2:动脉氧分压
项目 存活患者(n=10) 死亡患者(n=42) P 值血红蛋白(g/L) 119.0±7.0 118.6±3.7 0.593血小板计数(×109/L) 198.7±50.5 86.2±15.6 0.076淋巴细胞计数(×109/L) 2.5±0.5 2.4±0.3 0.449胆红素(μmol/L) 35.5±9.8 45.8±6.6 0.361白蛋白(g/L) 26.0±2.8 23.9±1.4 0.611 Cr(μmol/L) 59.7±8.1 78.1±6.1 0.065 CKMB(U/L) 84.7±36.0 262.8±32.5 0.001血气分析pH 7.4±0.0 7.3±0.0 0.006 Lac(mmol/L) 2.0±0.4 10.7±0.7 0.003 HCO3-(mmol/L) 23.5±1.0 20.7±1.4 0.008 PaCO2(mmHg) 37.1±3.3 44.0±3.7 0.123 PaO2(mmHg) 220.5±45.4 172.9±20.2 0.820

图1 ECPR 患儿的并发症分布
2.5 接受CRRT 的相关因素 肾脏损伤是本中心最常见并发症,均采用CRRT 支持治疗。 对CRRT 相关因素进行了多元Logistic 回归分析(表4)。 单因素分析中ECMO 持续时间、ECPR 前的平均动脉压以及ECPR 前是否ROSC 均与进行CRRT 治疗有关。随着ECMO 持续时间的增加,接受CRRT 治疗的概率会有所增加。 ECPR 前患儿的平均动脉压降低也将导致接受CRRT 的概率增加。 是否ROSC 与接受CRRT 存在负相关。 ECPR 前曾经历过ROSC 的患儿,相较于未经ROSC 患儿,接受CRRT 的危险将会增加。 多元Logistic 回归模型中,并未发现ECPR 前Cr 值与接受CRRT 显著相关(P=0.400)。
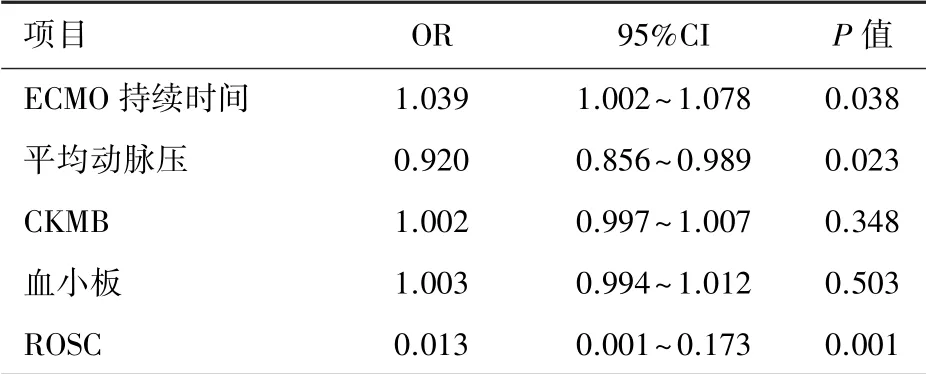
表4 CRRT 相关危险因素的多元logistic 回归分析
2.6 与生存相关的危险因素 对出院生存相关的危险因素进行Logistic 回归模型分析(表5)。 单因素分析中,相关危险因素包括复杂先心病、插管地点、CKMB 指标、Lac 水平以及HCO3-的浓度。 将以上五种指标纳入多元回归分析后发现,插管前患儿的乳酸水平与生存相关(中位数为10.35 mmol/L)。本中心高Lac 水平患儿(Lac>10.35 mmol/L)的死亡危险约是低Lac 患儿的3 倍。 而入院诊断为复杂先心病的患儿,其死亡危险较之非复杂先心病患儿更高,具有显著的统计学意义。 HCO3-可能是与生存相关的危险因素之一,但在本研究中,由于样本量等问题,尚未发现其与ECMO 患儿的出院生存相关。

表5 ECPR 患儿生存相关危险因素
3 讨 论
相对于成年ECPR,小儿ECPR 报道仍有限。AHA 在2016 年发布的指南评估中显示,相较于院内CCPR 时间超过10 min 的患儿,ECPR 更能改善患儿的出院生存率,且具有良好的神经功能预后[6]。2000 年至2011 年间,该组织研究了3 765 例患者,其中591(16%)接受了ECPR,3 165(84%)接受了CCPR,ECPR 患儿40%(237/591)的出院率远高于CCPR 患儿27%(862/3 165)出院生存率[7-8]。 本文根据单中心的数据探讨影响ECPR 后有利结局的临床相关因素。
3.1 心脏骤停及复杂先心病 在新生儿重症监护病房(NICU)中收治的新生儿和婴儿中,有1%~2.2%的概率发生心脏骤停,而在儿科重症监护病房(PICU)中收治的患儿中,则有2%~6%的心脏骤停[10-11]。已报道的出院患儿数据,婴儿的存活率介于20%~61%之间,儿科人群中存活率则介于10%~44%之间[12]。 在本项单中心回顾性研究中,患者群体中ECPR 的总体存活率为19%,低于2018 年ELSO 注册报告的数据[13],可能与本研究中先心病比例高相关。 多因素分析中复杂先心病是死亡的危险因素。而在Schmidt 等人提出的SAVE 评分中指出,先心病是一项重要的危险因素[14]。 复杂先心病患儿往往意味着更长的手术持续时间、心脏残余畸形以及愈发不良的一般状况。 研究指出在接受心脏直视手术后得到ECMO 支持的儿童中,约有四分之一有解剖学上的残留问题[15],该数据在复杂先心病患儿中比例可能更高,其中以残余分流及肺动脉高压为主。积极评估所有术后儿科心脏手术患者的残留病变,早期发现残留病变和再次干预能够有效改善ECPR的临床预后。
3.2 高Lac 水平 CPR 持续时间长或心脏停跳时间较长的患儿可能会发生明显的代谢性酸中毒和血清Lac 升高。 ECMO 后持续性代谢性酸中毒和血清Lac 升高可能是由于ECMO 流量不佳而引起的,其与插管大小或位置、出血、血容量不足、填塞、过度血管舒张、侧支径流过多或左心室扩张有关[16]。 在本研究中,幸存者和非幸存者之间的Lac 水平存在显着差异(P=0.016),这表明血Lac 水平是ECMO 患儿病情恶化的独立危险因素,研究结果与其他研究相似,较高的Lac 水平与ECMO 脱机失败及死亡显著相关[17]。 因此,尽早应用ECMO 逆转灌注不良和清除Lac 血症对于ECPR 的预后至关重要[18]。
3.3 低灌注时间 延长的低灌注时间将导致器官终末期损害,例如严重的肾脏或中枢神经系统损伤,预后不良。 因此,应尽早决定使用ECPR 以保持器官功能。 在波士顿儿童医院,若患儿经过两轮药物复苏后ROSC 失败,且心肺复苏持续时间为21 ~45 min[16],则启动ECPR。 在本研究中,低灌注持续时间为34.9 ~96.9 min,部分患儿的ECPR 程序时间过长。 单因素分析中,CCPR 时间与患儿的生存率有关(P=0.037)。 在心脏术后高危患儿中,延迟关胸及常备预充好的ECMO 设备或能节省ECPR 时间。
3.4 肾脏并发症 急性肾损伤(acute kidney injury,AKI)是本中心ECMO 患儿最常见并发症。 ECMO 支持基础上进行CRRT 的主要目的是治疗或预防液体超负荷,AKI 和电解质失衡[19-20]。 ELSO 注册中心的回顾性研究表明,死亡患儿往往存在更多的AKI 和CRRT 倾向,AKI 和CRRT 均可独立预测ECMO 治疗后新生儿及儿童的死亡风险[21]。 本研究中ECMO持续时间长、低平均动脉血压等会导致患儿接受CRRT 的机率增加,从而影响患儿的远期预后。 但存活和死亡患儿ECPR 前的Cr 水平在统计学上并无差异,表明患儿术前未存在肾脏损伤,ECPR 后发生急性肾损伤,可能是心脏骤停及CPR 期间出现的肾脏低灌注状态所致[22]。 因此,本研究认为可能是AKI 而非CRRT 本身会增加患儿的死亡风险[23]。
3.5 不足之处 本研究中的不足主要有患儿ECPR数量有限,病种以先心病为主,不能全面反应ECPR患儿的预后,危险因素的分析变量不足,仍需进行多中心研究来提高患儿的样本量。
4 结 论
单中心研究显示非心脏手术患儿的存活率高,复杂先心病降低小儿ECPR 的存活率。 肾功能不全并发症是小儿ECPR 的主要并发症,与ECPR 的持续时间、ECPR 前的平均动脉压相关。 ECPR 前24 h 内血Lac 值是评价小儿ECPR 预后的关键危险因素。

