肺保护通气与右美托咪定联合应用对胸腔镜下心脏手术患者的肺保护效果
李 帆,黄一丹,胡振飞,詹海婷,苟伟挺,吴鹏凯,吴建江
近年来微创手术逐渐成为主流,微创心脏手术也发展迅速并逐渐成为心脏外科手术的未来发展方向。 单肺通气(one-lung ventilation,OLV)技术是保证满意的手术视野和良好的双肺隔离的重要方法,这需要OLV 技术的保证。 但是由于在手术中患者OLV 期间肺组织的缺血再灌注损伤、氧化应激反应亢进、炎性因子反应进一步增强等因素进一步促进了手术围术期急性肺损伤的发生。 以往研究显示肺保护性机械通气策略能改善机体氧合、改善术后肺损伤、减少炎性因子的释放、减轻术后肺部感染[1-2]。 现有研究表明右美托咪定(Dexmedetomi⁃dine,Dex)可以抑制机体炎症反应、降低机体白介素(interleukin,IL)IL-1、IL-6、肿瘤坏死因子-α(tumor necrosis factor,INF-α)等炎性因子的表达[3],造成IL-10 的爆发并且使NF-κB 活化水平受到抑制[4-5],减弱机体氧化应激反应,从而达到减轻心肺转流(cardiopulmonary bypass, CPB)手术中肺损伤的作用[6]。 笔者查询相关文献后,发现关于Dex 与肺保护通气策略联合用于胸腔镜下心脏手术减轻患者肺功能损伤报道并不多见。 本次实验主要观察胸腔镜下心脏手术中结合运用肺保护通气策略与Dex联合应用的肺保护效果,报告如下。
1 资料与方法
1.1 一般资料 纳入标准:①择期行胸腔镜下心脏手术的患者;②美国纽约心脏病学会(New York Heart Disease Assocation,NYHA)心衰程度分级为Ⅱ~Ⅲ级; ③年龄18 ~65 岁。 排除标准:①不停跳心脏手术;②术前严重高血压病史或者心功能不全;③哮喘、肺气肿病史;④术中脉搏氧饱和度(SpO2)<90%或者动脉氧分压(PaO2)<60 mmHg;⑤术中改变手术方式。
1.2 研究设计 采用密闭信封随机法将60 例患者分为4 组各组15 例。 肺保护性机械通气策略组(A组)、单独使用Dex 组(B 组)、Dex 与肺保护性机械通气策略联合应用组(C 组)、空白对照组(D 组)。
1.3 麻醉方法 所有患者入室后常规监测心电图、脉搏血氧饱和度,左侧Allen 试验阴性行左侧桡动脉穿刺置管,持续监测患者动脉血压。 麻醉诱导开始前10 min B 组和C 组手术患者从外周静脉用静脉泵匀速泵入Dex 负荷剂量0.5 μg/kg 后按0.6 μg/(kg·h)的速度持续静脉泵注至患者出室;A 组、D组患者按B、C 组患者右美剂量使用等量生理盐水泵注。 B 组、C 组Dex 负荷量泵注结束后开始麻醉诱导,咪唑安定0.1 mg/kg,舒芬太尼2 μg/kg,静安1 mg/kg,爱可松1 μg/kg,5 min 后行左侧双腔支气管插管,按患者左侧支气管直径选取合适管号并确认插管位置,机控呼吸。 A 组、C 组双肺通气及OLV期间均设置潮气量6 ml/kg,呼气末正压(positive end-expiratory pressure,PEEP)通气5 cmH2O,氧浓度分数(FiO2)70%,呼吸频率14 ~16 次/min,吸呼比(I ∶E)=1 ∶2,呼气末二氧化碳分压(PETCO2)维持在35~45 mmHg。 B、D 组于双肺通气及OLV 期间均采用潮气量9 ml/kg,PEEP 0 cmH2O,FiO2100%,呼吸频率12 次/min,I ∶E 比为1 ∶2,PETCO2维持在35 ~45 mmHg。 静脉维持采用全程静脉麻醉,使用丙泊酚、舒芬太尼。 在麻醉深度监测仪(Narcotrend)的监测下将麻醉深度维持于D2 ~E1水平。 术中维持脉搏氧饱和度(SpO2)>90%,如低于该值则逐渐增高吸入氧浓度,如SpO2仍上升不佳,则间断双肺通气。 术后所有患者带气管插管入ICU。
1.4 手术操作 所有患者仰卧位右侧胸部抬高30°后行股动脉、股静脉插管连接预充好的CPB 管道。右前外侧乳房下切口,手术开始后夹闭右侧气管导管,右侧肺萎陷,左侧OLV。 在第4 肋进胸腔,右腋中线第3 肋或者是第6 肋间腋中线放置胸腔镜。CPB 开始同时停止患者呼吸。 主动脉阻断后全身灌注流量保持在60 ~80 ml/(kg·min)。 复温至鼻咽温>36.5℃待主要手术操作完成之后,麻醉医师膨肺排出气体,外科医师松开主动脉钳心脏复跳,恢复呼吸,仍行左肺单侧通气。 撤离股静脉插管,待患者循环稳定后使用鱼精蛋白,最后拔出股动脉插管。确定胸腔内没有出血后行双肺通气,关胸。 所有手术操作完成后,单管替换双腔管,患者带气管插管麻醉状态送ICU。
1.5 观察指标 ①记录四组患者于麻醉诱导前(T0)、单肺通气前即刻(T1)、单肺通气30 min(T2)、恢复双肺通气前即刻(T3)、恢复双肺通气15 min(T4)、手术结束后(T5)、术后2 h(T6)各时间点的收缩压(systolic blood pressure, SBP)、舒张压(di⁃astolic blood pressure, DBP)、心率(heart rate, HR)及气道峰压(airway peak pressure, Ppeak)、气道平台压(airway plateeau pressure, Pplat)、气道阻力(airway resistance, Raw)。 ②计算四组患者术中各组时间点的氧合指数(oxygenation index,OI)。 ③测定四组患者各个时间点血浆内TNF-α、 IL-6 和丙二醛(malondialdehyde, MDA)的浓度。
1.6 统计学方法 应用SPSS 20.0 统计软件分析数据,计量资料属于正态分布所以以均数±标准差(±s)表示,组间比较采用成组t检验,组内比较采用重复测量设计的方差分析;计数资料采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结 果
2.1 一般资料比较 四组患者性别、年龄、体重、心功能分级、CPB 时间、OLV 时间等差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 四组患者SBP 和DBP 不同时间点比较 与D组相比,B 组与C 组患者于T2 ~T4 时间点SBP 和DBP 均明显升高(P<0.01);与A 组相比,B 组于T2~T4 时间点、C 组患者于于T1 ~T3 时间点SBP和DBP 均明显升高(P<0.01)。 见图1 和图2。
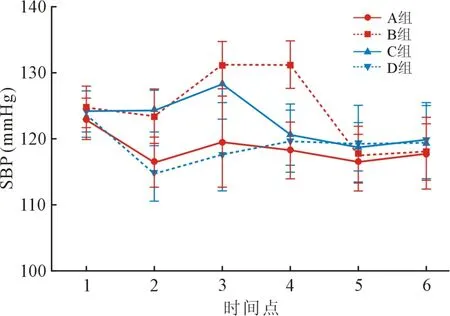
图1 四组患者不同时点SBP 比较

图2 四组患者不同时点DBP 比较
2.3 四组患者HR 不同时间点比较 与D 组和A组相比,B 组和C 组患者于T2 ~T4 时间点HR 明显降低,有统计学意义。 见图3。

图3 四组患者不同时点HR 比较
2.4 四组Ppeak 不同时间点比较 与T1 相比,各组患者于OLV 期间T2~T4 时间点Ppeak 均显著升高(P<0.01)。 与D 组相比,B 组于T3 ~T5 时间点明显降低(P<0.01);C 组于T3 ~T5 时间点明显降低(P<0.01);A 组于T2 ~T5 时间点明显降低。见图4。

图4 四组患者不同时点Ppeak 比较

表1 患者一般情况及术中情况(n=15)
2.5 四组Pplat 不同时间点比较 B 组T2 和T3 时间点均显著升高(P<0.01)。 与D 组相比,C 组于T2、T4 和T5 时间点均明显降低(P<0.01);A 组于T2 和T4 时间点明显降低(P<0.01)。 与C 组相比,A 组于各个时间点无差异(P>0.05),B 组于T2 ~T5时间点明显增高(P<0.01)。 见图5。
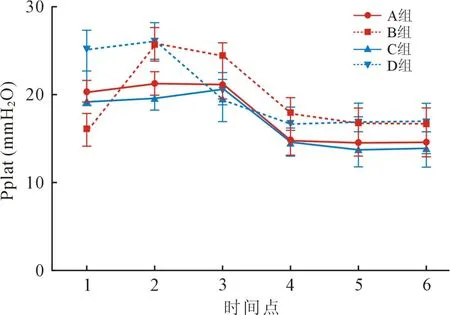
图5 四组患者不同时点Pplat 比较
2.6 四组Raw 不同时间点比较 与T1 相比,四组患者于OLV 期间T2、T4 ~T6 时间点均Raw 显著升高(P<0.01)。 与D 组相比,A 组和B 组于T2 ~T4时间点明显降低(P<0.01)。 C 组于T2 ~T6 时间点明显降低(P<0.01)。 见图6。
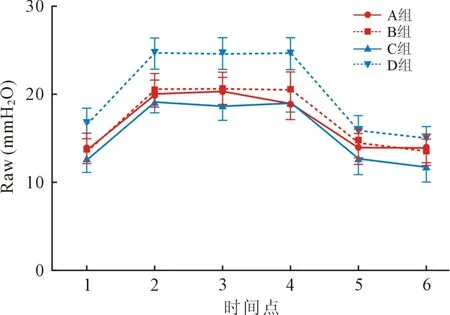
图6 四组患者不同时点Raw 比较
2.7 四组OI 不同时间点比较 与T1 时间点相比,四组患者于OLV T2 ~T4 时间点OI 均显著降低(P<0.01)。 与D 组相比,B 组T1 时间点OI 升高(P<0.05)。 C 组于T1~T6 时间点均明显升高(P<0.05)。 与C 组相比,A 组于T1 ~T6 各个时间点均明显降低(P<0.01);B 组于T1、T3 ~T6 点均显著降低(P<0.05)。 见图7。

图7 四组患者不同时点OI 比较
2.8 四组TNF-α 浓度不同时间点比较 与T1 相比,四组患者T3 ~T6 点TNF-α 明显升高。 与D 组相比,A 组患者于T3、T4、T6 时间点均显著降低(P<0.01)。 B 组T3~T6 时间点均显著降低(P<0.01)。C 组于T2~T6 时间点均显著降低(P<0.01)。 与C组相比,B 组于T2 时间点显著升高(P<0.01)。 见图8。
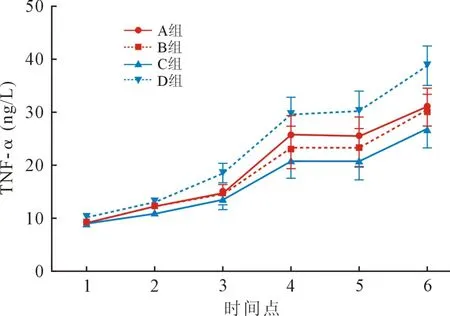
图8 四组患者不同时点TNF-α 比较
2.9 四组IL-6 浓度不同时间点比较 与T0 点相比,四组患者T2 ~T5 点IL-6 显著增高。 与D 组相比,A 组患者于T2~T5 时间点均显著降低(P<0.01)。C 组于T2~T5 时间点均显著降低(P<0.01)。 与C组相比,A 组患者于T2~T5 时间点均显著升高(P<0.01);B 组患者于T1、T2、T4 和T5 时间点均显著升高(P<0.01)。 与B 组相比,A 组患者于T1、T2 和T4 时间点升高(P<0.05)。 见图9。
2.10 四组不同时间点MDA 浓度比较 与T1 时间点相比,D 组患者于T3~T6 点MDA 水平显著增高,B 组患者于T4 点MDA 浓度明显增高,而C 组患者仅在T2 时间点显著升高(P<0.01)。 与D 组比较,A 组、B 组和C 组患者于T3 ~T6 时间点显著降低见图10。

图9 四组患者不同时点IL-6 比较

图10 四组患者不同时点MDA 比较
3 讨 论
术后肺功能损伤是CPB 下心脏手术最常见的并发症之一,也是患者死亡的主要原因之一。 因术后肺功能不全导致的患者围术期死亡率甚至达到了50%[7-8]。 OLV 能够通过肺隔离技术获得满意的手术术野,从而为手术的正常进行保驾护航。 但是,由于OLV 与正常生理通气方式不同造成患者通气血流比失衡,从而导致患者氧合降低。 为了提高改善患者氧合,大多数麻醉医师都会选择增加潮气量,提高吸入氧浓度,通气侧使用高PEEP 等方式来改善患者的氧合状态。 但是这种高潮气量、高氧浓度吸入、高气道压的OLV 模式本来就是引起胸腔镜术后肺损伤的重要因素之一。 肺保护性机械通气策略是指在维持合适的机体氧合和患者能承受的最低氧供的条件下,为了预防肺泡过度膨胀和使塌陷的肺泡重新打开,从而保护患者肺功能、降低术后肺部并发症、降低术后院内患者死亡率的通气方式[9],其中临床上常用的措施包括:小潮气量、适合的PEEP、低吸入FiO2、定时肺复张。 多项研究表明在需要OLV 的患者中采用肺保护性通气策略能够有效的降低炎性因子的产生减轻患者肺部损伤[10-12]。 Dex 是一种临床常用麻醉药,其抗炎和肺保护作用已经得到大量试验的证实[13-14]。 虽然研究证实通过在OLV 中使用肺保护性机械通气策略能够减轻机械通气引起的肺部炎症与氧化应激反应、减轻机械通气造成的肺损伤、降低术后肺部并发症。 但是有一些文献指出“保护性肺通气策略”仍然会引起肺组织损伤以及相关炎性因子释放[15-16]。 而大多数的研究均已经证实Dex 能够通过一系列机制对肺部进行保护,包括抗交感神经、抑制氧化应激以及炎症反应等从而发挥抗炎作用,具有明显的改善氧合、抗炎抗氧化及肺保护作用。 因此,笔者将肺保护性机械通气策略与Dex联合应用于CPB 胸腔镜下心脏手术,来观察二者联合使用是否会增强肺保护作用。
以往的高容量、高氧浓度、高气道压的OLV 模式一方面由于导致患者肺部通气血流比值失衡,导致患者氧合降低,另一方面因为使用了大潮气量使通气侧肺的Ppeak、Raw、Pplat 增加,加重患者肺功能的损伤。 司建洛[17]等的研究发现与常规大潮气量的通气方式相比,这种小潮气量、高频率、适当PEEP的通气方式能够明显降低患者术中Ppeak、Raw,改善患者氧合。 邹斌[18]等人在一项肺保护性通气策略用于胸腔镜肺癌根治患者术中OLV 策略的研究中发现:肺保护通气策略相比传统大潮量OLV 模式,患者Ppeak,Raw,Pplat、IL-10、IL-8、TNF-α 明显降低。 本研究中发现Dex+肺保护性通气策略组(C组)与剩下三组相比,Ppeak、Raw、Pplat 均明显下降(P<0.01),这与以往的研究相一致。
OI 因为其计算简单方便,即与机体内的缺氧情况有较好的相关性,又能较好的反应机体肺内血液分流量,所以是目前最常用的监测肺部氧合的指标。本研究发现:与T0 相比,所有分组患者OLV T2 ~T4时间点的OI 均显著降低(P<0.01),说明OLV 不利于患者氧合。 与D 组相比,C 组于T1~T6 时间点OI明显升高。 与C 组相比,A 组T1~T6 各个时间点OI明显降低。 B 组于T1、T3~T6 点OI 降低有统计学意义(P<0.01)。 说明肺通气策略与Dex 有改善患者OLV 氧合的效果。 二者联用改善患者氧合作用强于单独分别使用。
TNF-α 是一种肺部炎症反应早期即可出现的物质。 已知TNF-α 能够通过刺激IL-6、IL-8 等炎性介质等的释放,在肺损伤的病理过程中起重要作用[19]。 IL-6 是一种早期参与炎症反应和组织损伤的物质,它的表达高低与炎症反应的严重程度和持续时间相关,是一种机体炎症反应和应激反应的重要指标[20]。 鉴于以上研究已知,在肺炎症反应中TNF-α、IL-6 所起到了非常重要的作用,所以本研究选择TNF-α、IL-6 作为观察肺部炎症反应的指标。
MDA 可以认为是一种能够能间接反映氧化应激反应强度的物质。 高蓉[21]等在一组胸腔镜肺癌根治术OLV 通气期间采用肺保护通气策略与传统通气方式相比,患者术后TNF-α、IL-6 等炎性因子的含量明显降低,改善患者氧合,术后肺功能明显提高,ICU 带管时间缩短。 本研究结果表明:四组患者TNF-α、IL-6、MDA ,T3 ~T6 时间点相比T1 时间点均增高有统计学意义,与D 组相比,A 组TNF-α 于T3、T4、T6 时间点显著降低有统计学意义;IL-6 于T3~T6 时间点显著降低(P<0.01);MDA 于T3 ~T6时间点显著降低(P<0.01)。 说明在胸腔镜下心脏手术OLV 策略可以有效的减轻患者全身炎症反应,减少氧化应激反应。 这与已知研究结果相符。 而Kim 等[22]的一组关于胸腔镜下肺叶切除术中保护性通气对炎症反应的随机对照研究中发现,分别采用两种不同的通气模式,两组患者的动脉氧合情况及TNF-α、IL-6 等炎性因子的水平相比较并无统计学意义。 这可能是因为肺保护通气策略的措施并不是单一措施,而是有小潮气量、快呼吸频率、最佳PEEP、低FiO2等共同决定的,有可能得到不同的效果。
目前认为在OLV 引起机体氧化应激反应增强和肺部炎症反应的机制有很多,例如:非通气侧肺低氧、肺萎陷伤、低灌注/缺血再灌注损伤以及通气侧肺的过度膨胀与牵张周期性肺泡闭合与开放形成的剪切伤、吸入高浓度氧等[23-25]。 这些因素促使大量氧自由基和炎性因子释放,造成了术后急性肺损伤。肺保护性通气策略能减少肺容量伤和气压伤,改善术后肺功能[26-28],减少术后肺部并发症能和全身炎症反应[29-30]。
Lee 等[31]表明大潮气量机械通气所致急性肺损伤伴随各种炎性因子显著増高,Dex(5 μg/kg)能显著抑制此效应。 Gong 等[16]在一组食管癌OLV 患者的研究中发现,Dex 联合保护性通气策略能够使IL-6 水平明显降低,超氧化物歧化酶水平明显升高。Huang 等[32]一篇关于Dex 和安慰剂在成人胸部手术OLV 期间的氧合和肺内分流的荟萃分析中认为:Dex可改善成人开胸手术OLV 期间的OI,减少肺内分流。 现有研究表明在胸外科腔镜手术围术期OLV期间,使用Dex 能明显改善患者的术中氧合、减轻肺部炎症反应[31]。 本试验也发现使用Dex 的B 组和C组患者其OI 均优于D 组, 血清TNF-α、IL-6 以及MDA 均较D 组降低,这与现有的研究一致。 这也说明了Dex 在CPB 手术中可以通过抑制全身炎症反应、降低氧化应激程度,改善机体氧合等机制发挥肺保护作用,并且与单独使用Dex 或者肺保护通气策略相比,使用Dex+肺保护通气策略的患者,术中血清中的炎症指标TNF-α、IL-6 以及MDA 均有降低,有统计学意义。
国内外很多实验都证明,在围手术期使用Dex能够通过降低儿茶酚胺和炎性因子的释放,达到维持患者血流动力学稳定的作用[33]。 本实验发现,在使用Dex 后,B 组、C 组患者的SBP、DBP 在一些时间点明显高于A 组及C 组患者;B 组、C 组患者的HR 在在一些时间点明显高于A 组及C 组患者;B 组及C 组中有些患者在主动脉开放后出现复跳困难或者复跳后心率太慢的情况,这可能是因为Dex 通过作用于突触前α2 肾上腺素能受体来抑制去甲肾上腺素的释放,降低儿茶酚胺水平及交感神经兴奋性,从而减慢HR,加快房室传导,增强心肌收缩力有关。
本研究将Dex 和肺保护性通气策略联合应用于胸腔镜下心脏手术中的结果表明两者在抑制炎症反应、降低氧化应激反应、改善机体氧合、改善肺通气等方面发挥协同作用,从而增强肺保护作用,值得临床进一步推广。
本实验尚存在一些不足之处,比如样本量过少;肺保护通气策略的相关潮气量、PEET 等的数值是否是最合适的;未将术后肺部相关并发症纳入观察指标。 这些也是后续进一步改进实验的方向。

