杨桃根中2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮对糖尿病小鼠心肌损伤的影响*
吴娅妮,韦晓洁,高雨桐,陈 铭,韦秀莎,黄仁彬△,张士军△
(1.广西医科大学药学院,南宁 530021;2.广西中医药大学基础医学院,南宁 530299)
糖尿病是一组以高血糖为特征的代谢性疾病[1],长期的高血糖会导致多种糖尿病并发症的产生,包括肾病、视网膜病变、神经病变、中风、心血管疾病和周围血管疾病等[2]。糖尿病心肌病是糖尿病心血管并发症最常见的疾病之一,其发病机制复杂,由多因素造成[3],氧化应激反应参与调节并启动的细胞凋亡是糖尿病心肌病发生发展的重要机制[4]。李伟斯等[5]已报道杨桃根总提取物能够在降低糖尿病大鼠血糖的同时降低血清中心肌酶活性,对糖尿病大鼠心肌损害有一定的预防治疗作用。而2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮(2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione,DMDD)是从杨桃根提取分离所得的黄酮类单体化合物,杨桃根DMDD 具有良好的降血糖效果,能够抑制糖尿病肾病及阿尔茨海默模型小鼠的氧化应激,减少细胞凋亡[6-7]。因此,本实验通过复制糖尿病小鼠心肌损伤模型,探讨杨桃根DMDD对糖尿病小鼠心肌损伤的作用及可能机制。
1 材料与方法
1.1 实验动物 SPF级C57BL/6雄性小鼠共50只,6~8周龄,体重(18±2)g,购自广西医科大学实验动物中心,动物生产许可证号:SCXK桂2014-0002,实验动物使用许可证号:XYKG桂2014-0003。
1.2 主要药物与试剂 中药材杨桃根采自广西灵山县,依据课题组前期制备方法[5]自行制备杨桃根DMDD。链脲佐菌素(美国Sigma 公司);乳酸脱氢酶(LDH)、肌酸激酶(CK)试剂盒均购自上海执诚生物科技有限公司;肌酸激酶同工酶(CK-MB)酶联免疫吸附试验(ELISA)试剂盒购自上海江莱生物科技有限公司;BCA蛋白定量试剂盒、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)购自南京建成生物研究所;天狼星红染色液购自安徽雷根生物技术有限公司;TUNEL试剂盒上海碧云天生物技术有限公司;AxyPrep总RNA小量制备试剂盒购自美国Axygen 公司;PCR 逆转录试剂盒购自TaKaRa 宝生物工程(大连)有限公司;PCR引物由生工生物工程(上海)股份有限公司合成。
1.3 模型制备及分组给药 50 只雄性C57BL/6 小鼠适应性喂养1周后,随机选取10只小鼠作为空白组,剩余小鼠给予高糖高脂饲料喂养4周,之后给予链脲佐菌素(STZ)100 mg/kg空腹腹腔注射,72 h后测空腹血糖,血糖值≥11.1 mmol/L 视为造模成功。将造模成功的小鼠随机分为模型组,DMDD 高(50 mg/kg)、中(25 mg/kg)、低(12.5 mg/kg)剂量组,每组10 只,继续高糖高脂饲料喂养,灌胃给药治疗8周,1次/d,空白组灌胃等剂量蒸馏水。
1.4 血清指标检测 给药结束后,各组小鼠禁食不禁水12 h,摘除眼球收集血液,颈椎脱臼处死小鼠。血液室温放置30 min,4 ℃下3 500 r/min 离心15 min,收集血清。全自动血生化分析仪检测血清中CK、LDH 含量。使用ELISA 法检测CK-MB 水平,严格按照说明书操作步骤进行。
1.5 心肌组织MDA、SOD、GSH 含量检测 处死小鼠后,迅速取出心脏组织,用预冷的生理盐水清洗残留血液。取适量心肌组织,按照1∶9 的比例加入生理盐水制备成10%心肌组织匀浆,4 ℃下3 500 r/min 离心15 min,收集上清液,按照试剂盒说明书检测MDA、SOD、GSH 含量,BCA 试剂盒检测蛋白浓度。
1.6 心肌组织苏木精-伊红(HE)、天狼星红染色和TUNEL 染色 取小鼠心脏1/3 的心尖处,放入4%多聚甲醛,固定24 h,常规脱水,进行石蜡包埋,切片,行HE 染色,显微镜下观察心肌结构病理变化。切片常规脱蜡至水,行天狼星红染色,滴染1 h,流水冲洗,苏木精染细胞核,常规脱水、中性树脂固封,于光学显微镜下观察胶原纤维增生情况。切片参照TUNEL 试剂盒说明书进行细胞凋亡检测,于光镜下观察,细胞核染成棕黄色的为凋亡细胞。采用Image J图像分析软件计数阳性细胞数,计算细胞凋亡率。
1.7 实时荧光定量PCR(qPCR)法检测Bax、Bcl-2、Caspase-3 mRNA 表达 提取心脏组织总RNA,测定总RNA 浓度,逆转录为cDNA,使用ABI 7300 系统完成PCR扩增,反应条件如下:50 ℃2 min,95 ℃2 min,95 ℃15 s,60 ℃退火15 s,72 ℃延伸1 min,共40 个循环。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。引物序列如下:Bax上游:5’-TTGCCCTCTTCTACTTTGCTAG-3’,下游:5’-CCATGATGGTTCTGATCAGCTC-3’;Bcl-2 上游:5’-GATGACTTCTCTCGTCGCTAC-3’,下游:5’-GAACTCAAAGAAGGCCACAATC-3’;Caspase-3 上游:5’-AGTGGGACTGAG GAGAT-3’,下游:5’-GTAACCAGGTGCTGTGAGGTAAG-3’;β-actin 上游:5’-GTCGAGTCGCGTCCACC-3’,下游:5’-GTCATCCATGGCGAACTGGT-3’。
1.8 统计学方法 采用SPSS 17.0 统计软件对数据进行分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 DMDD 对小鼠血清中空腹血糖(FBG)、CK、CK-MB、LDH 水平的影响 与空白组相比,模型组小鼠血清中的FBG、CK、CK-MB、LDH 水平显著升高(P<0.01);与模型组比较,DMDD 各剂量组FBG、CK、CK-MB、LDH 水平明显下降(P<0.05 或P<0.01),且DMDD 高、中剂量组FBG 低于DMDD低剂量组(P<0.05),DMDD 高剂量组心肌酶低于DMDD低剂量组(P>0.05),见表1。
表1 DMDD对小鼠FBG、CK、CK-MB、LDH的影响,n=10

表1 DMDD对小鼠FBG、CK、CK-MB、LDH的影响,n=10
与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与DMDD中剂量组比较,$P<0.05;与DMDD低剂量组比较,&P<0.05。
2.2 DMDD 对小鼠心肌组织MDA、SOD、GSH 含量的影响 与空白组相比,模型组小鼠血清中的MDA水平显著升高(P<0.01),SOD、GSH水平显著下降(P<0.01);与模型组小鼠相比,DMDD 能够显著提高小鼠SOD、GSH 含量,降低MDA 含量(P<0.05 或P<0.01),且DMDD 高剂量组与DMDD 低剂量组比较,差异有统计学意义(P<0.05),见表2。
2.3 DMDD对小鼠心肌结构、纤维增生和心肌凋亡的影响 HE 染色可见空白组小鼠心肌排列紧密整齐,结构较为完整;模型组小鼠心肌排列不规则,心肌间质变宽,可见部分心肌纤维断裂;DMDD 各剂量组小鼠心肌组织细胞排列稍乱,心肌断裂减少。天狼星红染色可见模型组心肌组织含有明显红色的胶原纤维,分布杂乱,空白组及DMDD 各剂量组红色胶原纤维减少。TUNEL染色结果可见,与空白组相比较,模型组心肌组织有较多棕黄色凋亡细胞核,凋亡率显著上升(P<0.01);与模型组相比,DMDD各剂量组凋亡细胞均明显减少,凋亡率明显下降(P<0.01),且DMDD 高剂量组凋亡率低于DMDD低剂量组(P<0.05),见图1、图2。
表2 DMDD对小鼠MDA、SOD、GSH的影响,n=10
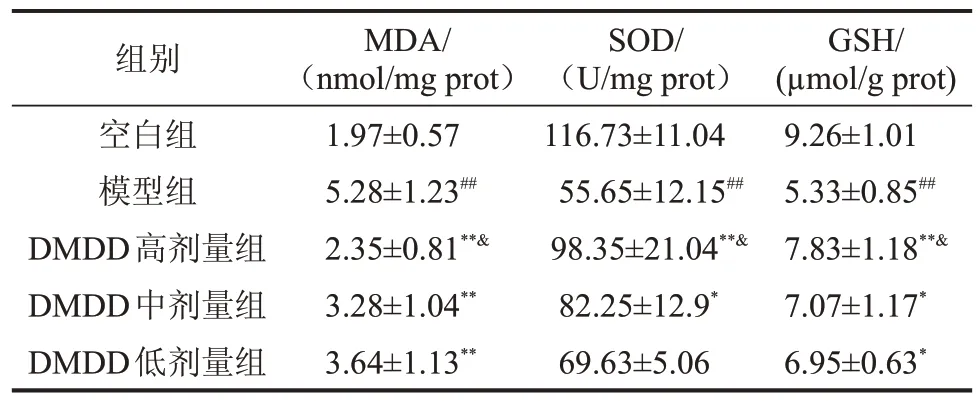
表2 DMDD对小鼠MDA、SOD、GSH的影响,n=10
与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与DMDD中剂量组比较,$P<0.05;与DMDD低剂量组比较,&P<0.05。
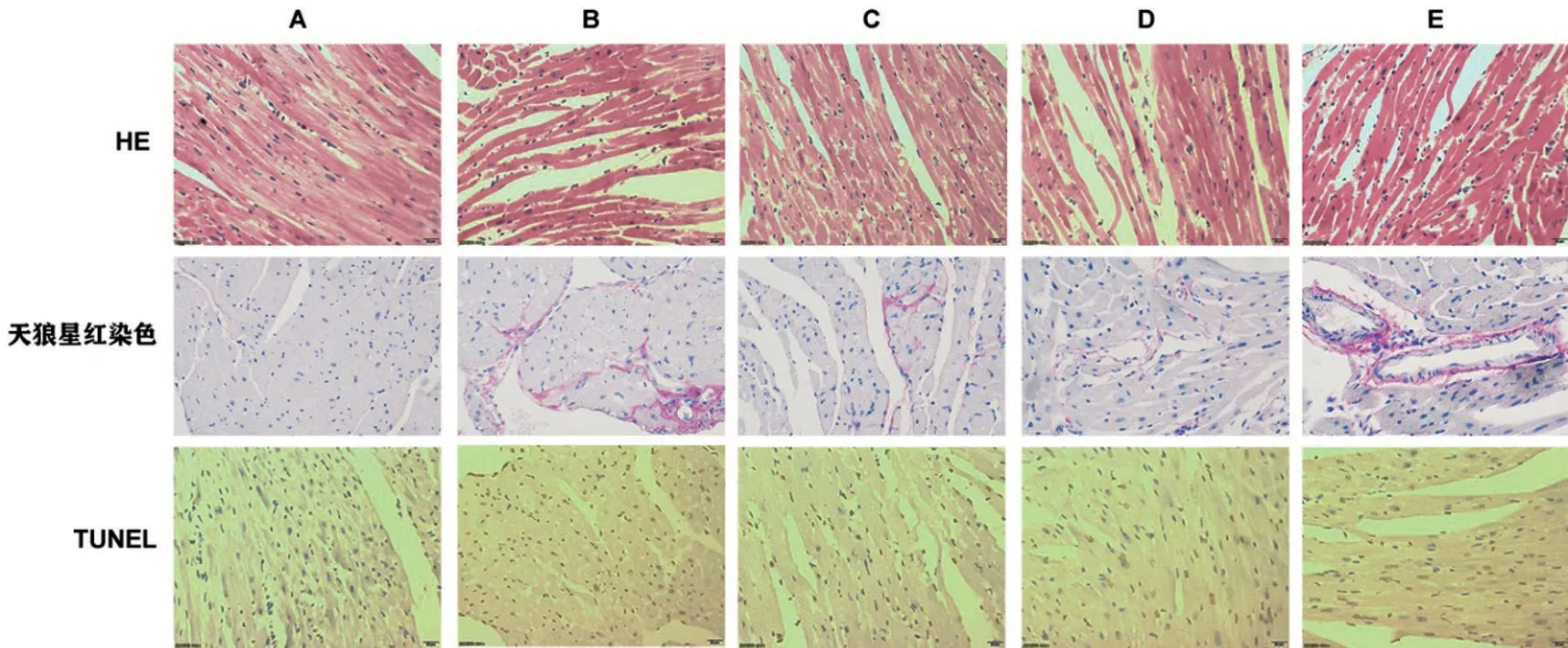
图1 心肌组织HE、天狼星红染色及TUNEL染色图(×400)
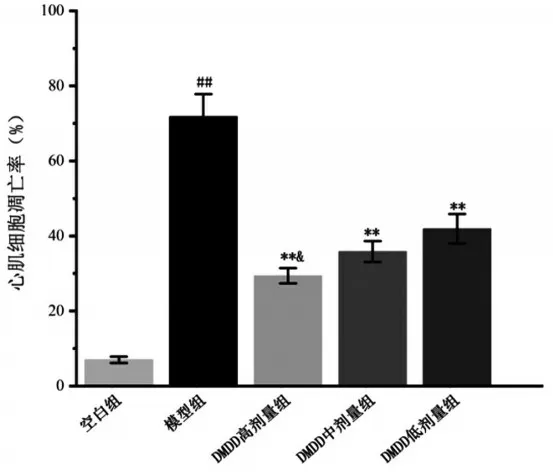
图2 5组心肌细胞凋亡率比较
2.4 DMDD 对小鼠心肌组织中Bax、Bcl-2、Caspase-3 mRNA 表达的影响 与空白组相比,模型组小鼠心肌组织中Bax、Caspase-3 mRNA表达水平显著性升高(P<0.01),Bcl-2 mRNA 表达水平显著下降(P<0.01);与模型组相比,DMDD 治疗组Bax、Caspase-3 mRNA 表达水平显著下降(P<0.05 或P<0.01),Bcl-2 mRNA表达水平显著升高(P<0.05或P<0.01),DMDD 高、中剂量组Caspase-3 mRNA表达低于DMDD低剂量组(P<0.05),见表3。
表3 DMDD对小鼠Bax、Bcl-2、Caspase-3 mRNA表达的影响,n=10
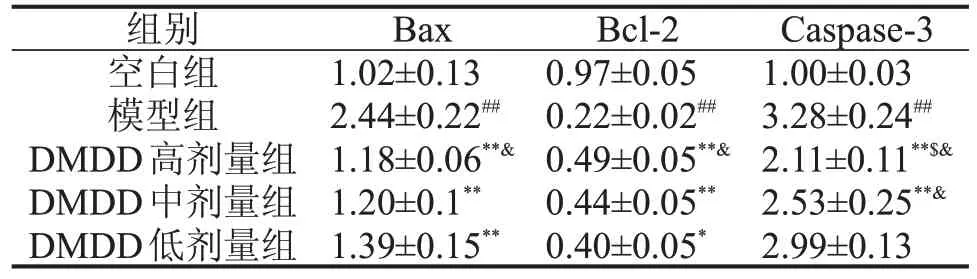
表3 DMDD对小鼠Bax、Bcl-2、Caspase-3 mRNA表达的影响,n=10
与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与DMDD中剂量组比较,$P<0.05;与DMDD低剂量组比较,&P<0.05。
3 讨论
糖尿病发病率和死亡率逐年上升,给个人和社会造成了巨大压力。糖尿病心肌病作为糖尿病最常见的并发症之一,与糖尿病患者心力衰竭的高死亡率密切相关[8]。目前临床上尚缺乏对糖尿病心肌病特异性、针对性的治疗药物。本研究利用高糖高脂饲料联合腹腔注射小剂量STZ 复制糖尿病心肌损伤模型,使糖尿病小鼠在持续的高糖环境下,心肌组织受到损伤,导致血清中的CK、LDH 及CKMB水平升高(P<0.01)。CK、LDH及CK-MB均分布于心肌细胞中,是心肌疾病的常见诊断指标,特别是CK-MB,对心肌损伤有很高的特异性。当心肌组织受损,细胞通透性增加,血清中CK、LDH、CKMB水平随之升高[9]。而DMDD能够降低糖尿病小鼠血清中CK、LDH 及CK-MB 水平(P<0.05),且在病理染色中可见DMDD 减少心肌断裂及心肌胶原纤维生成,在一定程度上保护糖尿病心肌损伤。
糖尿病心肌病发病机制复杂,涉及的发病因素较多,线粒体产生的活性氧诱导氧化应激损伤心肌组织是其中重要的发病机制[4]。MDA 作为脂质过氧化最终产物之一,其水平的高低能够反映细胞脂质过氧化的严重程度[10]。SOD 在氧化应激中具有清除超氧阴离子的专有作用,其活力的高低反映了细胞清除自由基能力的大小。大多数体内产生的自由基由GSH 消耗,如果GSH 消耗过多或者产生不足就会导致组织的脂质过氧化损伤[11]。检测心肌组织内的MDA、SOD和GSH含量,能够间接表明心肌组织内氧化应激水平。本研究中模型组小鼠心肌组织中的MDA 含量显著性升高,SOD 和GSH 含量显著性下降(P<0.01),说明糖尿病小鼠心肌组织抗氧化能力下降。经过DMDD 治疗后,MDA 含量降低,SOD和GSH活性增强,表明DMDD能够提高心肌组织的抗氧化能力,通过抑制氧化应激改善糖尿病心肌损伤。
心肌组织自由基增多,脂质过氧化物累积,导致心肌细胞凋亡,而心肌细胞凋亡是心功能障碍发生的主要原因[12]。Caspase-3是Caspase家族中凋亡的关键执行者,经细胞内的促凋亡基因Bax 激活下游基因使其活化[13]。Bcl-2作为细胞凋亡抑制基因,通过抑制线粒体细胞色素C 的释放,抑制细胞凋亡[14]。本实验利用TUNEL染色观察心肌细胞凋亡,qPCR检测心肌组织中Caspase-3、Bax、Bcl-2 mRNA表达量,结果表明,模型组小鼠心肌细胞凋亡明显增加,Caspase-3、Bax mRNA 表达量显著升高(P<0.01),Bcl-2 mRNA 表达量显著下降(P<0.01)。而DMDD 能够减少心肌细胞凋亡,降低Caspase-3、Bax mRNA 表达,升高Bcl-2 mRNA 表达,提示DMDD可下调促凋亡基因表达,上调凋亡抑制基因表达,从而抑制心肌细胞凋亡。
综上,杨桃根DMDD能够减轻糖尿病小鼠的心肌损伤,其作用机制与DMDD 抑制氧化应激,减少心肌纤维增生,抑制心肌细胞凋亡有关。

