HMGB1介导线粒体自噬参与糖尿病小鼠心肌缺血/再灌注损伤*
吴云娇,黄 锋,卢创宏,吴晓丹,曾志羽
(广西医科大学第一附属医院 1.心血管内科;2.广西心脑血管疾病防治精准医学重点实验室;3.广西心脑血管疾病临床医学研究中心,南宁 530021)
心血管疾病(CVD)在我国的发病率和病死率不断上升,每年约有300 万人死于CVD,占中国死亡人数的40%[1]。缺血性心肌病(IHD)作为CVD的重要组成部分之一,已成为主要死亡原因之一。及时恢复血流进行再灌注是治疗心肌缺血的主要方式,然而随之而来的再灌注损伤会导致心肌发生功能紊乱和结构损伤。糖尿病作为CVD 的主要独立危险因素,和非糖尿病人群相比,糖尿病患者发生IHD的患病率和风险均显著升高[2]。中国更是全世界糖尿病患者最多的国家,2013年的调查显示患病人数已达到1.14 亿,约占总人口的11%[3]。而糖尿病让心肌对缺血/再灌注(I/R)损伤的易损性增加[4],糖尿病急性心梗患者接受再灌注治疗后不良事件发生率较非糖尿病患者明显增高[5]。
生理条件下,线粒体可被特异性包裹于自噬小体,经溶酶体融合后降解、消化,即线粒体自噬,该途径可消除受损或者过多的线粒体,从而维持细胞内环境的稳定。然而过度的线粒体自噬会使得线粒体的绝对数量减少,进而加剧细胞损伤[6]。缺血过程中增强的自噬往往起到保护作用,但在再灌注过程中过度的自噬会加重损伤[7]。高迁移率族蛋白1(HMGB1)对细胞自噬和线粒体自噬起重要调控作用[8-9]。HMGB1 参与糖尿病心肌病的发生、发展过程[10-11],其通过与糖基化终产物受体(RAGE)结合,加重心肌损伤,在糖尿病I/R后心肌重塑中起重要作用[12]。因此,本研究通过使用HMGB1 中和抗体干预糖尿病心肌I/R 小鼠,观察小鼠心肌组织中线粒体自噬水平,探索HMGB1 是否通过线粒体自噬途径参与糖尿病小鼠I/R损伤。
1 材料与方法
1.1 实验动物与试剂 雄性db/db 小鼠43 只,7 周龄,体重35~40 g,购于江苏集萃药康生物科技股份有限公司。MiniVent 845 型动物呼吸机(Harvard 公司,美国);HMGB1中和抗体及Ig-Y空载抗体(Shino test公司,日本);阿佛丁(南京爱贝生物科技有限公司,中国);2,3,5-氯化三苯基四氮唑(TTC)溶液(Sigma 公司,美国);伊文思蓝(Evans blue)溶液(Sigma 公司,美国);HMGB1 酶联免疫吸附试验(ELISA)检测试剂盒(IBL公司,美国);肌酸激酶同工酶MB(CK-MB)ELISA试剂盒(武汉华美,中国);乳酸脱氢酶(LDH)ELISA 试剂盒(武汉华美,中国);RIPA裂解液、BCA 试剂盒、4×上样缓冲液(Solarbio 公司,中国);兔抗HMGB1单克隆抗体(#HM-901)购于美国IBL 公司;兔抗LC3B 多克隆抗体(#ab51520)、兔抗P62单克隆抗体(#ab240635)、山羊抗兔IgG H&L(HRP)(#ab6721)均购于美国Abcam公司;兔抗GAPDH 多克隆抗体(#10494-1-AP)购于中国Proteintech 公司;兔抗HSP60 单克隆抗体(#GB11243)、Alexa Fluor488 标记山羊抗兔(HRP)IgG(#GB25303)、CY3 标记山羊抗兔(HRP)Ig G(#GB23303)均购于中国servicebio公司。
1.2 心肌I/R 小鼠模型的建立 用1.25%阿佛丁(240 mg/kg)腹腔注射麻醉小鼠,固定于小动物手术台上,行气管插管,连接呼吸机(潮气量250 mL/min;呼吸频率120次/min)。酒精消毒后,沿小鼠左侧胸大肌下缘作一斜向上的斜行皮肤切口,逐层钝性分离肌层,暴露肋间隙。在第4 或第5 肋间隙处打开胸腔,开胸器固定后,剥离心包膜充分暴露左心耳及左心室。在左心耳下缘约2 mm处,用7-0无损伤缝合针线穿过心肌表层,于肺动脉圆锥附近出针,结扎冠状动脉左前降支(LAD)缺血30 min 后,松开结扎线恢复血流再灌注3 h。左室前壁心肌颜色变苍白或紫绀,心电图显示ST段弓背向上抬高视为缺血成功;开放LAD后左室前壁心肌颜色逐渐恢复红色视为再灌注成功。
1.3 实验分组与给药 将40 只雄性db/db 小鼠随机分为4组,每组10只。另取3只雄性db/db小鼠加入假手术-生理盐水(Sham-NC)组。(1)假手术-空载抗体(Sham-G)组:只穿线不结扎LAD,1 h后尾静脉注射Ig-Y 空载抗体(2 mg/kg);(2)假手术-中和抗体(Sham-A)组:只穿线不结扎LAD,1 h后尾静脉注射HMGB1 中和抗体(2 mg/kg);(3)I/R-A 组:心肌缺血30 min后恢复血流灌注30 min时,尾静脉注射HMGB1 中和抗体(2 mg/kg),继续灌注至3 h;(4)I/R-G 组:心肌缺血30 min 后恢复血流灌注30 min 时,尾静脉注射Ig-Y 空载抗体(2 mg/kg),继续灌注至3 h;(5)Sham-NC组:只穿线不结扎LAD,1 h后尾静脉注射生理盐水(2 mg/kg)
1.4 Evans blue-TTC 双重染色法检测心肌梗死面积 再灌注3 h 后,深度过量麻醉小鼠,打开胸腔,再次原位结扎小鼠LAD,经主动脉逆行注射Evans blue 溶液约0.75 mL,取出心脏,置于-20 ℃冰箱中冷冻30 min,心脏变硬后,自心尖处连续横切厚度1 mm的切片(共5片),PBS清洗,放入1%TTC溶液中,37 ℃避光水浴15 min。染色成功后,用4%多聚甲醛溶液固定切片24 h。拍照,用Image J软件分析染色面积。TTC 染色为红色(梗死边缘区)和白色(梗死区)的区域为危险区(AAR),正常心肌经Evans blue染色为深蓝色。计算梗死区面积占AAR面积的百分比。
1.5 血浆HMGB1、LDH 水平检测 再灌注3 h 后,再次麻醉小鼠,使用眼球采血法收集小鼠全血,置于1.5 mL 离心管中,室温静置15 min,4 ℃离心10 min后小心吸取上层血浆,采用ELISA法检测血浆HMGB1、LDH 水平。检测过程严格按照试剂盒说明书操作。
1.6 免疫荧光法检测线粒体自噬水平 取小鼠心前区心肌组织制作石蜡切片,PBS 洗涤,甩干后在3%双氧水中室温避光孵育约25 min封闭过氧化物酶;PBS 洗涤,滴入3%BSA 溶液,室温下避光孵育约 30 min。加入LC3 一抗(1∶5 000),4°C 冰箱孵育过夜后加入对应山羊抗兔HRP 二抗(1∶500),室温孵育50 min,再于CY3-TSA孵育10 min。取出切片,放于EDTA抗原修复缓冲液(pH 8.0)中,置于微波炉内中火8 min 后转中低火7 min 进行抗原热修复。之后加入一抗HSP60(1∶800),4°C 冰箱孵育过夜后加入对应山羊抗兔HRP二抗(1∶400)避光室温孵育50 min。DAPI染核避光孵育10 min,PBS洗涤5 min,重复3次,滴加抗荧光猝灭封片液,盖玻片封片,于荧光显微镜下观察结果。可见呈点状蓝色的心肌细胞核和呈点状绿色荧光的自噬泡以及呈红色荧光的线粒体基质蛋白。
1.7 Western blotting 法检测HMGB1、LC3、P62 蛋白表达 将心前区心肌组织按100 mg/mL 加入RIPA 裂解液,于超声破碎仪中匀浆3次,冰上裂解30 min,离心,吸取上清。使用BCA 试剂盒检测蛋白浓度,加入4×上样缓冲液,煮沸6 min 使蛋白变性。SDSPAGE分离蛋白,转移至PVDF膜,5%脱脂奶粉室温封闭1 h;加入一抗HMGB1、LC3、P62、GAPDH(均为1∶1 000)4 ℃冰箱孵育过夜,TBST 洗膜3 次,5 min/次;加入二抗(1∶10 000)室温孵育1 h。ECL显色,FluorChem FC3 成像系统(Proteinsimple 公司,美国)显影、拍照,Image J 软件分析条带灰度值。以目的蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值为目的蛋白表达量。
1.8 统计学方法 采用SPSS 18.0统计软件分析数据,计量资料以均数±标准差()表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组血浆HMGB1水平比较 与Sham-G组比较,Sham-A 组血浆HMGB1 水平显著降低(P<0.05),I/R-A组、I/R-G组血浆HMGB1水平明显升高(P<0.05);与I/R-G 组比较,I/R-A 组血浆HMGB1水平显著降低(P<0.05);Sham-G 组与Sham-NC 组比较,差异无统计学意义(P>0.05),见图1。
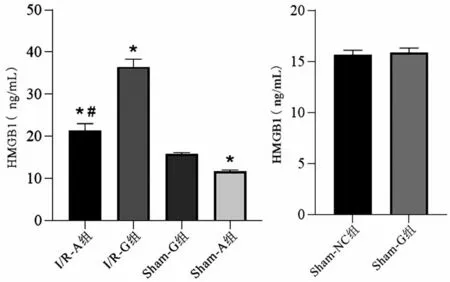
图1 各组小鼠血浆HMGB1水平比较
2.2 4组小鼠心肌梗死面积及血浆LDH水平比较与Sham-G 组比较,I/R-A 组、I/R-G 组小鼠心梗面积显著增加(P<0.05);与I/R-G组比较,I/R-A组小鼠心肌梗面积显著减少,血浆LDH水平显著降低(均P<0.05),见图2。
2.3 4 组心肌HMGB1、LC3-Ⅱ/Ⅰ、P62 蛋白表达量比较 与I/R-G 组比较,I/R-A 组心肌组织HMGB1蛋白表达量和LC3-II/I比值明显降低,而P62蛋白表达量显著升高(均P<0.05),见图3。
2.4 4 组心肌组织线粒体自噬情况 I/R-A 组心肌组织中HSP60与LC3的共定位荧光强度较I/R-G组明显减弱,见图4。
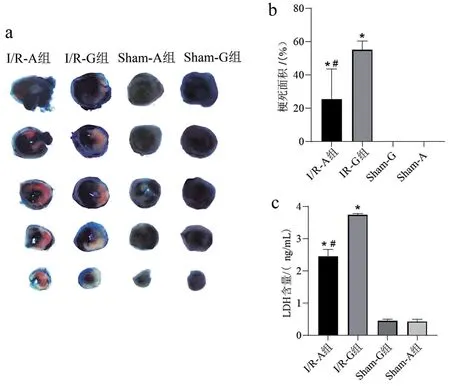
图2 4组心肌梗死及血浆LDH水平比较
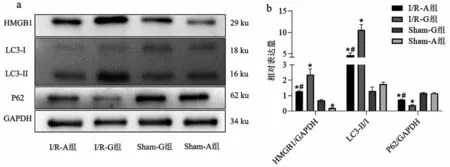
图3 4组HMGB1、P62、LC3-Ⅱ/Ⅰ蛋白表达量比较

图4 4组心肌组织线粒体自噬情况
3 讨论
CVD 是全球最主要的死亡原因[13]。急性心肌梗死(AMI)则是不论在发展中国家还是发达国家中都被认为是CVD 发病率和死亡率的主要原因[14-15]。早期成功进行溶栓治疗或直接接经皮冠状动脉介入治疗(PCI)恢复缺血心肌的血流量是治疗急性心梗的最有效策略。然而再灌注会对心肌造成额外的损伤和并发症,是CVD治疗的主要障碍[16-18]。糖尿病被认为是AMI 的独立危险因素[19]。糖尿病患者心肌梗死后的发病率、死亡率和再梗死率远高于非糖尿病患者[20-21]。有研究认为,糖尿病增加了心肌对I/R损伤的易感性[22]。糖尿病I/R损伤加重的机制尚不清楚,但继发于高血糖的增加的氧化应激可能起到重要作用。
有研究表明,糖尿病患者氧化应激增加的原因主要是内源性抗氧化防御系统产生和清除活性氧(ROS)之间的失衡,这种失衡的程度与I/R 损伤的程度密切相关[23]。增高的氧化应激会损害线粒体能力代谢,导致线粒体功能障碍,而损伤的线粒体又会产生更多的ROS,产生恶性循环[24]。
线粒体自噬是一种选择性自噬,可以清除细胞内过多或损伤的线粒体。在心肌细胞中,线粒体自噬是否对应激有保护作用一直存在争议。有研究发现,无论是在由缺糖诱导的缺血心肌细胞系还是活体小鼠缺血模型中,自噬的减少会伴随着心肌细胞存活率的下降以及心脏功能障碍,提示自噬有保护作用[8]。而在再灌注期间,自噬会进一步加重。用3-甲基腺嘌呤或N-2-巯基丙酰甘氨酸、Beclin 基因敲除抑制自噬后,体外或体内的I/R 心肌细胞存活率升高,心梗面积减少[25-26]。适度的自噬可以及时清除受损线粒体以维持内环境的稳定,而过度的自噬或者线粒体自噬发生缺陷会加重再灌注损伤。
HMGB1是一种染色质相关的核蛋白和细胞外损伤相关模式分子(DAMP)。可从坏死细胞中被动释放,也可从激活的免疫细胞中主动分泌至细胞外。作为促炎细胞因子在感染、损伤、炎症的发病机制中发挥关键作用[27]。HMGB1被证实在心肌I/R期间作为炎症和细胞损伤的早期介质来介导炎症反应和器官损伤,加重了再灌注的损伤。MIRI模型中循环和心肌HMGB1 水平明显增加,有助于再灌注期间梗死进一步加重[28]。降低HMGB1表达或靶向缺失HMGB1 后,显著减轻I/R 组织损伤,发挥保护作用[11,29]。此外,有研究表明,HMGB1 在促进细胞自噬和线粒体自噬中作为关键调节因子,将氧化还原、生物能量学和新陈代谢与自噬调节联系起来。靶向缺失HMGB1后自噬显著下降[9]。HMGB1在糖尿病心肌病的发展中起着重要作用,持续激活促炎途径和增强心肌损伤[11,30]。
目前研究认为,糖尿病心肌I/R 和氧化应激ROS 升高相关。这些机制大部分与线粒体障碍密切相关。糖尿病心脏病更是被有些学者认为是线粒体疾[31-32]。而HMGB1 是线粒体自噬的关键调节因子,氧化还原诱导HMGB1易位,可与晚期糖基化终产物结合导致持续的促炎途径激活和增强的心肌损伤,还可调控热休克蛋白β1(HSPB1)维持线粒体形态和掌控线粒体自噬[33]。有研究发现,糖尿病心肌I/R 大鼠经药物治疗后其心功能显著改善,同时HMGB1 表达明显下降[34]。本研究结果提示HMGB1可促进糖尿病小鼠心肌I/R损伤,其机制与其介导线粒体自噬密切相关。
本研究结果表明,HMGB1 中和抗体能够有效抑制心肌I/R诱导糖尿病小鼠心肌释放HMGB1,且Ig-Y 空载抗体对db/db 小鼠的HMGB1 水平没有影响,排除了空载抗体本身的影响(P<0.05)。LC3蛋白是自噬体形成的关键蛋白,自噬过程中胞质型的LC3-I被自噬相关蛋白切割后与磷脂酰乙醇胺结合形成LC3-Ⅱ,后者被招募至自噬体膜上,故一般用LC3Ⅱ/Ⅰ的比值来反应自噬程度[35]。LC3Ⅱ/Ⅰ上升提示自噬增强或者自噬清除障碍。P62是自噬底物的标志,P62 下降提示自噬增加。本研究中,I/R-G组相较于I/R-A组HMGB1明显增加,LC3-Ⅱ/Ⅰ比值增加,P62 蛋白表达下降(P<0.05)。LC3 与线粒体共定位免疫荧光染色同样显示I/R-G组自噬与线粒体共定位强度明显增强,自噬发生在线粒体上。
综上,HMGB1 可促进糖尿病小鼠心肌I/R 损伤,其机制与其介导线粒体自噬密切相关。今后将就其具体机制进行进一步的验证。

