高速公路边坡植被修复对土壤微生物群落的影响
吕 江, 赵 晖, 袁宗浩, 潘晓东, 孙宏磊, 蔡袁强
(1.杭州交通投资建设管理集团有限公司,浙江 杭州 310024;2.浙江工业大学土木工程学院,浙江 杭州 310014)
土壤微生物是土壤生态系统的重要组成部分,其不仅参与地下部分物质和能量循环[1-3],影响土壤团聚体的形成,改变土壤结构,还可以调控地上部分植物的生长和植被群落多样性[1,2].例如土壤中丛枝菌根菌丝分泌物可以促进难溶性无机磷的溶解,加速土壤磷的周转[3];土壤微生物分泌的土壤蛋白、黏液和多糖等物质是一种亲水性的黏合剂,可以将土壤颗粒紧紧地结合在一起,促进土壤团聚体的形成和稳定[4],土壤真菌群落可以提高滨海湿地中植物的耐盐性等[5].土壤微生物群落结构对周围土壤环境的变化非常敏感,不仅受到各种环境因子的影响,例如土壤pH、湿度、重金属含量、土壤养分含量等[6],还受到地上部分植物群落结构的影响[7],因此土壤微生物群落结构的变化常常作为评价土壤生态质量的指标之一.
高速公路在建设过程中不仅会破坏沿线边坡植被多样性,造成地表裸露,还会破坏土壤结构,造成土壤水分流失[8,9].近年来,高速公路建设造成的生态环境破坏越来越受到人们关注,有关高速公路边坡生态修复技术和手段也日趋成熟[10].植被修复往往是高速公路边坡修复的重要环节,其在防止水土流失、恢复土壤肥力方面起着积极作用[11].然而植被修复对土壤微生物的影响却鲜少受到关注.检测植被修复对高速公路边坡土壤微生物多样性的影响对于评估土壤生态环境优良和植被修复质量具有重要意义.
千黄高速淳安段(溧阳至宁德国家高速公路浙江省淳安段)地形变化大,山体破碎,陡坡多,该区域由于高速公路的建设造成大量边坡地表裸露,植被多样性降低,目前急需对该区域进行有效的生态修复.本研究将利用高通量测序技术[12]探究千黄高速淳安段边坡植被修复对该区域土壤微生物群落多样性的影响,为后期该区域更好的进行土壤生态环境的修复提供依据.
1 材料与方法
1.1 研究区域与样地概况
千黄高速淳安段区域,该区域属亚热带季风气候,年均气温17 ℃,年降水量1 430 mm,年平均日照时长1 951 h.
本研究土样采集自该区域高速公路向阳边坡(N 29.641 3°, E 118. 941 5°),土壤层厚度80 cm,边坡修复时间为4个月,土壤为黄壤土.其中对照边坡为土壤裸露区域,无植被覆盖,试验边坡主要植被为草本植物,如狗牙根(Cynodondactylon)、牛筋草 (Eleusineindica),其次为酢浆草 (Oxaliscorniculata)、雀稗(Paspalumthunbergii)、马唐(Digitariasanguinalis)、紫花苜蓿(Medicagosativa).对照边坡和试验边坡海拔、坡向等其他环境因子基本一致.
1.2 样品采集与处理
取样时,在对照边坡和试验边坡分别选取3块地作为固定采样地点,每块地面积4 m×4 m.在每个地点采用五点取样法进行取样,土壤取样深度为5~10 cm,每个地点的土壤样品合并在一起,共得到6份土壤样品.每份土壤样品分为两部分,一部分风干保存,用于土壤理化性质测定,一部分-80 ℃低温保存,用于土壤微生物群落多样性检测.
1.3 土壤理化性质检测
风干后的土壤,过100目孔径筛,然后用于土壤理化性质测定.其中土壤pH值检测采用电极法,土壤有机质含量检测采用重铬酸钾容量法-稀释热法,土壤速效磷检测采用Olsen法,土壤全氮含量检测用凯氏定氮法,土壤全磷含量检测采用高氯酸-硫酸法.
1.4 土壤微生物基因测序
土壤微生物总DNA提取:利用MOBIO PowerSoil®DNA Isolation Kit试剂盒提取土壤微生物总DNA,提取方法按照试剂盒说明步骤进行,用0.8%琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量.
PCR扩增:利用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[13]对细菌V3-V4可变区进行PCR扩增;以及引物ITS1F(5′-GGA AGTAAAAGTCGTAACAAGG-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[14]对真菌ITS区域进行扩增,然后利用Illumina Miseq平台进行高通量测序.
Illumina Miseq测序:PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,回收采用AXYGEN公司的凝胶回收试剂盒(AxyPrep DNA Gel Extraction Kit).利用Microplate reader(BioTek, FLx800)将PCR扩增回收产物进行荧光定量.然后将纯化后的PCR扩增片段制备测序文库.文库在上机测序前先在Agilent Bioanalyzer上进行质检,然后利用Illumina (MiSeq)平台进行上机测序.测序结果已经上传至NCBI(national center for biotechnology information),序列号为PRJNA669968.
数据分析:首先运用QIIME软件(quantitative insights into microbial ecology,v1.8.0,http://qiime.org/)剔除嵌合体序列以及低质量序列[15].然后按照 97%的相似性将序列进行操作分类单元(operational taxonomic units,OUT)的聚类分析.利用ANOSIM (analysis of similarities)方法比较对照区和试验区之间细菌和真菌群落结构的差异性.细菌和真菌的Alpha多样性和Beta多样性分析,以及典范对应分析(canonical correspondence analysis, CCA)利用R语言(version 3.1.2; http://www.r-project.org/)完成.
2 结果与分析
2.1 土壤理化性质
对照区和试验区土壤pH,全氮、全磷、速效磷含量无显著性差异,但是试验区土壤有机质含量显著高于对照区(表1).

表1 对照区和试验区土壤理化性质1)Table 1 Physiochemical properties of soil from the experimental plots and control
2.2 细菌群落多样性
本研究中共获得220 911条细菌序列,基于 97%的序列相似性水平聚类,对照区共得到4 009个OTU,试验区共得到5 280个OTU,对照区OTU数目显著低于试验区(P<0.05)(表2).通过Veen图(图1a)可以直观地看出对照区和试验区共有OTU 1 954个,对照区特有OTU 2 055个,试验区特有OTU 3 326个.其中试验区特有且丰度最高的OTU属于拟无枝酸菌属(Amycolatopsis),对照区特有且丰度最高的OTU属于戴氏均属(Dyella)和类卡诺氏属(Nocardioides).

表2 对照区和试验区细菌多样性指数1)Table 2 Biodiversity index of the soil bacteria from the experimental plots and control

表3 对照区和试验区真菌多样性指数1)Table 3 Biodiversity index of the soil fungi from the experimental plots and control

a.细菌;b.真菌.图1 OTUs分布Fig.1 OTUs distribution of the bacteria (a) and fungi (b)
通过计算细菌Alpha多样性指数,显示对照区Shannon指数显著低于试验区(P<0.05),对照区Simpson指数和Chao1指数与试验区无显著性差异(P>0.05)(表2).
门(phylum)水平上(图2a),对照区和试验区中主要的优势门为变形菌门(Proteobacteria),其次为放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflex)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、Rokubacteria.其中对照区变形菌门相对丰度(40.83%±5.3%)显著高于试验区(29.03%±2.7%)(P<0.05);对照区放线菌门相对丰度(16.77%±0.7%)显著低于试验区(25.43%±4.0%)(P<0.05);对照区酸杆菌门相对丰度(22.65%±4.4%)显著高于试验区(17.67%±0.2%)(P<0.05).

a.细菌;b.真菌.图2 对照区和试验区土壤细菌和真菌群落(门水平)分布Fig.2 Distribution of soil bacterial and fungal community (phylum level) in the experimental plots and control
属(genus)水平上(图3a),对照区和试验区中主要的优势属为类诺卡氏属(Nocardioides),其次为假单胞菌属(Pelomonas)、嗜酸栖热菌属(Acidothermus)、慢生根瘤菌属(Bradyrhizobium)、鞘脂单胞菌属(Sphingomonas)、罗尔斯通菌属(Ralstonia)、链霉菌属(Streptomyces)、Acidibacter.其中对照区类诺卡氏属相对丰度(4.41%±1.1%)显著高于试验区(1.59%±0.4%)(P<0.05);对照区假单胞菌属相对丰度(3.09%±0.7%)显著高于试验区(1.16%±0.7%)(P<0.05);对照区嗜酸栖热菌属相对丰度(2.83%±0.9%)显著高于试验区(0.62%±0.5%)(P<0.05);对照区罗尔斯通菌属相对丰度(1.48%±0.02%)显著高于试验区(0.68%±0.05%)(P<0.05);对照区链霉菌属相对丰度(0.45%±0.01%)显著低于试验区(1.66%±0.4%)(P<0.05).
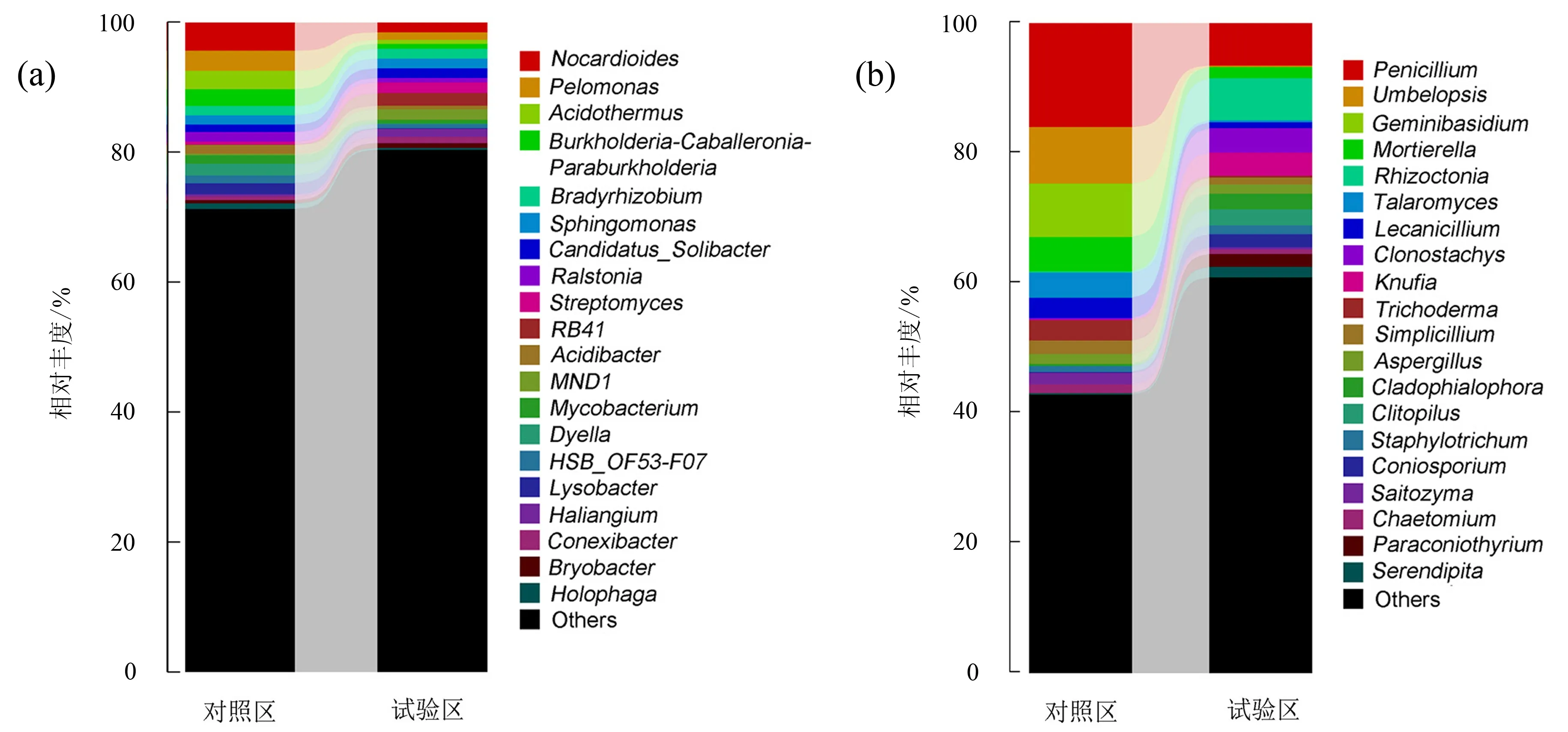
a.细菌;b.真菌.图3 对照区和试验区土壤细菌和真菌群落(属水平)分布Fig.3 Distribution of soil bacterial and fungal community (genus level) in the experimental plots and control
ANOSIM分析结果表明,对照区和试验区土壤细菌群落无显著性差异(P>0.05).CCA分析可以显示不同土壤样本之间的微生物群落相似度,CCA图中样本之间的距离越近,表明土壤样本之间微生物群落相似度越高.如图4a所示,对照区和试验区土壤细菌群落比较分散,土壤细菌群落对照区和试验区没有各自成聚群,表明对照区和试验区细菌群落无显著性差异.

a.细菌;b.真菌;TN.土壤总氮;TP.土壤总磷;AP.土壤速效磷;OC.土壤有机质含量.图4 细菌和真菌群落CCA分析Fig.4 CCA analysis of bacteria and fungal communities between the experimental plots and control
2.3 真菌群落多样性分析
本研究中共获得383 483条真菌序列,基于97%的序列相似性水平聚类,对照区共得到837个OTU,试验区共得到1 158个OTU,对照区OTU数目显著低于试验区(P<0.05)(表3).通过Veen图(图1b)可以直观地看出对照区和试验区共有OTU 200个,对照区特有OTU 637个,试验区特有OTU 958个.其中试验区特有且丰度最高的OTU属于拟盾壳霉属(Paraconiothyrium)和青霉属(Penicillium),对照区特有且丰度最高的OTU属于伞状霉属(Umbelopsis)和被孢霉属(Mortierella).
通过计算真菌Alpha多样性指数,显示对照区Shannon指数显著高于试验区(P<0.05),试验区Simpson指数与对照区无显著差异(P>0.05),对照区Chao1丰富度指显著小于试验区(P<0.05)(表3).
门(phylum)水平上(图2b),对照区和试验区中主要的优势门为子囊菌门(Ascomycota),其次为担子菌门(Basidiomycota)、毛霉门(Mucoromycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、隐真菌门(Rozellomycota).其中对照区子囊菌门相对丰度(56.54%±2.6%)显著低于试验区(66.73%±1.0%)(P<0.05);对照区毛霉门相对丰度(10.84%±4%)显著高于试验区(1.60%±0.7%)(P<0.05);对照区球囊菌门相对丰度(0.11%±0.05%)显著低于试验区(1.20%±0.1%)(P<0.05).
属(genus)水平上(图3b),对照区和试验区中主要的优势属为青霉菌属(Penicillium),其次为伞状霉属(Umbelopsis)、Geminibasidium、被孢霉属(Mortierella)、丝核菌属(Rhizoctonia)、篮状菌属(Talaromyces)、蜡蚧菌属(Lecanicillium)、粉红粘帚霉属(Clonostachys)、Knufia、Trichoderma.其中对照区青霉菌属相对丰度(15.98%±4.0%)显著高于试验区(6.52%±4.2%)(P<0.05);对照区伞状霉属相对丰度(8.70%±3.7%)显著高于试验区(0.22%±0.1%)(P<0.05);对照区丝核菌属相对丰度(0.20%±0.1%)显著低于试验区(6.47%±6%)(P<0.05);对照区篮状菌属相对丰度(3.88%±0.8%)显著高于试验区(0.31%±0.1%)(P<0.05);对照区Knufia属相对丰度(0.09%±0.08%)显著低于试验区(3.58%±0.3%)(P<0.05).
ANOSIM分析结果表明,对照区和试验区土壤真菌群落结构具有显著性差异(P<0.05).CCA分析结果显示,对照区和试验区土壤真菌群落可以各自成聚群,表明对照区和试验区细菌群落具有显著性差异.CCA图中的箭头和方向表明土壤有机质含量是影响土壤真菌群落结构主要因子(图4b).
3 讨论与结论
土壤微生物群落结构受到地上部分植物多样性的影响[16,17],地上部分植物群落多样性的改变,会使得土壤环境发生改变,进而使土壤微生物群落多样性发生变化.刘雅辉等[18]研究表明,种植植物样地的土壤有机质含量显著高于裸地,且种植植物改变了土壤微生物群落结构.本研究与其结果一致,高速公路边坡植物修复显著提高了土壤有机质含量,土壤有机质含量的变化显著影响了土壤真菌群落结构.植被修复过程中土壤有机质含量增加可能有两方面原因:一方面植物根系在土壤中分泌了各种次生代谢物质,另一方面植物凋落物归还于土壤.土壤有机质含量增加不仅能够为微生物生长提供碳源,促进一些土壤微生物的生长和繁殖,还可能会促进土壤养分循环,改变土壤有机质含量.因此植被修复是改良土壤性质的重要手段之一.
此外,边坡植被修复能够显著影响土壤真菌的群落结构,但是对土壤细菌群落结构无显著性影响,暗示了土壤细菌和真菌群落对周围环境变化的敏感性不同.这一结果和Li et al[19]的研究结果类似(千岛湖库区土壤细菌和真菌群落的构建机制显著不同,细菌和真菌群落对生境变化的响应存在显著差异).
3.1 细菌群落多样性
虽然对照区(地表裸露区)土壤细菌OTU 数目和Shannon多样性指数显著低于试验区(植被修复区域),但是ANOSIM分析结果显示对照区和试验区细菌群落结构无显著差异,表明土壤细菌群落总体不易受到植被覆盖的影响.即便如此,对照区和试验区某些细菌类群仍然存在门水平、属水平上的差异.
研究表明,对照区和试验区最丰富的门是变形菌门和放线菌门.变形菌门是土壤中比较常见的优势门,在很多矿区、农田等区域均属于优势门[20-22],这可能是由于变形菌门对环境的耐受性较强,因此能适应地表裸露等各种复杂环境[23].放线菌也属于土壤中比较常见菌群,对环境的耐受性较强,不止在土壤中,在水体中仍然广泛分布[24].放线菌是抗生素的主要产生菌[25],植被覆盖区域放线菌门丰度显著高于地表裸露区域,较高的放线菌门丰度可能会更有利于抗生素的产生,进而抑制土壤病原菌,从而有利于植物生长.
3.2 真菌群落多样性
研究表明,试验区土壤真菌OTU 数目显著低于对照区,但是Shannon多样性指数却显著高于对照区,表明地表裸露区域土壤真菌多样性虽然升高了,但是丰度却降低了(表2).ANOSIM分析结果显示对照区和试验区细菌群落结构具有显著差异,表明植被修复显著改变了土壤真菌的群落结构,提高了土壤真菌的多样性.
对照区和试验区最丰富的门是子囊菌门和担子菌门.子囊菌门是土壤中比较常见的类群,在农田、矿山等区域常常是优势门[26,27].虽然在门水平上地表裸露区域子囊菌门丰度高于植被修复区域,但是子囊菌门门下种类众多,有些属如Penicillium丰度在试验区却高于对照区,表明同一门下的不同属的真菌对环境的响应各不相同.
环境的改变除了使微生物中优势类群的相对丰度发生变化,还可以改变一些丰度较低真菌类群的相对丰度,例如对照区球囊菌纲的相对丰度(0.11%)显著低于试验区(1.20%),表明植物存在更有利于球囊菌纲中某些真菌的生存.球囊菌纲的相对丰度在对照区和试验区都比较低,但是已有研究发现球囊菌纲对土壤的修复过程具有重要意义.目前球囊菌纲中的丛枝菌根真菌已经成功用到矿山的土壤修复中[28,29],因此在后期对千黄高速淳安段进行生态修复时,可以更多地关注该类群.
3.3 结论
本研究显示千黄高速淳安段边坡植被修复能够显著提高土壤有机质含量,并显著影响土壤真菌的群落结构,但是对土壤细菌群落结构无显著性影响,此结果暗示了植被修复对土壤有机质含量的影响可能是土壤真菌群落发生改变的重要因素,同时也暗示了土壤真菌群落对土壤环境的变化更加敏感.因此在高速公路边坡修复过程中可以通过适当增加土壤有机质含量(如施肥),促进土壤真菌活性,加快土壤养分循环,进而更好地改善边坡生态环境.此外,土壤有机质增加也可以促进土壤团聚体的形成,进而影响土壤微生物群落结构[30],未来研究中可以更多地关注高速公路边土壤团聚体形成和微生物群落多样性的关系,这对于更好地进行边坡的生态修复具有重要意义.

