聚乙烯醇联合藻酸钙与兔软骨细胞共培养对兔膝关节软骨缺损修复的影响
王晓希,赵晓萌 ,余向前,赵文国,李志强
随着现代骨科学的迅速发展,膝关节软骨损伤修复的方法、技术、设备不断完善。藻酸钙(CaAlg)三维立体支架是目前常见的软骨缺损填充物之一,对缺处的磨损有较好的修复作用[1-2]。CaAlg三维立体支架内培养的软骨细胞,对软骨细胞的增殖具有促进作用。本研究旨在以聚乙烯醇(PVA)与CaAlg为材料,结合支架内细胞培养技术[1]制作多孔的、可渗透的复合支架,探讨PVA联合CaAlg(PVA/CaAlg)与兔软骨细胞(ATDC-5)共培养对兔膝关节软骨缺损修复的影响,以及对胰岛素样生长因子-1(IGF-1)的mRNA表达及Ⅱ型胶原分泌的影响。
1 材料与方法
1.1 实验动物清洁级4周龄新西兰白兔3只,体重0.9~1.1(1.0±0.1)kg,清洁级成年新西兰白兔20只,体重2.9~3.1(3.0±0.1)kg,雌雄不限。实验动物由华北理工大学实验动物中心提供(批准号:GB/T35823-2018)。动物在实验前适应性饲养1周,自由饮食和摄水,每天光照12 h,环境温度21~23(22±1) ℃。
1.2 材料与试剂PVA(聚合度为97%,百灵威科技有限公司)、胎牛血清(Gibco公司),Ⅱ型胶原酶I抗(北京博奥森生物技术有限公司),通用型Ⅱ抗、PBS缓冲液、DAB显色剂(北京中杉金乔生物技术有限公司),DMEM培养基(大连美伦生物技术有限公司),青霉素-链霉素双抗、海藻酸钠、氯化钙[艾康生物技术(杭州)有限公司],RT-PCR引物(爱康生物科技有限公司),Trizol(Invitroge公司),水合氯醛(洛阳市洛龙区豫科环试化工商店),HE染色试剂盒[博苑生物科技(上海)有限公司]。
1.3 实验仪器与器械二氧化碳培养箱(三洋公司),双人单面超净工作台SW-CJ-1BU(博迅医疗生物仪器股份有限公司),电热恒温水浴锅(金坛市医疗仪器厂),光学显微镜CX41-12C02、扫描电镜SU8010(奥林巴斯公司),可见分光光度计722N(上海光学仪器厂),电子天平JA2005(北京中西远大科技有限公司),高速离心机(北京医学离心机厂),RT-PCR热循环仪CFX96(Bio-Rad公司),病理切片机YD1508B(金华市益迪医疗设备有限公司),盖玻片、载玻片、一次性吸管、无菌离心管[诺尔曼生物技术(南京)有限公司],无菌培养皿、培养瓶[博苑生物技术(上海)有限公司],外科手术器械(上海浦东金环医疗用品股份有限公司)。
1.4 样品制备
1.4.1ATDC-5细胞的制备与培养 处死3只4周龄新西兰白兔,碘伏反复消毒皮肤3次以上,外侧髌骨旁做切口,剥开兔皮,游离双下肢肌肉组织,暴露膝关节(切勿损伤关节囊),截取双侧膝关节,取膝关节软骨,碘伏消毒后放入无菌培养皿,转移至超净工作台,用PBS缓冲液充分冲洗直至表面无碘伏。再用刀片小心取下表面的软骨组织,将其放入烧杯中,再次用PBS缓冲液冲洗至无色。剪碎软骨组织放入50 ml立式离心管中,加入0.2%Ⅱ型胶原酶,37 ℃下消化60 min。消化结束后,用吸管吸出多余的消化液,150目尼龙筛网过滤,过滤后放入离心管中加入DMEM终止消化,于1 000 r/min离心5 min,弃去上清液,反复吹打成混悬液,于含5%的胎牛血清的DMEM培养基中培养,光镜下观察细胞的形态与密度。大约每隔2 d更换1次培养液,若光镜下观察到软骨细胞完全贴壁80%左右,即可传代。将兔ATDC-5细胞传至第2代,HE染色观察兔ATDC-5细胞的形态变化,免疫组化染色观察Ⅱ型胶原的分泌情况。

图1 PVA/CaAlg材料
1.4.2PVA/CaAlg材料的制备与兔ATDC-5细胞三维培养冷冻-解冻循环法制备复合物 采用超滤法去除海藻酸钠溶液及氯化钙溶液中的热原及微生物后,将氯化钙浓度调至3 mol/L、海藻酸钠浓度调至4%后混合搅拌均匀,此时其溶胀率达到最大,获得CaAlg凝珠后,溶解一定量的PVA,在90 ℃下油浴,加热不断搅拌4 h,再加入CaAlg搅拌4 h,最后静置脱泡。将混合液倒入模具中,于-20 ℃冰箱中冷冻成型,12 h后取出,在室温下解冻6 h。重复上述冷冻解冻过程5次。将PVA与CaAlg的浓度比例调节为3 ∶7,置于-50 ℃下进行冷冻干燥,最终形成多孔的PVA/CaAlg材料 (见图1),并采用高温蒸汽灭菌法测定PVA/CaAlg材料的无菌性。 滴入兔ATDC-5 悬液淹没PVA/CaAlg材料,2周后HE染色及Ⅱ型胶原免疫组化染色,检查PVA/CaAlg材料内兔ATDC-5细胞的活性。
1.4.3兔膝关节缺损模型制备及分组 按随机数字表法将20只成年新西兰白兔分为对照组、实验组,每组10只。两组按剂量3 ml/kg腹腔注射15%水合氯醛麻醉,仰卧固定于手术台,使双下肢处于伸直状态。常规碘伏消毒3次,以右膝关节内侧做横向切口1 cm,逐层分离,暴露内侧副韧带。定位关节腔位置,切断内侧副韧带,可见内侧半月板和关节腔,再用小剪刀进入关节腔剪断前后交叉韧带,充分暴露关节面,在下端右膝关节软骨造缺损模型。对照组:缺损区不做处理,每5 d向右膝关节腔内注射生理盐水2 ml;实验组:植入共培养后的PVA/CaAlg复合物,术后5 d内局部注射庆大霉素预防感染,12周后对缺损区组织进行HE染色、免疫组化染色、RT-PCR定量分析IGF-1的mRNA表达。
1.5 软骨组织HE染色12周后,两组动物全部处死,将右膝关节上下折断,转移至超净工作台,剔除多余的肌肉组织,打开关节腔,充分暴露缺损处,用PBS缓冲液洗净后固定于4%多聚甲醛中,避光下固定24 h后,再用流水不断冲洗24 h,予以常规石蜡包埋、切片、HE染色,光镜下观察软骨组织病理学变化。
1.6 Ⅱ型胶原免疫组化染色光镜下观察细胞爬片情况,PBS缓冲液冲洗3遍,每次2 min;滴加Trypsin-EDTA进行修复20 min,PBS缓冲液冲洗3遍,每次2 min;再滴加3% H2O2封闭液10 min,PBS缓冲液冲洗3遍,每次2 min;接着将通用型Ⅱ抗滴加到切片上,在37 ℃下孵育30 min,PBS缓冲液冲洗3遍,每次2 min;再滴加DAB显色剂,室温下显色5 min,光镜下观察终止显色;最后进行HE染色,二甲苯透明及中性树胶封片,观察修复处软骨细胞的胶原分泌情况。
1.7 RT-PCR定量分析IGF-1的mRNA表达采取氯仿法提取瘢痕组织RNA,紫外吸收法测定其纯度和浓度。用Trizol法提取总RNA,扩增条件:94 ℃ 预变性下5 min ;变性94 ℃下40 s,退火55 ℃ 下50 s,延伸72 ℃下50 s,共35个循环。引物由浙江爱康生物科技有限公司合成,GAPDH基因mRNA内参,上游引物5′-CCA-CAT-CGC-TCA-GAC-CAT-3′,下游引物5′-ACG-GTG-CCA-TGG-AAT-TTG-CCI-3′。具体步骤如下:精密称取200 mg软骨组织,加入Trizol溶液1 ml,剪碎,震荡30 s,加入0.2 ml氯仿,室温下剧烈震荡30 s,于4 ℃ 12 000 r/min离心15 min,吸取上清液,加入相同体积量的异丙醇溶液,-20 ℃下放置30 min后,于4 ℃ 12 000 r/min离心10 min,离心后可见底部有少量的RNA。再弃去上清液,加入1 ml 75%乙醇,震荡摇匀,连续洗涤2次,于4 ℃ 7 500 r/min离心10 min,弃去上清液,再用滤纸吸走残余液体,室温下干燥10 min。利用光谱分析A260/A280的比值(范围为1.8~2.1)检测RNA提取后的纯度,-80 ℃保存备用。按照下列顺序依次加入试剂:RT-PCR缓冲液25 μl、MgCl2(25 mmol/L)1.5 μl、2.5 mmol/L dNTP 2.0 μl、上游引物和下游引物各2.0 μl、0.2 μl Tap DNA聚合酶以及1 mg/L DNA模板2.0 μl。最后按照上述扩增条件在RT-PCR热循环仪上进行扩增并进行对比分析。
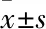
2 结果
2.1 兔ATDC-5细胞形态及组织学检查光镜下观察,第2代兔ATDC-5细胞贴壁良好,少部分细胞正在分裂增殖,此时细胞呈椭圆形、多角形,见图2。原代软骨细胞培养72 h后,HE染色显示软骨细胞形态良好,细胞形态多呈卵圆形、多角形;细胞核为圆形或椭圆形,胞液丰富,着色明显,部分细胞伸出伪足,见图3A;在光镜下观察,Ⅱ型胶原免疫组化染色显示细胞胞质呈棕黄色,细胞生长地方棕色较深,见图3B。
2.2 PVA/CaAlg复合物内细胞形态及组织学检查2周后对PVA/CaAlg复合物进行HE染色,结果显示兔ATDC-5细胞表型正常,部分细胞分裂,细胞核着色呈蓝色,细胞内液丰富,呈淡红色,支架结构完整,见图4A;Ⅱ型胶原免疫组化染色结果显示,细胞胞质呈棕黄色,细胞内外均可见到棕色颗粒状,见图4B。
2.3 缺损区修复状况的对比检查与实验组相比,对照组膝关节缺损区明显瘢痕组织增生,关节面不平整,伴有大量的关节液增加现象,见图5。HE染色结果显示对照组缺损区细胞及组织结构排列紊乱,软骨细胞较少,纤维组织显著增多,无新生血管长入,实验组缺损区细胞及组织结构排列较整齐,软骨细胞多,细胞核微小、聚集,纤维组织较少,见图6。表明PVA/CaAlg与软骨细胞共培养能促进细胞增殖的同时纤维组织在逐渐减少。通过免疫组化染色在光镜下可明显观察到:能分泌Ⅱ型胶原的软骨细胞着黄褐色,对照组Ⅱ型胶原分泌较少,排列不规律,实验组Ⅱ型胶原分泌较多,排列整齐规律,见图7。说明PVA/CaAlg与软骨细胞共培养可明显促进软骨细胞分泌Ⅱ型胶原。
2.4 RT-PCR定量分析IGF-1的mRNA表达提取mRNA的纯度经核酸蛋白检测仪检测以及扩增和溶解曲线分析表明,无明显杂质,符合实验要求。结果显示, IGF-1的mRNA表达量对照组低于实验组,差异有统计学意义(P<0.05),见图8。
3 讨论
关节软骨损伤后很难进行自我修复,虽然损伤后局部软骨细胞能进行一定程度的有丝分裂,形成瘢痕和增厚的软骨组织,并产生胶原,但新生的胶原不足以修复软骨缺损区,增厚软骨表层也仅仅是以成纤维细胞为主的增生,其生物力学性能不如软骨组织,也无法承受过重负荷。这种修复仅是形态上的修复并不是完全修复,造成这种结果的原因有很多,根据我们多年经验认为其原因如下:① 软骨细胞增殖能力较差,蛋白多糖分子的合成、聚合与硫酸化易受内外环境因素的变化,损伤情况下炎症因子的刺激导致其分解速率增加。② 软骨组织基质主要有胶原及可聚蛋白聚糖,赋予了组织外形和强度,但也因其致密的结构导致缺损区缺少迁移增殖并参与修复的未分化细胞。③ 成年后,软骨钙化层中羟基磷灰石大量沉积导致潮线的出现,进一步减少了其营养来源[3-4]。这些原因损伤后软骨细胞成簇状或克隆状增生,而没有能力修复损伤组织及阻止损失进一步加重,只能让损失部位及其周围发生进一步的撕裂及启动炎症反应。④ 损伤后缺损区的不平整,在缓慢的修复过程中由于磨损会延缓愈合或加重损伤。以上这4种因素均影响着软骨的自身修复作用。

图2 第2代兔ATDC-5细胞光镜下形态,细胞呈椭圆形、多角形 ×100 图3 原代软骨细胞72 h后HE染色及免疫组化染色 ×100 A.HE染色显示细胞多为圆形或椭圆形,着色显著,部分细胞伸出伪足;B.Ⅱ型胶原免疫组化显示细胞胞质呈棕黄色,细胞生长地方棕色较深 图4 PVA/CaAlg复合物HE染色及免疫组化染色 ×100 A.HE染色显示部分细胞分裂,细胞核着色呈蓝色,细胞内液呈淡红色,支架结构完整;B.Ⅱ型胶原免疫组化显示细胞胞质呈棕黄色,细胞内外均可见到棕色颗粒状
IGF-1是一种多功能的细胞增殖调控因子,可促进关节软骨细胞的增殖及活性[5]。同时兔ATDC-5细胞中IGF-1的表达情况,是反映软骨缺损修复情况的指标之一。本实验中,通过HE染色观察兔ATDC-5细胞在材料上的生长情况,免疫组化检测Ⅱ型胶原的分泌,RT-PCR检测IGF-1的mRNA表达,发现实验组兔ATDC-5细胞的数量、胶原的分泌、排列规律性以及IGF-1的mRNA表达明显优于对照组,推测可能是通过PVA/CaAlg复合物与兔ATDC-5细胞共同培养,提高了IGF-1的表达,增加Ⅱ型胶原酶的分泌,从而促进对兔膝关节软骨缺损的修复作用。
综上所述,PVA/CaAlg复合物是一种良好的支架,这种复合支架材料具有良好的理化及生物学性能,与兔ATDC-5细胞共同培养后植入缺损区,为修复关节软骨缺损提供了一种有效的方法。

