一株土壤解磷细菌发酵条件的优化
王美鑫,吴松,张媛媛,韩森汇,张晓阳,宋漳
(福建农林大学林学院,福建 福州 350002)
土壤中含有难溶性磷,解磷微生物的存在可以将其转化为可吸收利用的可溶性磷,改善植物磷素营养,促进土壤中有益微生物代谢[1].在解磷的过程中,微生物还可以分泌有机酸、酶类以及一些小分子物质[2-4],其解磷细菌本身在环境土壤的改良中具有应用潜力[5].不同的解磷菌的解磷能力亦不相同[6],同种解磷菌的解磷能力在不同的土壤环境条件下表现仍有很大差异[7-8].在油茶林土壤微生物及解磷菌的分离筛选等领域,诸多科研工作者进行了大量研究.对于根际土壤微生物的开发利用,假设可以从油茶根际土壤分离并筛选出高效能的功能菌株,探究最佳的生长环境,将对研制微生物肥料具有长远而深刻的意义[9-10].本试验探究不同的培养基、温度、初始pH、转速、接种量和装液量等条件对解磷菌株解磷特性的影响,旨在为提高土壤磷利用率提供理论依据.
1 材料与方法
1.1 供试菌株与供试培养基
供试解磷细菌CoPDB4分离自福建省闽侯桐口林场油茶根际土壤,保存于福建农林大学森林保护研究所.
种子液体培养基:蔗糖5.0 g,淀粉5 g,K2HPO40.2 g,MgSO4·7H2O 0.2 g,CaSO40.1 g,(NH4)2SO41.0 g,CaCO30.5 g,NaCl 0.2 g,H2O 1 000 mL;SP培养基:葡萄糖10 g,酵母粉0.5 g,(NH4)2SO40.5 g,Ca3(PO4)25 g,KCl 0.3 g,H2O 1 000 mL;NBRIY培养基:葡萄糖10 g,(NH4)2SO40.5 g,Ca3(PO4)25 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·7H2O 0.03 g,NaCl 0.3 g,KCl 0.3 g,H2O 1 000 mL;NBRIP培养基:葡萄糖10 g,(NH4)2SO40.1 g,Ca3(PO4)25 g,MgSO4·7H2O 0.25 g,MgCl2·7H2O 5 g,KCl 0.2 g,H2O 1 000 mL;NBRIYP培养基:葡萄糖10 g,酵母粉0.5 g,(NH4)2SO40.1 g,Ca3(PO4)25 g,MgSO4·7H2O 0.25 g,MgCl2·7H2O 5 g,KCl 0.2 g,H2O 1 000 mL.
1.2 供试菌株活化
将供试菌株CoPDB4接种于种子液体培养基,在温度28 ℃、转速160 r/min下摇培3 d,获得一级种子菌液.以相同的方法取一级种子菌液5 mL接种于种子液体培养基,在相同条件下摇培相同时间,获得二级种子菌液.同理,获得三级种子菌液,得到活化的供试菌株.
1.3 生物量和磷含量的测定
(1)紫外分光光度计测生物量[11].将发酵处理后的种子液定量(3 mL)吸取到比色皿中,以纯净培养基为对照,每个样品重复3次.对照比色皿放在第一个,其余样品依次排列,设定分光光度计的波长为700 nm,对照组进行校对,其余样品依次检测,记录每天样品测定值.
(2)钼锑抗比色法[12]测定磷含量.将处理后的待测样品pH调至颜色刚成微黄色后,加入5 mL钼锑抗显色剂,定容,摇匀.30 min后,于分光光度计上用2 cm光径比色皿比色处理,将波长设定为700 nm比色,以空白试验溶液为参比液,调OD值到零,测定待测显色液的OD值.
1.4 发酵培养条件优化
(1)培养基.选用SP、NBRIY、NBRIP、NBRIYP4种培养基优化处理,以不接种液体培养基为对照,每个处理各重复3次.接种菌株种子液后,于28 ℃、160 r/min条件下摇培7 d,测定生物量与磷含量.
(2)pH.将pH设定为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0优化处理,以pH 7.0不接种培养基为对照,每个处理重复3次.测定方法同上.
(3)装液量.设定装液量50、75、100、125、150、175 mL优化处理,每个处理重复3次.测定方法同上.
(4)接种量.将接种量设定为1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mL优化处理,以不接种的液体培养基为对照,每个处理重复3次.测定方法同上.
(5)温度.将温度设定为24、26、28、30、32、34 ℃优化处理,每个处理重复3次.测定方法同上.
(6)摇床转速.设定不同转速20、140、160、180、200、220 r/min优化处理,每个处理重复3次.测定方法同上.
1.5 数据分析
采用Word 2003对试验数据加以处理,SPSS 21.0进行单因素分析.
2 结果与分析
2.1 不同培养基对解磷细菌的影响
解磷细菌在供试4种培养基中均能生长(图1),其中在NBRIY培养基中生长量最高,解磷能力也最强.且在NBRIY培养基中生长的细菌生物量和解磷能力显著高于SP、NBRIP和NBRIYP培养基.对比其余3种培养基,只有NBRIY培养基中包含了FeSO4·7H2O,说明解磷细菌在含Fe2+的培养基中培养效果更好,因此NBRIY培养基可作为解磷细菌的首选培养基.
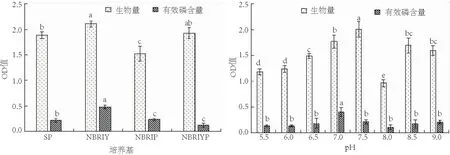
图1 不同培养基对细菌CoPDB4生长量和解磷能力的影响 图2 pH对细菌CoPDB4生长和解磷能力的影响 Fig.1 Effects of culture media on the growth rate and Fig.2 Effects of pH on the growth rate and phosphate-solubilizing ability of bacteria CoPDB4 phosphate-solubilizing ability of bacteria CoPDB4
2.2 pH对解磷细菌的影响
解磷细菌在pH 6.8~8.2内均能够生长(图2),在pH为7.5的培养基中生长最好,而在pH为7.0的培养基中解磷能力最强.在pH为7.0的培养基中生长的细菌生物量和解磷能力显著高于其余pH培养基,不同pH培养基对解磷细菌差异有统计学意义(P>0.05).由此可说明该解磷细菌在中性偏碱性的条件中生长情况最好且作用效果最强,有利于解磷细菌的生长,且更好地发挥作用.
2.3 装液量对解磷细菌的影响
解磷细菌在体积分数为20%~70%装液量的培养基中均可生长,在30%装液量条件下OD值最高,即生长最好,在20%装液量条件下解磷能力最强.且在不同装液量的培养基中,菌株的生长与解磷能力差异有统计学意义(P>0.05,图3).图中表明,该解磷细菌不适宜在装液量高的条件下生长和发挥作用,装液量越多,菌液的相对含量降低,使得细菌存活率降低,且解磷量减少;在适宜装液量(20%、30%)下能保证该菌的正常生长和发挥作用,有利于磷含量的提高.
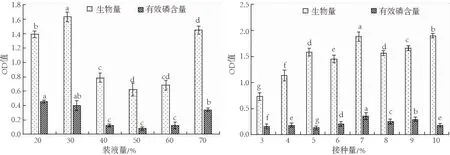
图3 装液量对细菌CoPDB4生长量和解磷能力的影响 图4 接种量对细菌CoPDB4生长量和解磷能力的影响Fig.3 Effects of volume on the growth rate and Fig.4 Effects of inoculum amount on the growth rate phosphate-solubilizing ability of bacteria CoPDB4 and phosphate-solubilizing ability of bacteria CoPDB4
2.4 接种量对解磷细菌的影响
解磷细菌接种体积分数为3%~10%的菌液在培养基中均可生长,在7%接种量条件下OD值最高,即生长最好,生物量最高,解磷能力也最强,.且在不同接种量的条件下,菌株的生长和解磷能力的差异均具有统计学意义(P>0.05,图4).图中表明,该解磷细菌对接种量有一定要求,随着接种量的增多,解磷细菌的生长和解磷能力逐渐提高,当接种量到达7%时,生物量和解磷量到达峰值,此后接种量的增多使得解磷细菌的生长和解磷能力降低.因此,7%接种量为该解磷细菌发酵培养的最适接种量,可用于后续的优化实验,提高解磷细菌的解磷能力.
2.5 温度对解磷细菌生长的影响
解磷细菌在24~34 ℃均可生长,在30 ℃时,生长最好且解磷能力最好.且在不同温度下,菌株生长和解磷能力的差异均具有统计学意义(P>0.05,图5).

图5 温度对细菌CoPDB4生长量和解磷能力的影响 图6 摇床转速对细菌CoPDB4生长量和解磷能力的影响Fig.5 Effects of temperatures on the growth rate and Fig.6 Effects of shaking speed on the growth rate phosphate-solubilizing ability of bacteria CoPDB4 and phosphate-solubilizing ability of bacteria CoPDB4
图5表明,随着温度的升高,解磷细菌的生长量与含磷量也在同步提高,说明温度对于该解磷细菌的生长和发挥作用有一定影响;到30 ℃时,生长量与含磷量达到峰值,温度高于30 ℃含量均降低,说明30 ℃是解磷细菌生长的最佳温度.
2.6 摇床转速对解磷细菌的影响
解磷细菌在120~220 r/min的摇床转速之间均能生长,在摇床转速为160 r/min时,解磷细菌的解磷能力最强,而在摇床转速为180 r/min使菌株生长最好.且在不同的摇床转速下,菌株生长和解磷能力的差异均具有统计学意义(P>0.05,图6).在摇床转速较高条件下,生物量和含磷量降低,说明解磷细菌在高转速条件下受到抑制而无法正常生长和进行解磷作用,在160、180 r/min下解磷细菌的解磷能力和生物量均达到高水平,因此可选用转速为160、180 r/min作为解磷细菌发酵培养的优选转速.
3 结论
磷对植物生长发育起重要的作用[13].土壤中含有大量难溶性磷,只有0.1%可供植物吸收利用,严重限制了作物的生长[14].土壤中的解磷微生物能将难溶性磷转化为可溶性磷,促进植物吸收,提高磷肥利用率.张海燕等[15]从小麦根际土壤中分离筛选出2株高效解磷细菌,对其进行发酵条件优化,促进了小麦生长和根部发育;庄馥璐等[16]从苹果根际土壤中筛选出具有矿化有机磷能力的解磷菌,提高了有机磷的利用率.培养条件不同时,解磷微生物的影响也不同,陈炫等[17]研究出解磷菌N1-41-43的最佳温度30 ℃、最适pH为6.5,解磷量190.57 mg/L;武志海等[18]对水稻根际土壤分离筛选的2株解磷菌研究表明最佳碳源为葡萄糖、最佳氮源为蛋白胨、最适pH为6.0.
本试验以油茶根际解磷微生物为研究对象,对从油茶根际土壤中分离筛选出的解磷细菌进行发酵条件优化,得出解磷细菌CoPDB4在6 d时解磷能力最佳,此后培养时间越长解磷能力下降较快;在NBRIY培养基中,pH为7.5,温度为30 ℃,摇床转速为180 r/min时解磷细菌生长最好;在NBRIY培养基,pH为7.0,温度为30 ℃,摇床转速为160 r/min时解磷能力最强.该结果中的温度条件与苏辉兰等[19]对贡柑果园高效解磷菌条件优化研究所得结果一致;在装液量为20%(体积分数)时解磷能力最好,当装液量逐渐增加时解磷能力下降,说明解磷细菌属好氧型细菌,在氧气充足的条件下自身的代谢能力更好,且该条件与李卫荣[20]从玉米根际土壤中筛选的高效解磷菌条件优化所得结果相同;接种量的选择在考虑解磷能力基础上还需要考虑生产中的经济效益,试验所得接种量为7%时解磷能力最强.

