新型鹅星状病毒FJ-NP株的分离鉴定
林裕胜,江锦秀,张靖鹏,游 伟,胡奇林
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
0 前言
【研究意义】星状病毒是重要的传染病原之一,对人类健康和动物养殖业已构成威胁,特别是给养殖业造成了严重的经济损失。开展罹病雏鹅新型鹅星状病毒的分离鉴定,可为新型鹅星状病毒的致病机制研究和疫苗研发积累素材、提供理论参考。【前人研究进展】星状病毒(Astroviruses,AstV)分为哺乳动物星状病毒属(Mamastrovirus)和禽星状病毒属(Avastrovirus),已被证实的哺乳动物星状病毒属有19种,禽星状病毒属有3种[1−3]。其中禽星状病毒1型主要为火鸡星状病毒1型(Turkey astrovirus 1, TAstV-1);禽星状病毒2型包括禽肾炎病毒1型(Avian nephritis virus 1, ANV-1)和肾炎病毒 2型 (Avian nephritis virus 2 ANV-2); 禽星状病毒3型包括鸭星状病毒1型(Duck astrovirus 1, DAstV)、火鸡星状病毒2型(Turkey astrovirus,TAstV-2)和一些未经分类的星状病毒[3]。星状病毒基因组的高度变异使其对环境和宿主具有很强的适应能力,甚至可跨种传播[4−5]。2017年以来,国内多省市爆发了一种以痛风为主要特征的致死性传染病,5~20日龄雏鹅感染后精神沉郁、食欲减退、消瘦、四肢瘫痪等,死亡率高达30%,剖检可见患病鹅内脏、翅腿部关节及喙部等处出现白色尿酸盐沉积;经病原分离鉴定、动物回归试验以及序列分析,确定为新型鹅星状病毒(Novel goose astrovirus,GAstV)[6−9]。【本研究切入点】2019年8月,福建省南平市某鹅场雏鹅大量出现关节肿胀,剖检有尿酸盐沉积的传染性疾病,在5~20日龄的雏鹅中发病率高达40%,死亡率为80%,然而引起该病的病原尚不清楚。【拟解决的关键问题】为明确其病因,本研究通过采集患病雏鹅的心、肝、脾、肺、肾等组织进行PCR检测和病原分离鉴定,最终确定引起该场发病的病原为新型鹅星状病毒,对分离的新型鹅星状病毒的ORF2部分基因进行克隆测序分析,明确其遗传进化规律,为后续疫苗研制和开展相关基础研究提供重要素材。
1 材料与方法
1.1 样品来源
3份心肝脾肺肾组织样品均采自福建省南平市某发病鹅场,患病鹅临床症状为关节肿大,精神沉郁,剖检可见肝脏、肺脏、肾脏及关节腔有严重的尿酸盐沉积。
1.2 试验材料与主要试剂
健康鹅胚由福建长乐灰鹅保种场提供,该场种鹅所产种蛋、孵出的雏鹅未发生过痛风病,鹅星状病毒PCR检测结果为阴性,鹅星状病毒抗体检测结果为阴性;DH5α感受态细胞、TranScript One-Step gDNA Removal and cDNA Synthesis Super Mix反转录试剂盒、病毒DNA/RNA提取试剂盒购自北京全式金生物技术有限公司;胶回收试剂盒购自康宁生命科学(吴江)有限公司;pMD19-T载体、DL2000均购自宝生物工程(大连)有限公司。
1.3 样品处理
无菌采集患病雏鹅心、肝、肺、肾、脾等组织并进行细菌分离,同时对采集的肝脏、脾脏和肾脏等组织,在生物安全柜内用灭菌剪刀剪碎后按照1∶10加 入 无 菌PBS(pH7.4、0.01 mol·L−1)进 行 研磨,反复冻融3次后,3 000 r·min−1离心15 min,上清液0.22 μm滤器过滤后−20 ℃冰箱保存。
1.4 引物设计
根据GenBank已公布的新型鹅星状病毒ORF2基因(No: MN399857.1)序列,Oligo 7.9软件设计1对新型鹅星状病毒特异性检测引物,引物序列:P1: 5′- AT TACCCATGAAGGCCGAGAGGAAGCTTGAGAAA-3′/P2:5′- GTTCAAGATGCGGCCGAGCTTTTATG GTATCTAT-3′,退火温度55 ℃,扩增片段为383 bp。鹅细小病毒(Goose parovovirus, GPV)、禽流感病毒(Avian influence virus, AIV)、禽呼肠孤病毒(Avian orthoreovirus, ARV)、新城疫病毒(Newcastle disease virus, NDV)、鹅多瘤病毒(Goose polyoma virus, GPoV)及鹅圆环病毒(Goose circovirus, GoCV)等鹅常见病毒检测的引物序列参照参考文献[10](表1),所有引物均由福州擎科生物工程有限公司合成。
1.5 病原分离
取过滤后的上清液,经尿囊膜接种11日龄鹅胚,37 ℃孵育,每天早晚各照胚1次,弃掉24 h内死亡鹅胚,连续观察7 d,并做好记录,收集尿囊液和病变明显的组织脏器。收获的组织和尿囊液经研磨处理后继续接种鹅胚,连续盲传5次,取3~5代次尿囊液及组织脏器研磨液进行后续检测。
1.6 核酸的提取
利用全式金DNARNA试剂盒,按照说明书操作步骤提取组织样品和研磨液中的DNA和RNA。
1.7 反转录
应用北京全式金生物技术有限公司商品化反转录试剂盒将提取的样本总 RNA反转录为cDNA,反转录体系(10 μL):Random Primer 1 μL,RNase-freewater 5.0 μL,TranScript RT/RI Enzyme Mix 1.0 μL,gDNA Remover 1.0 μL,Reaction Mix 10 μL,RNA模板2.0 μL。反应程序为:25 ℃ 10 min,42 ℃ 30 min,85 ℃ 5 s,4 ℃终止。

表 1 鹅常见病毒引物Table 1 Primers for common goose viruses
1.8 PCR扩增
以上述cDNA和DNA为模板,用合成的新型鹅星状病毒、禽流感病毒、新城疫病毒、呼肠孤病毒、鹅细小病毒、鹅圆环病毒及鹅多瘤病毒等引物进行PCR扩增检测[10]。PCR反应体系(20 μL):Mix 10 μL,上 游 引 物1.0 μL,下 游 引 物1.0 μL,DNA/cDNA模板2 μL,双蒸水补足至20 μL。反应程序为:95 ℃预变性 5 min,95 ℃ 变性 30 s,55~60 ℃退火30 s,72 ℃延伸30 s,进行35个循环,72 ℃延伸10 min,4 ℃终止反应。
1.9 新型鹅星状病毒ORF2基因克隆、测序与分析
将设计好ORF2基因引物对1.5中研磨液提取的核酸进行PCR扩增,扩增条件参照1.8中进行,退火温度为55 ℃,扩增产物经胶回收纯化试剂盒纯化后与pMD19-T载体连接,转化至 DH5α感受态细胞中。挑取单个菌落进行扩大培养,经菌液PCR鉴定为阳性克隆后,送至福州尚亚生物科技有限公司测序。利用DNAStar.Lasergene.v7.1软件对测定的ORF2基因序列与GenBank上公布的32株新型鹅星状病毒株(表2)进行相似性对比分析并构建遗传进化树。
2 结果与分析
2.1 临床样品RT-PCR检测结果
除设计的新型鹅星状病毒特异性引物对3份组织研磨液在380 bp左右处有扩增条带外,其余鹅常见病毒病均未扩增,图1中仅展现新型鹅星状病毒引物扩增片段。
2.2 病原分离
为进一步明确是否有细菌感染,对患病雏鹅心脏、肝脏、脾脏、肺脏和肾脏组织进行细菌分离,结果均未分离到细菌,排除是由细菌感染引起的。组织研磨液处理后接种11日龄鹅胚后,7日内鹅胚均未出现死亡。第1代至第5代鹅胚均出现全身广泛性出血点和出现斑,剖检胚体可见肝脏出血点,第3代后鹅胚出现尿囊膜增厚,解剖胚体可见肝脏组织坏死(图2)。取鹅胚第3代到第5代尿囊液和组织研磨液进行鹅常见病毒PCR和RT-PCR扩增,结果显示,仅有新型鹅星状病毒在380 bp处有特异性的扩增条带,其他病原未有扩增条带(图3)。表明分离的毒株为新型鹅星状病毒。
2.3 鹅星状病毒ORF2基因序列分析
测序结果经NCBI在线比对分析后,与新型鹅星状病毒的同源性最高,表明分离株为新型鹅星状病毒:命名为 FJ-NP 株。将FJ-NP 株ORF2基因扩增序列与下载的32株新型鹅星状病毒进行相似性分析和遗传进化分析,相似性结果显示FJ-NP株 ORF2基因核苷酸序列与32株参考株的相似性为97.69%~99.74%,其中与黑龙江AstV-Goose-2018-HLJ01和河南(AstVHN02-Goose-1119-18、AstV-AH02-Goose-0715-18、AstVHB02-Goose-0310-19)相似性最高均为99.74%,与北京HN1G株相似性最低为97.4%;遗传进化树结果显示分离株与安徽(GD AHAU2、AHAU3、AHAU5)株、黑龙江AstV-Goose-2018-HLJ01株和河南(AstVHN02-Goose-1119-18、AstV-AH02-Goose-0715-18、AstVHB02-Goose-0310-19、AstV-HN03-Goose-0402-19)株在同一进化分支上,与湖北AstV-HBXG-Goose-2019株、北京HN1G株、福建GTF-04株亲缘关系较远,暗示该流行毒株可能为安徽和河南的变异株(图4~6)。

表 2 新型鹅星状病毒参考毒株Table 2 Reference strains for novel goose astrovirus
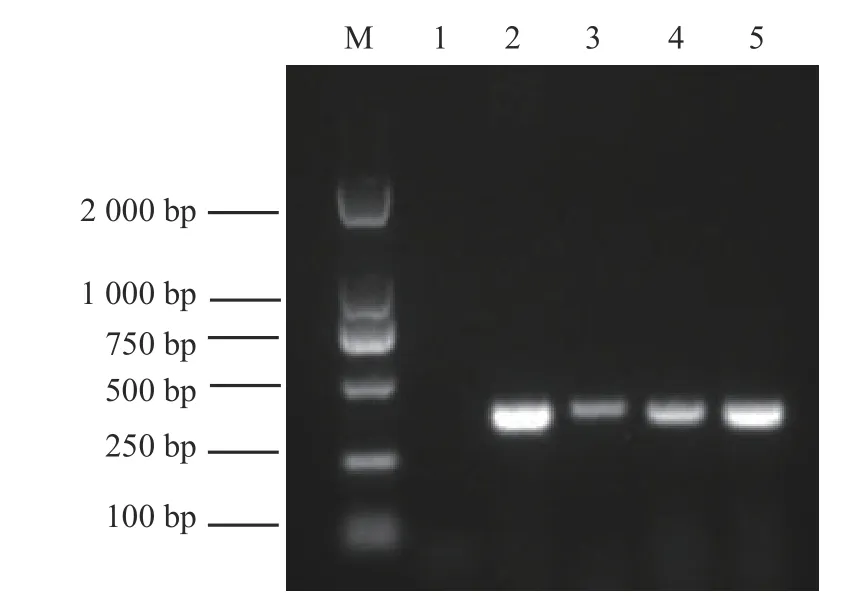
图 1 临床样品中新型鹅星状病毒RT-PCR检测Fig. 1 RT-PCR detection of novel goose astrovirus in clinical samples

图 2 死亡鹅胚体变化Fig. 2 Pathologic changes in goose embryo

图 3 分离株新型鹅星状病毒RT-PCR检测结果Fig. 3 RT-PCR result on isolated strain of novel goose astrovirus

图 4 FJ-NP 株ORF2基因PCR扩增图Fig. 4 RT-PCR amplification of FJ-NP ORF2 genes

图 5 ORF2部分基因核苷酸同源性比较Fig. 5 Homology of partial ORF2 gene nucleotide

图 6 ORF2部分基因遗传进化分析Fig. 6 Phylogenetic tree analysis based on partial ORF2 gene
3 讨论与结论
星状病毒可引起雏鸭肠炎、腹泻、病毒性肝炎,鸡的肠炎,以及降低各种禽类孵化率等,但在鹅群中的感染报道近几年才有。Zhang等[6]于2015年在江苏、安徽、广东、山东和福建等地采集病料中检测到星状病毒,通过病原分离鉴定以及全基因测序证实分离到的星状病毒与禽类和人的星状病毒存在一定差异,结合其剖检症状以内脏和关节腔尿酸盐沉积为主,有别于传统星状病毒剖检特征,故命名为新型鹅星状病毒。
南平市是福建省养鹅主要地区,近年来多有关于新型鹅星状病毒在该地区发生的报道,已成为制约养鹅业的主要疫病之一。2019年南平市某养鹅场大量雏鹅出现关节肿大,剖检内脏和关节有大量的尿酸盐沉积,疑似感染了新型鹅星状病毒。本团队通过实地调研、临床症状和剖检病变初步判断该养鹅场感染了新型鹅星状病毒感染。通过对采集样品进行病原分离、RT-PCR检测和克隆测序分析,最终成功分离到了1株新型鹅星状病毒,命名为FJ-NP。国内外的研究结果显示引起鹅痛风的原因较多,比如高钙高蛋白饲料引发机体蛋白质代谢障碍和肾脏损伤,缺水导致的尿酸血症,以及磺胺类药物引起的中毒和肾脏损伤等,因此在临床诊断过程中应当注意鉴别诊断[11−13]。目前新型鹅星状病毒的起源、宿主范围,变异程度,分子发病机制和潜在的人畜共患风险等情况仍不清,有待于进一步研究。根据ORF2基因编码的衣壳蛋白序列,禽星状病毒可分为3型即禽星状病毒1、2和3型[14−17]。本研究通过PCR扩增获得了分离株ORF2基因部分序列,随后进行克隆测序,对测序结果开展遗传进化分析,结果显示该分离株ORF2核苷酸序列与GenBank上发表的32株新型鹅星状病毒的同源性均在97%以上,且与黑龙江AstV-Goose-2018-HLJ01和河南(AstVHN02-Goose-1119-18、AstV-AH02-Goose-0715-18、AstVHB02-Goose-0310-19)相似性最高均为99.74%,遗传进化树结果显示与安徽(GD AHAU2、AHAU3、AHAU5)株、黑龙江AstV-Goose-2018-HLJ01株和河南(AstV-HN02-Goose-1119-18、AstV-AH02-Goose-0715-18、AstV-HB02-Goose-0310-19、AstV-HN03-Goose-0402-19)株在同一进化分支上,与2014年北京HN1G株亲缘关系较远,表明当前流行的新型鹅星状病毒已发生变异。
鉴于该病为新发病,目前对该病的流行病学及致病机制等研究尚未深入,同时疫苗研制仍处于实验室阶段,尚未有商品化疫苗可进行预防。因此,加快疫苗研制和致病机制的研究对于该病的科学防控具有重要的作用。本研究为我省在新型鹅星状病毒相关工作积累了研究素材,并提供了理论依据。

