西伯利亚鲟AdipoR克隆、组织分布及其对禁食的响应
唐 妮 田正志 李 娅 汪 斌 徐少奇 王 美 陈 虎 齐锦雯 王书瑶 赵柳兰 陈德芳 李志琼
(四川农业大学动物科技学院, 成都 611130)
脂联素(Adiponectin, AdipoQ)作为脂肪细胞因子之一, 能通过结合其受体发挥多种生物学功能,如调节摄食[1]、繁殖[2]、免疫[3,4]和糖脂代谢[5]等。2003年Yamauchi等[6]从人类(Homo sapiens)和小鼠(Mus musculus)上克隆得到AdipoR1和AdipoR2, 其包含7次跨膜结构域, 与G蛋白偶联受体相反, N端在细胞内而C端在胞外。此后, 学者从哺乳动物(猪[7]、山羊[8])和鸟类(鸡[9]、鹅[10])等克隆获得AdipoR基因。然而, 关于鱼类脂联素受体的报道相对较少。目前, 仅从部分硬骨鱼中克隆获得该基因,如斑马鱼(Brachydanio rerio var)[11]、虹鳟(Oncorhynchus mykiss)[12]、斜带石斑鱼(Epinephelus coioides)[13]、大菱鲆(Scophthalmus maximus)[14]、草鱼(Ctenopharyngodon idellus)[15]、青鱼(Mylopharyngodon piceus)[16]和尼罗罗非鱼(Oreochromis niloticus)[17]。此外, 在斑马鱼、虹鳟和斜带石斑鱼上, 脂联素受体的表达受禁食的影响[11—13], 提示AdipoR可能参与调节机体维持能量稳态的过程。
西伯利亚鲟(Acipenser baeri), 属于辐鳍鱼纲,鲟形目, 鲟科, 鲟属, 作为一种亚冷水性鱼类, 在全世界被广泛养殖。西伯利亚鲟是一种古老的鱼类,极具营养价值和学术研究价值。迄今为止, 尚未见西伯利亚鲟脂联素受体基因的相关报道。本文通过克隆和RACE扩增技术获得西伯利亚鲟2种脂联素受体基因的序列, 通过实时荧光定量聚合酶链反应(Real time quantitative PCR, RT-qPCR)检测AdipoR1和AdipoR2基因在组织中的表达情况, 及禁食复投喂对2种基因在肌肉中表达量的影响。
1 材料与方法
1.1 实验材料
实验鱼本研究所用西伯利亚鲟幼鱼购于四川润兆鲟鱼有限公司, 饲养于四川农业大学水产系。饲养条件为12h∶12h光暗周期, 室温控制在(20±1)℃。在暂养期间, 每天14:00按体重3%的比例饲喂1次, 每天换水2次(8:00和20:00)。饲料为鲟商业沉性颗粒饲料。
主要试剂和仪器总RNA提取试剂盒购于成都福际有限公司, 反转录试剂盒、SYBR荧光定量MIX和pMD19-T载体购于大连宝生物有限公司TaKaRa, DH5α感受态细胞和DNA片段胶回收试剂盒购于TIANGEN, RACE试剂盒购于Clontech公司。荧光定量仪为Bio-rad CFX96, 核酸蛋白仪购于Thermo公司。
1.2 RNA提取及cDNA第一链合成
按照TaKaRa RNAiso Plus Reagent说明书, 提取西伯利亚鲟组织的总RNA。用核酸测定仪和1.0%琼脂糖凝胶电泳进行RNA的浓度和完整性检测。实时荧光定量PCR模版在cDNA合成前通过PrimeScript™ RT reagent Kit(Perfect Real Time)去除基因组DNA污染, 根据TaKaRa试剂盒进行荧光定量cDNA合成。采用Clontech公司的SMART RACE cDNA构建试剂盒制备5′-RACE和3′-RACE -Ready cDNA。
1.3 基因克隆
参考GenBank公布的AdipoR1和AdipoR2的核苷酸序列, 利用DNAMAN进行序列比对获得同源片段。通过Primer 5.0软件进行引物设计, 包括克隆目的基因核心片段、3′RACE和5′RACE引物(表 1),由生工生物工程有限公司合成引物。
以西伯利亚鲟脑cDNA为模板, 进行PCR扩增。PCR扩增体系为10 μL, 包括: 5 μL PCR Master Mix、1 μL cDNA模板、上下游引物各0.5和3 μL ddH2O。PCR反应程序为: 94℃预变性5min; 94℃变性30s, 55℃退火45s, 72℃延伸1min, 35个循环;72℃延伸7min。PCR产物经1.5%浓度的琼脂糖凝胶电泳分析, 利用TIANGEN Midi DNA Purification Kit切胶回收目的条带, 与pMD19-T载体于4℃过夜连接, 转化入DH5α感受态细胞, 菌液PCR筛选含目的片段菌液, 送生工生物工程有限公司进行测序。
根据得到的核心片段和接头应物设计的特异性引物, 用SMART RACE cDNA试剂盒进行5′端和3′端的RACE全长的克隆。两轮PCR反应程序为:94℃预变性5min; 94℃变性30s, 退火45s, 72℃延伸1min, 34个循环; 72℃延伸5min; 克隆后结果送于生工公司进行测序。AdipoR1基因特异性退火温度58.4℃,AdipoR2基因特异性退火温度63.6℃。最后,将克隆所得目的基因核心序列与3′端和5′端序列进行拼接, 获得目的基因cDNA序列全长。

表 1 引物序列及用途Tab. 1 Primers used for the study
1.4 生物信息学分析
将测序所得的AdipoR1和AdipoR2 cDNA序列在NCBI上选择BLAST工具(http://blast.ncbi. nlm.nih.gov/Blast.cgi)进行同源比对, 用DNAStar查找ORF, 推导出氨基酸序列, 利用ClustalW(http://www.ddbj.nig.ac.jp/search/clustalw-e.html)进行多重序列比对, 采用SignalIP 4.1 server(http://www. cbs.dtu.dk/services/SignalP/)进行信号肽预测, 通过在线软件TM-HMMServer v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行氨基酸序列的跨膜区预测, 采用MEGA 5软件, 用邻接法构建系统进化树。
1.5 组织分布实验
选取6尾西伯利亚鲟(215.20±29.00) g禁食24h后, 通过MS-222麻醉后处死, 快速分离获得22个组织, 包括5个不同脑区(前脑、中脑、下丘脑、小脑和延脑), 及17个外周组织(心、眼、食道、肌肉、胰、鳃、性腺、皮肤、瓣肠、直肠、鳔、肾、脾、十二指肠、幽门盲囊、肝和胃)。提取RNA并反转录成cDNA作为模板, 通过实时荧光定量PCR测定AdipoR1及AdipoR2基因在各组织中的表达情况。
1.6 禁食复投喂实验
将27尾(29.45±2.84) g健康的西伯利亚鲟, 均匀放入9个鱼缸, 每缸3尾鱼。正式试验前进行驯化,每天14:00投喂按体重3%进行投喂, 驯化2周后开始正式试验。将其分为3组, 即投喂组、禁食组和复投喂组。其中, 复投喂组在禁食第10天进行复投喂。在第10天采集样品, 采样时间为14:30(即投喂后30min)。每组从对应的3个缸中分别捞取2尾鱼,即每组6尾, 麻醉后处死, 采集背部白肌, 用于后续基因表达分析。
1.7 实时荧光定量PCR
通过Bio-Rad系统进行荧光定量分析。通过退火温度摸索和标准曲线绘制, 分析融解曲线筛选获得适宜的荧光定量引物(表 1)。AdipoR1和AdipoR2荧光定量引物扩增效率分别为95.7%和98.2%。反应体系为25 μL, 操作按照TaKaRa公司的荧光定量试剂盒(SYBR®Premix ExTaqTMⅡ)说明书进行。反应程序为: 95℃预变性1min; 95℃变性15s, 58.4℃退火15s, 72℃延伸45s, 44个循环。每个实验样品重复3次。以β-actin作为内参基因, 采用2-△△Ct法计算AdipoR1和AdipoR2相对表达量, ΔΔCt=(Ct目的基因–Ct内参基因)–(Ct目标基因参照–Ct内参基因参照)。
1.8 数据分析
所有数据表示为平均数±标准误(Mean±SEM),通过SPSS 20.0进行单因素方差分析, 运用Duncan进行多重比较,P<0.05表示差异显著。
2 结果
2.1 AdipoR1和AdipoR2结构分析
本研究通过RT-PCR和RACE方法克隆获得了西伯利亚鲟AdipoR1(GenBank登录号: MT580287)和AdipoR2(GenBank登录号: MT580342)基因cDNA的完整序列。西鲟AdipoR1基因cDNA全长为2013 bp, 包括5′-UTR(234 bp)、3′-UTR(633 bp)和开放式阅读框ORF(1146 bp), 编码381个氨基酸。西伯利亚鲟AdipoR2 cDNA全长为1590 bp, 包括329 bp的5′-UTR, 175 bp的3′-UTR和1086 bp的完整ORF,其编码361个氨基酸。西伯利亚鲟AdipoR1和AdipoR2蛋白主要由N端胞内结构域、HlyIII结构域和C端胞外区域(359—381aa)组成。跨膜区域预测结果显示, 西伯利亚鲟AdipoR1和AdipoR2均包含7个跨膜结构域, N端在细胞膜内, C端在细胞膜外, 与G蛋白耦联受体的拓扑结构相反。
2.2 序列比对和系统进化分析
氨基酸序列比对结果显示, 西伯利亚鲟AdipoR1与其他脊椎动物氨基酸序列一致性较高,如人类(81%)、苏门答腊猩猩(Pongo abelii, 81%)、小鼠(82%)、原鸡(Gallus gallus, 81%)、吐绶鸡(Numida meleagris, 81%)、非洲爪蟾(Xenopus tropicalis, 80%)、高山倭蛙(Nanorana parkeri, 81%)、斑马鱼AdipoR1-A(82%)和AdipoR1-B(76%)、虹鳟(80%)和大菱鲆(87%)。此外, 西伯利亚鲟AdipoR2氨基酸一致性与斑点雀鳝最高为85%, 与哺乳动物、鸟类和两栖类的一致性介于76%—78%, 与鱼类相比氨基酸一致性介于79%—81%。
聚类分析结果显示, 西伯利亚鲟AdipoR1、AdipoR2均与其他硬骨鱼类聚为一支, 而哺乳动物(人类、猩猩和小鼠)、鸟类(原鸡和吐绶鸡)、两栖类(非洲爪蟾和高山倭蛙)聚为另一支(图 1)。此外,遗传距离分析结果显示, 西伯利亚鲟AdipoR1与斑点雀鳝(Lepisosteus oculatus, 0.1226)距离最近, 与斑马鱼AdipoR1-B(0.2307)距离最远。西鲟AdipoR2与斑点雀鳝(0.1518)距离最近, 与高山倭蛙(0.2649)距离最远。
2.3 组织分布
AdipoR1和AdipoR2广泛分布于西伯利亚鲟中枢和外周组织(图 2)。其中,AdipoR1表达量最高的是中脑, 延脑、前脑、小脑和下丘脑次之, 肌肉中的表达量较低。西伯利亚鲟AdipoR2 mRNA在中脑表达最高, 鳃、瓣肠、性腺和延脑次之, 肌肉表达最低。
2.4 禁食和复投喂对肌肉中脂联素受体表达的影响
在禁食10d后, 西伯利亚鲟肌肉AdipoR1表达量显著上调, 复投喂后AdipoR1表达显著降低。在禁食10d时, 肌肉AdipoR2表达量显著升高, 而复投喂后AdipoR2 mRNA表达无显著变化(图 3)。
3 讨论
目前, 学者已从人和小鼠等哺乳动物、鸟类和硬骨鱼上克隆获得脂联素受体基因。其中, 在鱼类上的报道仅见斑马鱼[11]、虹鳟[12]、斜带石斑鱼[13]、大菱鲆[14]、草鱼[15]、青鱼[16]和尼罗罗非鱼[17]。本研究通过克隆获得2种西伯利亚鲟脂联素受体, 即AdipoR1和AdipoR2。与本研究类似, 虹鳟、斜带石斑鱼、大菱鲆和尼罗罗非鱼AdipoR1仅鉴定出一种类型。然而, 同属于鲤形目的斑马鱼、草鱼和青鱼存在AdipoR1-A和AdipoR1-B。由上可知, 鱼类AdipoR1可能具有更多的亚型。与其他脊椎物种类似, 西伯利亚鲟AdipoR1和AdipoR2主要由N端结构域、HlyIII结构域和C端结构域组成, 并且N端在胞内, C端在胞外。多重序列比对结果显示鱼类AdipoR的N段结构域氨基酸一致性较低, 提示该区域保守性较低。
在西伯利亚鲟上,AdipoR1和AdipoR2广泛分布于中枢和外周组织中。在大鼠、猪、鸡和其他硬骨鱼上也观察到类似的结果。脂联素受体AdipoR1和AdipoR2 mRNA分布的广泛性, 提示其可能在不同组织中参与调节不同的生理活动。此外, 本研究发现AdipoR1和AdipoR2在西伯利亚鲟组织中的表达模式存在差异。例如, 西伯利亚鲟AdipoR1主要在大脑各区域中表达且高于外周组织,AdipoR2 mRNA主要在中脑表达, 鳃和瓣肠次之。与之类似,免疫组化检测结果显示, 在大鼠上,AdipoR1在大脑各区域广泛分布,AdipoR2则在特定的脑区中表达,如下丘脑、大脑皮层和海马体[18]。然而, 在斑马鱼上,AdipoR1-A、AdipoR1-B和AdipoR2广泛分布于脑、肠、肝、脂肪组织、肾和卵巢中, 并且3个受体基因组织表达模式类似。本研究结果显示,AdipoR1和AdipoR2 mRNA均在西伯利亚鲟中脑表达最高。尽管目前关于鲟鱼中脑的功能研究较少,斑马鱼上的研究显示中脑能整合多种感觉, 与感光、游泳和捕食等反应密切相关[19]。因此, 我们推测AdipoR可能与这些功能密相关, 但有待进一步探究。此外, 其他物种上的研究显示AdipoR1和AdipoR2高表达的组织存在差异。例如, 在猪和鸡上,AdipoR1 mRNA骨骼肌表达丰富,AdipoR2 mRNA在脂肪组织中高表达[9]。然而, 在硬骨鱼上,AdipoR1和AdipoR2高表达的组织差异较大。例如,AdipoR1 mRNA在虹鳟脾脏[12]、斜带石斑鱼端脑[13]、草鱼和青鱼肝脏[15,16]和大菱鲆的鳃组织中[20]丰富表达。AdipoR2 mRNA表达量在虹鳟近侧小肠、斜带石斑鱼性腺和大菱鲆肠道中较高。此外, 西伯利亚鲟AdipoR1和AdipoR2在肌肉中表达较低。与本研究类似,AdipoR1在虹鳟、斜带石斑鱼、大菱鲆和尼罗罗非鱼白肌中表达较低,AdipoR2在大菱鲆和雌性尼罗罗非鱼肌肉中表达也是最低[17]。以上研究结果显示, 哺乳动物AdipoR1可能主要参与肌肉能量代谢过程, 而鱼类AdipoR1可能具有独特的生物学作用。总的来说,AdipoR1和AdipoR2基因广泛分布于多组织中, 提示其可能具有多种生物学功能, 并且其生物学功能存在物种差异。
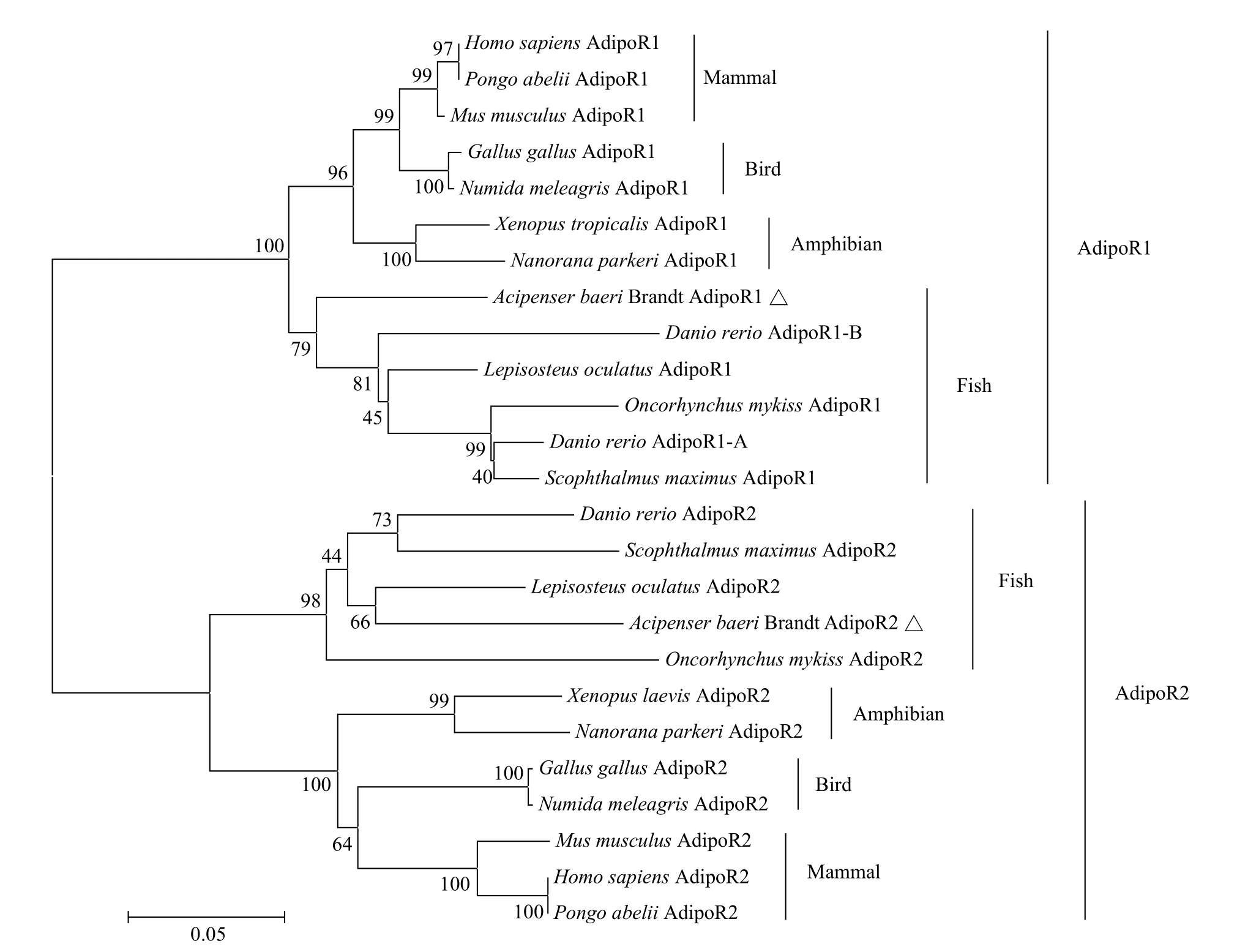
图 1 AdipoR1和AdipoR2氨基酸序列系统进化树Fig. 1 Phylogenetic tree of amino acid sequences of AdipoR1 and AdipoR2

图 2 西伯利亚鲟AdipoR1(A)和AdipoR2(B)组织分布Fig. 2 Tissue distribution of AdipoR1 (A) and AdipoR2 (B) in Siberian sturgeon

图 3 禁食对西伯利亚鲟肌肉AdipoR1和AdipoR2 mRNA表达量的影响Fig. 3 Effect of fasting and refeeding on the expression of AdipoR1 and AdipoR2 mRNA in muscle of Siberian sturgeon
肌肉是鱼类受饥饿影响较大的组织之一。在禁食期间, 肌肉不仅能短期通过肌糖原供能, 还能通过脂质和蛋白分解提供主要的能量[21]。在西伯利亚鲟幼鱼中, 禁食10d后肌肉中AdipoR1和AdipoR2 mRNA表达量均显著升高, 在复投喂后AdipoR1表达量显著降低, 而AdipoR2 mRNA表达量无显著变化。在鱼类中, 有研究显示饥饿能影响脂联素受体基因的表达。与本研究结果类似, 当禁食25d或35d,虹鳟白肌AdipoR1和AdipoR2表达显著升高[12]。在斜带石斑鱼中, 禁食7d显著上调了肌肉中AdipoR1和AdipoR2表达量, 复投喂后降低[13]。在饥饿期间,适应生理调节会影响鱼类肌肉等组织并且快速引发糖、脂和蛋白代谢来维持能量稳态。之前的研究显示, 禁食10d后纳氏鲟和虹鳟白肌中的糖原、蛋白质和脂质含量均显著降低[22]。由上可知, 鱼类AdipoR1和AdipoR2可能在白肌能量代谢调节中发挥重要作用。此外, 在小鼠中, 禁食2d能显著上调肌肉AdipoR1和AdipoR2表达, 复投喂后其表达量显著降低[23]。然而, 在幼猪中, 禁食1d不影响肌肉中AdipoR1和AdipoR2表达的变化[24]。这种差异可能与研究的物种及禁食的时间长短等因素有关。总的来说, 在西伯利亚鲟肌肉中, 脂联素受体的表达受禁食的调节, 并且这种作用在鱼类上相对保守, 提示脂联素受体基因可能参与机体能量稳态维持过程。
总的来说, 本研究克隆获得了西伯利亚鲟AdipoR1和AdipoR2的cDNA全长序列, 并进行了相关生物信息学分析。本研究通过分析西伯利亚鲟AdipoR1和AdipoR2 mRNA组织分布情况, 并且发现AdipoR1和AdipoR2广泛分布于西伯利亚鲟组织中。此外, 本研究发现禁食能显著上调肌肉AdipoR1和AdipoR2 mRNA表达, 提示AdipoR1及AdipoR2可能参与脂联素能量代谢的调节。本研究为后续深入开展脂联素及其受体在西伯利亚鲟能量代谢和能量稳态调节的作用提供了理论基础。

