lncRNA TDRG1通过调节miR-101-3p促进结直肠癌细胞增殖、侵袭和迁移*
王帅奇,孙 浩,张寿儒,陈利辉,陈秀峰,李 卫
(重庆大学附属肿瘤医院胃肠肿瘤中心,重庆400030)
结直肠癌(colorectal cancer,CRC)是全球发病率最高的肿瘤之一,每年有近160万例新发CRC病例[1]。CRC的存活率约为58%,并且一旦CRC进入晚期,手术切除是无用的,患者的预后极差[2]。尽管一些研究已经确定了许多与肿瘤发生有关的基因,但这些过程的分子机制尚不清楚[3-4]。因此,迫切需要进一步研究CRC发生发展的机制,寻找具有预后和治疗价值的新的治疗靶点。越来越多的研究表明,长链非编码RNA(long noncoding RNA,lncRNA)在肿瘤的发展过程中起着关键作用,包括细胞增殖、细胞周期和转移[5-6]。最近的报告发现一些lncRNA在CRC的发展中起作用[7]。睾丸发育相关基因1(testicular development-related gene 1,TDRG1)是一种新发现的lncRNA,在多种肿瘤包括肺腺癌、甲状腺乳头状癌、宫颈癌和食管鳞状细胞癌中起原癌基因的作用[8-9]。然而,TDRG1在CRC中的作用尚未阐明。在本研究中,我们检测了CRC组织和正常组织中TDRG1的表达,并通过构建敲减TDRG1表达的CRC细胞模型,揭示TDRG1调节CRC细胞增殖、侵袭和迁移的机制。
材料和方法
1 临床组织标本
于2016年5月~2018年8月,在重庆大学附属肿瘤医院共收集40对CRC组织及相应的癌旁组织。标本冷冻保存在-80℃。
2 方法
2.1 细胞培养人正常结肠上皮NCM460细胞及CRC细胞系HT-29、SW480和LoVo购自ATCC。细胞培养在含10%胎牛血清(FBS)和1%青霉素/链霉素的McCoy′s 5A和高糖DMEM培养基(Gibco)中。
2.2 细胞转染由上海吉凯基因化学技术有限公司合成了抗TDRG1(sh-TDRG1)和非靶向对照(sh-NC)的慢病毒短发夹RNA(shRNA),miR-101-3p模拟物(pre-miR-101-3p)和miR-101-3p阻遏物(antimiR-101-3p)及其各自的非靶向序列(pre-NC或anti-NC)。使用Lipofectamine 3000试剂(Life Technologies)转染细胞。通过qPCR检测细胞过度表达和沉默的效率。
2.3 RT-qPCR实验使用Trizol试剂(Invitrogen)从细胞或组织中分离总RNA,并使用PrimeScript RT试剂盒(TaKaRa)将RNA反向转录成cDNA。RT-qPCR分析采用SYBR Green PCR试剂盒(TaKaRa)进行。U6用于标准化miR-101-3p的相对表达,和β-actin用于标准化TDRG1的相对表达。采用2-ΔΔCt法计算相对表达。TDRG1的正向引物序列为5′-CGGGAACAAGCCCTGTG-3′,反 向 引 物 序 列 为5′-CCGGCCCAAAGATGATG-3′;miR-101-3p的正向引物序列为5′-TGCACCTAAAAGGAG-3′,反向引物序列为5′-GTGCAGGGTCCGAGGT-3′;U6的正向引物序列为5′-CTCGCTTCGGCAGCACA-3′,反向引物序列为5′-AACGCTTCACGAATTTGCGT-3′;β-actin的正向引物序列为5′-CTCCATCCTGGCCTCGCTGT-3′,反向引物序列为5′-GCTGTCACCTTCACCGTTCC-3′。
2.4 CCK-8法检测细胞活力细胞以每孔2.5×103个细胞的密度接种于96孔板中,培养24、48、72和96 h后,在每个孔中加入10μL CCK-8分析剂(Dojindo)。继续培养2 h后,以0.1%的最终浓度加入DMSO,使用酶标仪在450 nm处检测溶液的吸光度(A)值。
2.5 集落形成实验将细胞以每孔1×103接种在6孔板中,并加入含10%FBS的DMEM培养基。转染2周后,用甲醇固定细胞,用0.1%结晶紫(Sigma)染色。在显微镜下计算可见集落数。
2.6 Transwell测定在迁移实验中,将细胞以每孔1×105的密度接种到24孔Transwell小室中,在上腔室中加入无血清培养基,在下腔室中加入完全培养基。孵育24 h后,将细胞用含有0.1%结晶紫的染料溶液染色。之后,使用显微镜拍摄照片,并从6个视野中随机计数细胞。对于侵袭实验,使用预先涂有BD BioCoat Matrigel的Transwell室(BD Biosciences)检测细胞侵袭能力,其余步骤与细胞迁移测试相同。
2.7 双萤光素酶报告基因检测通过双重萤光素酶报告基因确认TDRG1和miR-101-3p之间关系。用PCR扩增含有预测miR-101-3p结合位点的TDRG1片段,克隆到含有萤光素酶的报告载体中来构建TDRG1野生型(TDRG1-WT)。为了使预测的miR-101-3p结合位点在TDRG1内发生突变,将假定的结合位点序列替换为TDRG1突变型(TDRG1-Mut)。用Lipofectamine 3000将载体和pre-miR-101-3p共转染HEK 293T细胞。48 h后,通过细胞裂解提取样品以检测萤光素酶活性。
3 统计学处理
使用SPSS17.0进行分析。所有数据均以均数±标准差(mean±SD)表示,两组之间的差异通过Student′st检验进行了分析,多组间比较采用单因素方差分析以及Bonferroni事后检验。以P<0.05为差异具有统计学意义。
结 果
1 TDRG1在人CRC组织中的表达情况
应用RT-qPCR检测CRC组织中TDRG1的表达水平。如图1所示,与匹配的癌旁组织相比,在CRC组织中观察到TDRG1的表达水平显著增加(P<0.01),见图1A。此外,我们检测了TDRG1在CRC细胞系中的表达,结果表明,与正常细胞NCM460相比,TDRG1在CRC细胞系HT-29、SW480和LoVo中明显上调(P<0.05或P<0.01),见图1B。TDRG1表达与肿瘤病理参数的关系分析显示,TDRG1表达与CRC的肿瘤深度、淋巴结转移及肿瘤大小呈正相关(P<0.05),见表1。
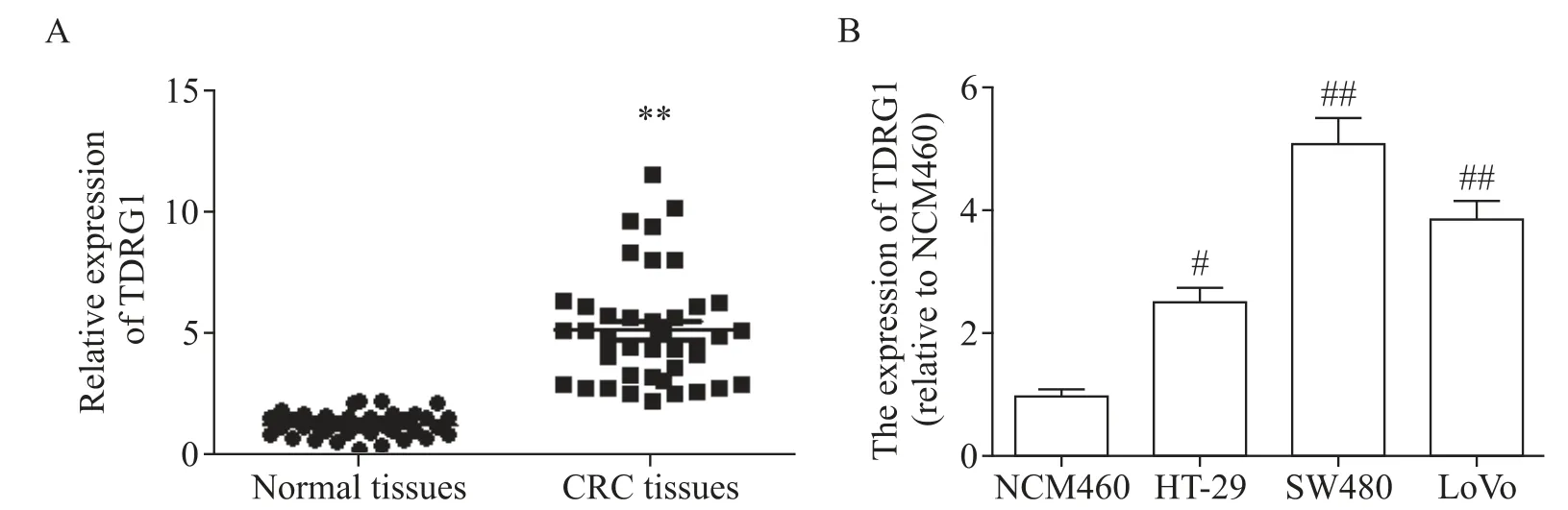
Figure 1.TDRG1 was highly expressed in CRCtissues and cells.A:the expression of TDRG1 was analyzed by RT-qPCR(n=40);B:the relative expression of TDRG1 in 3 colorectal cancer cell lines and normal NCM460 cells was analyzed by RT-qPCR(n=3).Mean±SD.**P<0.01 vs normal tissues;#P<0.05,##P<0.01 vs NCM460 group.图1 TDRG1在CRC组织和细胞中高表达
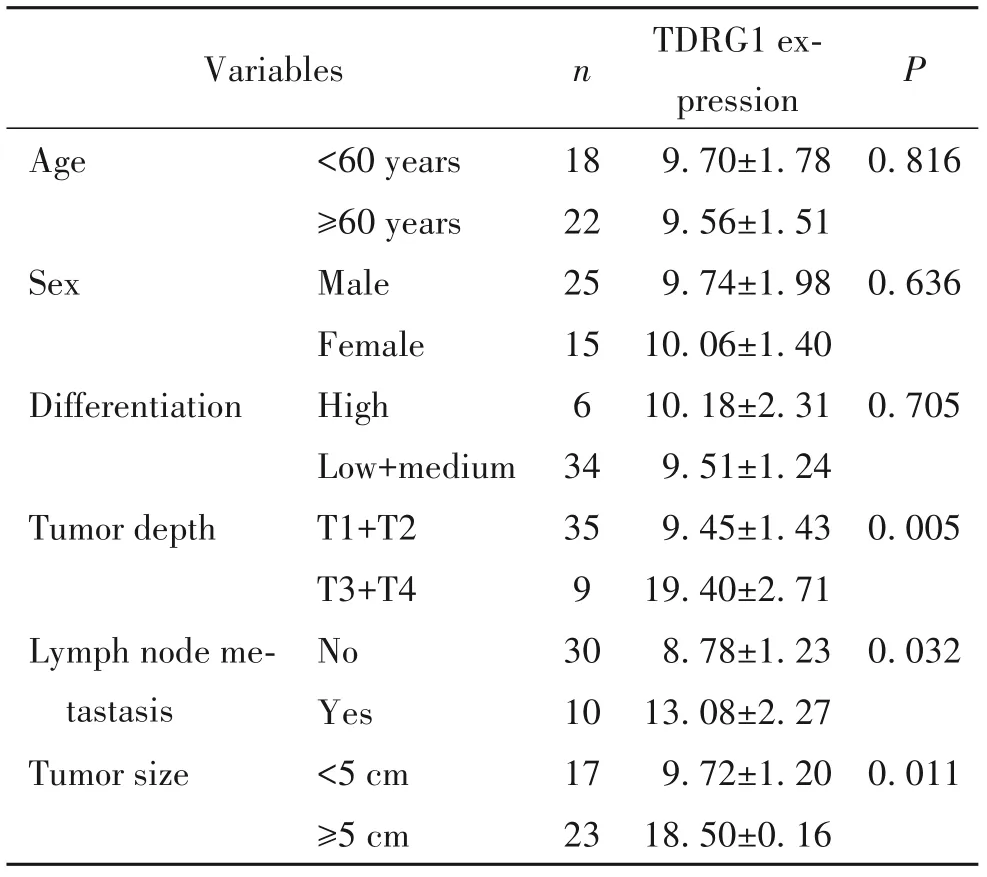
表1 TDRG1表达与肿瘤病理参数的关系Table 1.Relationship between TDRG1 expression and tumor pathological parameters
2 敲减TDRG1基因的表达对SW480细胞增殖及侵袭和转移能力的影响
为了探讨TDRG1在CRC进展中的作用,用敲减SW480细胞株中TDRG1表达(图2A)的方法检测细胞增殖及侵袭能力。如图2B、C所示,敲减TDRG1基因的表达抑制了SW480细胞的活力和集落形成能力(P<0.01)。此外,sh-TDRG1转染可观察到迁移和侵袭细胞数量显著减少(P<0.01),见图2D。
3 miR-101-3p是TDRG1的直接靶点
越来越多的证据表明,lncRNA可作为相应miRNA的ceRNA[10]。因此,利用生物信息学数据库Starbase 2.0预测miR-101-3p作为TDRG1的靶点(图3A),并通过双萤光素酶报告基因实验验证了二者关系(图3B)。随后,RT-qPCR分析显示,敲减TDRG1的表达上调了SW480细胞中miR-101-3p的水平(图3C)。此外,与正常组织相比,在CRC肿瘤组织中观察到miR-101-3p低表达水平(P<0.05),见图3D。Pearson相关分析显示TDRG1与miR-101-3p呈负相关(R2=0.389,P<0.01),见图3E。
4 TDRG1通过miR-101-3p调节CRC的进展
为了进一步探讨miR-101-3p是否参与TDRG1相关的CRC进展,使用miR-101-3p抑制剂转染到SW480细胞。图4A显示miR-101-3p抑制剂的显著抑制效率。CCK-8和集落形成实验的结果表明,miR-101-3p抑制剂减轻了敲减TDRG1表达导致的细胞活力和集落形成能力的降低(图4B、C)。此外,Transwell实验表明miR-101-3p抑制剂也减轻了敲减TDRG1表达引起的细胞侵袭能力的降低(图4D)。
讨 论
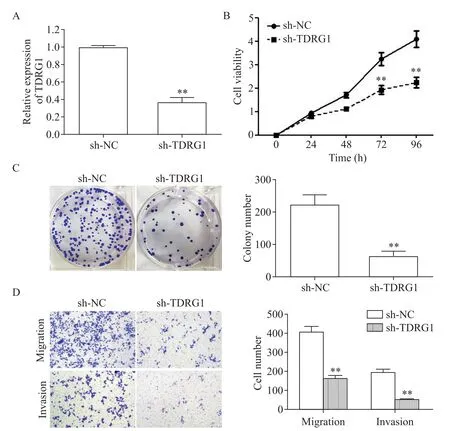
Figure 2.Knock-down of TDRG1 expression inhibited the proliferation,migration and invasion abilities of SW480 cells.A:knockdown efficiency of sh-TDRG1 transfection in SW480 cells;B and C:the proliferation of SW480 cells was detected by CCK-8 assay and colony formation assay;D:Transwell assay was used to detect the migration and invasion abilities of the cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs sh-NCgroup.图2 敲减TDRG1基因的表达抑制SW480细胞的增殖、迁移和侵袭能力
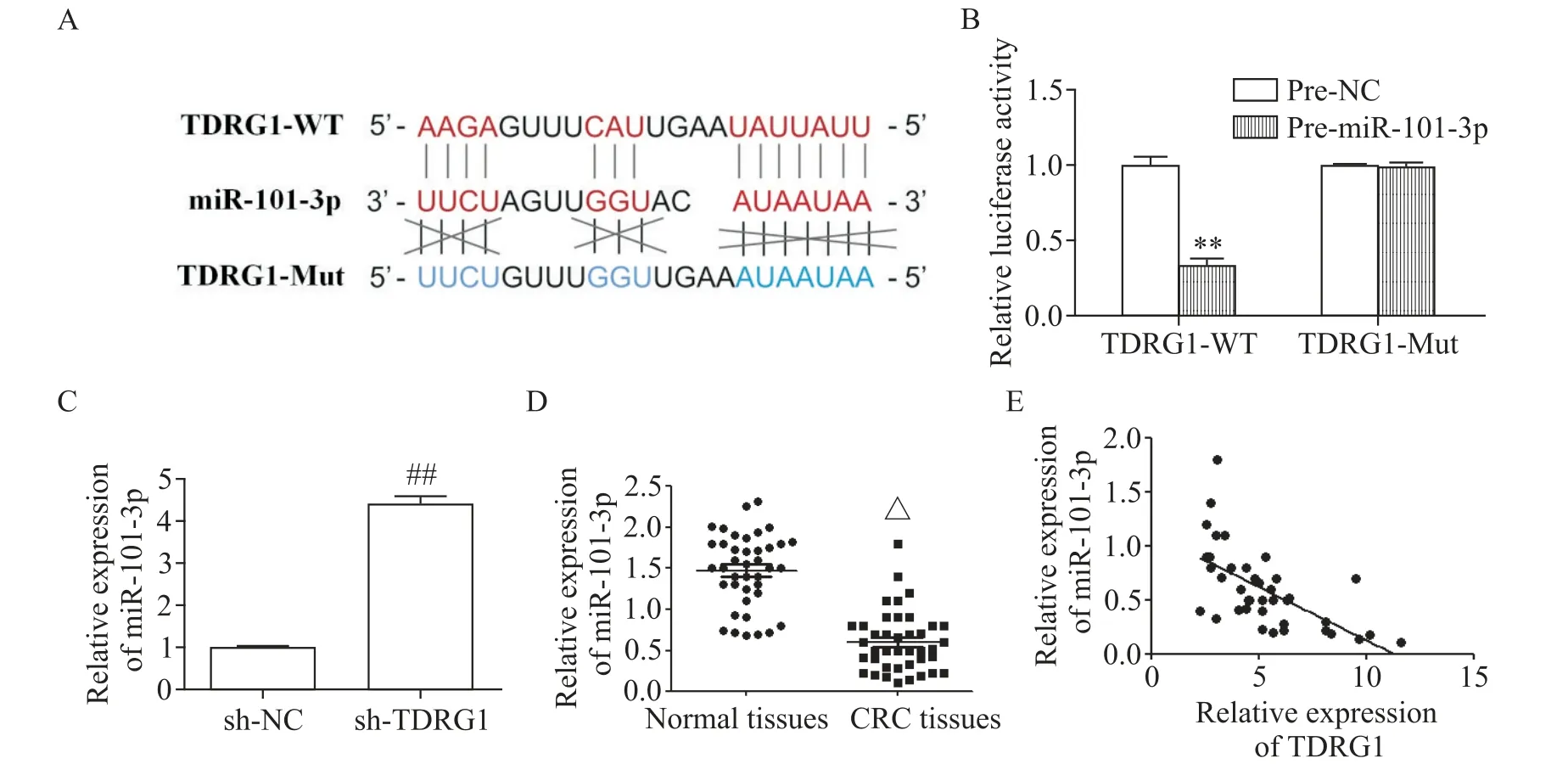
Figure 3.miR-101-3p was the direct target of TDRG1.A:the binding site between TDRG1 and miR-101-3p was predicted by Starbase 2.0;B:luciferase reporter assay confirmed the interaction between TDRG1 and miR-101-3p in HEK-293T cells;C:knock-down of TDRG1 expression promoted the expression of miR-101-3p in SW480 cells;D:the expression of miR-101-3p in tumor tissues was lower than that in normal tissues;E:there was a negative correlation between miR-101-3p and TDRG1 in CRCtissues.Mean±SD.n=3.**P<0.01 vs pre-NCcells;##P<0.01 vs sh-NCgroup;△P<0.01 vs normal tissues.图3 miR-101-3p是TDRG1的直接靶点
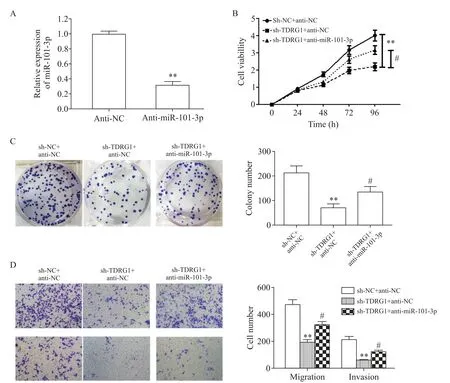
Figure 4.miR-101-3p mediated TDRG1 to regulate the occurrence and development of CRC.A:the knock-down efficiency of miR-101-3p in SW480 cell line was detected by RT-qPCR;Band C:the proliferation of SW480 cells was detected by CCK-8 assay and colony formation assay after transfection;D:the migration and invasion abilities of the cells were detected by Transwell assay.Mean±SD.n=3.**P<0.01 vs sh-NC+anti-NCgroup;#P<0.05 vs sh-TDRG1+anti-NCgroup.图4 miR-101-3p介导TDRG1调控CRC的发生发展
CRC是第4大肿瘤相关死亡原因[10]。越来越多的证据表明,lncRNA在肿瘤进展中起重要作用,并且在CRC中发现了lncRNA的异常表达[11-12]。因此,需要明确lncRNA在CRC发生发展中的确切作用,以期在CRC治疗中寻找新的诊断生物标志物。TDRG1是一种新的lncRNA,在多种人类肿瘤中起致癌作用。最近已证实TDRG1通过调节miR-326/丝裂原激活的蛋白激酶1或miR-214-5p/SOX4促进宫颈癌细胞的生长、迁移和侵袭[8-9]。在NSCLC中,TDRG1通过调节miR3/ZEB1轴促进NSCLC细胞转移[13]。因此,在几种恶性肿瘤中,TDRG1被认为是有效的癌基因。然而,TDRG1在CRC中的作用尚未被探讨。在本研究中,我们首先确定TDRG1在CRC中是起促进癌症的lncRNA,并证明TDRG1在人CRC组织中被过度调节,其与CRC的肿瘤深度、淋巴结转移及肿瘤大小相关;其次,我们进行了功能丧失实验,以探讨TDRG1对CRC细胞恶性特征的影响。结果表明,敲减TDRG1的表达可抑制体外CRC细胞的增殖和侵袭,提示TDRG1可能作为CRC治疗的生物标志物。
先前的研究已经证明,lncRNA通过与miRNA竞争性结合而充当ceRNA来调节癌症相关基因的表达[14]。我们使用了生物信息学数据库(StarBase 2.0)分析确定了miR-101-3p可能与TDRG1相互作用,并通过随后的萤光素酶实验证实了这一点。miR-101-3p被报道为不同肿瘤中的肿瘤抑制miRNA,如乳腺癌、视网膜母细胞瘤、骨肉瘤、卵巢癌和肝细胞癌[15-16]。值得注意的是,Jin等[17]发现miR-101-3p在CRC组织中下调,miR-101-3p的表达增加抑制了CRC细胞增殖、迁移和侵袭。在这项研究中,我们在CRC肿瘤组织中观察到miR-101-3p低表达水平,并且Pearson相关分析显示TDRG1与miR-101-3p呈负相关。此外,转染miR-101-3p抑制剂部分减轻了敲减TDRG1表达引起的细胞增殖、迁移和侵袭能力的降低。总而言之,本研究发现的miR-101-3p在CRC进展中的表达模式和抑癌作用的研究结果与Jin等[17]的结果一致。因此,靶向TDRG1/miR-101-3p可能是治疗CRC的一种新途径。
综上所述,本研究证明TDRG1是CRC中的一个癌基因,并且与CRC的进展密切相关。敲减TDRG1的表达联合miR-101-3p过表达在体外具有抑瘤作用,且两者之间存在负相关。TDRG1/miR-101-3p可能在人CRC中发挥重要作用,为CRC的治疗提供了一个有前途的靶点。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

