基于气相色谱-质谱联用结合网络药理学探究竹叶椒挥发油抗炎镇痛的作用机制
龚普阳,潘烨华,郭瑜婕,哈立洋,李晓朋,顾 健*
1.西南民族大学药学院,四川 成都 610041
2.湖北中医药大学药学院,湖北 武汉 430000
竹叶椒为芸香科植物竹叶椒Zanthoxylum armatumDC.的果实,具有温中燥湿、散寒止痛的功效,用于治疗脘腹冷痛、寒湿吐泻、蛔厥腹痛、龋齿牙痛等症[1-2]。以其生药材为主要原料制备而成的竹叶椒片临床常用于治疗急性阑尾炎、腹痛及胃痛,疗效显著[3]。竹叶椒传统功效与现代临床研究均表明其具有抗炎、镇痛作用。挥发油是竹叶椒的主要活性组分之一,包含烯烃、烷烃、醇类、酯类等多种成分。现代药理学研究表明,竹叶椒挥发油能够显著抑制脂多糖(lipopolysaccharide,LPS)诱导的小鼠单核巨噬细胞RAW264.7 中一氧化氮合酶(nitric oxide synthase,NOS)、环氧合酶 2(cyclooxygenase-2,COX-2)和白细胞介素-1β(interleukin-1β,IL-1β)的表达[4]。网络药理学是系统生物信息学研究的重要工具,利用网络可视化方法分析疾病与药物及靶点间复杂的相互作用关系,具有整体性和系统性特点,目前已广泛用于预测中药调控机体生物网络的作用机制[5]。本研究整合气相色谱-质谱联用(GC-MS)分析与生物信息学技术,探究竹叶椒挥发油主要活性成分的作用靶点及信号通路,预测竹叶椒挥发油多成分、多层次、多途径的抗炎、镇痛潜在作用机制,为竹叶椒药用价值的深入研究与临床合理使用提供科学依据。
1 材料
1.1 药材
竹叶椒购自四川省洪雅县,经西南民族大学药学院顾健教授鉴定为芸香科花椒属植物竹叶椒Z.armatumDC.的果实。
1.2 试剂
无水硫酸钠(批号20200612)购自天津福晨化学试剂有限公司。
1.3 仪器
QP2010 Ultra GC-MS 仪(日本Shimadzu 公司);DZTW 型电子调温电热套(浙江力凡仪器科技有限公司);JA2003 电子天平(上海舜宇恒平科学仪器有限公司)。
2 方法
2.1 竹叶椒挥发油的GC-MS 分析
2.1.1 竹叶椒挥发油的制备 采用水蒸气蒸馏法提取竹叶椒挥发油,无水硫酸钠脱水,精密吸取1 mL,经0.22 μm 滤膜滤过,得到供GC-MS 分析的挥发油样品。
2.1.2 气相色谱条件 DB-130 毛细管柱(30 m×0.25 mm×0.25 μm);分流比为150∶1;压力为48 kPa;柱箱温度为50 ℃;进样温度为300 ℃;吹扫体积流量为3.0 mL/min;色谱柱初始温度为50 ℃,保持1 min,以5 ℃/min 升温至80 ℃,再以15 ℃/ min 升温至300 ℃,保持20 min;进样量为2 μL;载气为氦气。
2.1.3 质谱条件 电子轰击(EI)离子源;离子源温度为230 ℃;接口温度为300 ℃;溶剂延迟时间为2.00 min;每0.3 秒扫描采集数据,扫描速度为2000,扫描范围为m/z30~550。
2.2 竹叶椒挥发油成分的潜在作用靶点收集
基于GC-MS 获得的竹叶椒挥发油化学成分信息,采用中药系统药理数据库和分析平台(TCMSP)进行成分查询及靶点收集。对于TCMSP 未收录的其他竹叶椒挥发油成分,借助PubChem 数据库(http://pubchem.ncbi.nlm.nih.gov)查询成分相应SMILES 号,进一步采用Swiss Target Prediction 数据库(http://www.swisstarget prediction.ch/)进行靶点预测补充[6]。
2.3 “成分-靶点-疾病”网络构建
在OMIM(http:// www.omim.org/)和GisGeNET(http://www.disgenet.org)数据库中,以“炎性反应”“疼痛”为关键词搜索相关靶点,去除重复和假阳性靶点,构建炎性反应、疼痛靶点数据集[7]。分别构建“成分-靶点”和“疾病-靶点”网络模型,运用Cytoscape 3.7.2 软件将2 个网络合并,去除无关联节点,得到竹叶椒挥发油抗炎、镇痛的活性成分及主要靶点,借助Uniprot(https://www.uniprot.org/)数据库将靶点名称转化为相应基因简称。
2.4 靶点的组织分布网络构建
将获得的靶点导入 BioGPS(http://biogps.org/#goto=welcome)数据库,获得靶点与组织的对应关系,并采用Cytoscape 3.7.2 软件构建“靶点-组织”网络,以基因表达量为指标筛选前10 个靶点主要分布的器官、组织或部位,获得竹叶椒挥发油抗炎、镇痛靶点的组织分布[8]。
2.5 蛋白- 蛋白相互作用( protein-protein interaction,PPI)网络的构建
将“2.3”项下获得的主要靶点输入STRING 在线数据库(https://string-db.org/),设置“Homo sapiens”,获得PPI 关系,结果保存为RTF 格式,将节点及结合作用评分数据导入Cytoscape 3.7.2 软件进行网络构建与分析,筛选核心靶点[9]。
2.6 基因本体论(gene ontology,GO)功能与京都基因及基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将筛选得到的竹叶椒挥发油抗炎、镇痛靶点导入DAVID 数据库(https://david.ncifcrf.gov/home.jsp),设置“Homo sapiens”,进行GO 功能及KEGG通路富集分析[10-11],采用Graphpad Prism 8 软件及在线绘图站Omishare(http://www.omicshare.com/ tools/index.php/)将结果可视化。
2.7 分子对接验证
通过PDB 数据库下载前列腺素内过氧化物合成酶 2(prostaglandin-endoperoxide synthase 2,PTGS2)、毒蕈碱型乙酰胆碱受体亚型3(muscarinic acetylcholine receptor M3,CHRM3)、过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor alpha,PPARA)和大麻素受体2(cannabinoid receptor 2,CNR2)4 个核心靶点蛋白的晶体复合物,借助Discovery Studio 软件进行蛋白修饰,去除其配体与非蛋白分子,以pdb 格式保存,采用Open Bable GUI 软件转为pdbqt 格式。借助PubChem 在线数据库获取主要活性成分的2D 结构,采用Sybyl 软件对各成分进行能量优化。利用AutoDock Vina 软件进行分子对接,以结合能评价竹叶椒挥发油潜在活性成分与4 个靶点蛋白的结合能力[12]。
3 结果
3.1 竹叶椒挥发油化学成分的定性表征
采用GC-MS 法测定竹叶花椒挥发油中的化学成分,总离子流见图1。通过气相色谱-质谱数据库NIST08.LIB 数据匹配,结合文献资料解析,鉴定出竹叶椒挥发油化学成分44 个,其中烯烃类成分23个、醇类成分7 个、酯类成分2 个、苯及其衍生物1 个、其他类型及未知成分11 个。如表1 所示,芳樟醇占比最高,为29.78%;柠檬烯占比为15.35%,β-月桂烯占比为14.42%。
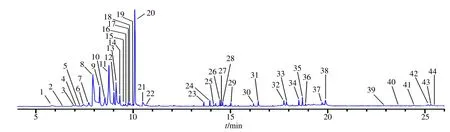
图1 竹叶椒挥发油的GC-MS 总离子流图Fig.1 Total ion chromatogram of GC-MS of volatile oil of Z.armatum
3.2 “成分-靶点-疾病”网络的构建与分析
如图2 所示,“成分-靶点-疾病”网络有114 个节点、269 条边,平均度值为4.3,节点颜色越深、面积越大代表度值越高。圆形节点为竹叶椒挥发油活性成分共38 个,其中ZA42、ZA31、ZA38、ZA33、ZA43、ZA9、ZA23 和ZA39 度值均≥5,度值≥2 的成分占总成分的73.68%;未预测到ZA8、ZA3、ZA15和ZA37 抗炎、镇痛的作用靶点,因此予以剔除。菱形节点为交集靶点共78 个,度值均≥2,其中PTGS2、CHRM3、PPARA、CNR2、肾上腺素能受体α1A(adrenergic receptor α1A,ADRA1A)、F10、免疫球蛋白重链恒定区γ1(immunoglobulin heavy constant γ1,IGHG1)和非受体型酪氨酸蛋白磷酸酶 1(tyrosine-protein phosphatase non-receptor type 1,PTPN1)节点度值均≥5,度值≥3 的靶点占总靶点的51.28%。

表1 竹叶椒挥发油中化学成分的定性分析Table 1 Qualitative analysis of chemical composition in volatile oil of Z.armatum
3.3 靶点与组织分布关联网络的构建与分析
如图3 所示,靶点-组织分布网络包含126 个节点、782 条边,平均度值为9.63,圆形节点代表潜在作用靶点,长方形节点代表相关靶点可能分布的组织或器官,边代表靶点与组织之间的相互作用关系。44 个靶点分布于淋巴组织,43 个靶点分布于肝脏,41 个靶点分布于心肌细胞,37 个靶点分布于心脏。此外,CD33、CD34、CD14、CD56 等靶点分布于抗原蛋白。因此,竹叶椒挥发油可能通过作用于多种组织或器官的靶点,从而发挥抗炎、镇痛作用,且免疫调控可能是其主要作用机制之一。

图2 竹叶椒挥发油抗炎、镇痛的“成分-靶点-疾病”网络Fig.2 “Ingredient-target-disease” network of volatile oil of Z.armatum on anti-inflammation and analgesic
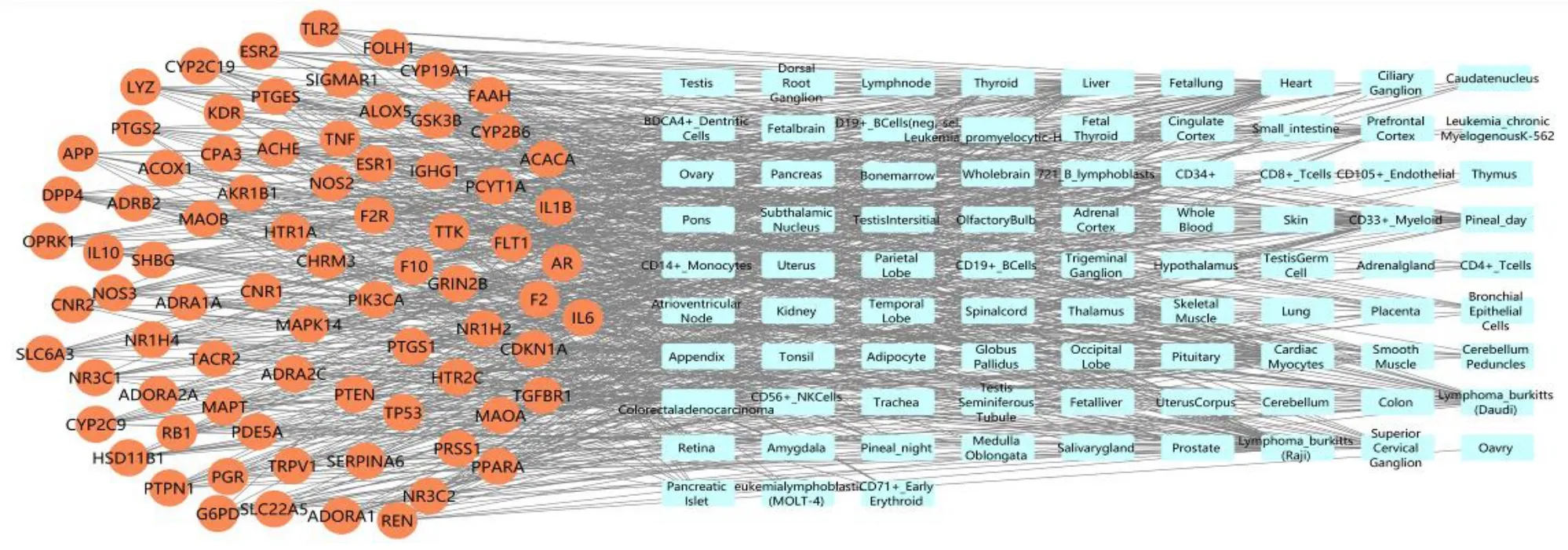
图3 竹叶椒挥发油抗炎、镇痛潜在靶点的组织分布网络Fig.3 Potential targets-tissue distribution network of volatile oil of Z.armatum on anti-inflammation and analgesic
3.4 PPI 网络的构建与分析
如图4 所示,PPI 网络共有75 个节点、519 条边,平均度值为13.8。PCYT1A、SIGMAR1、IGHG1未参与PPI,因此予以剔除。度值≥3 的靶点占总靶点的93.33%,度值>20 的靶点主要包含PTGS2、IL6、肿瘤坏死因子(tumor necrosis factor,TNF)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)、NOS3、β-淀粉样蛋白前体蛋白(amyloid-β precursor protein,APP)、雌激素受体1(estrogen receptor 1,ESR1)、IL1B 等。将PPI 网络数据导入Cytoscape 3.7.2 软件,筛选出大于平均度值的靶点33 个见图5,提示这些靶点可能在竹叶椒挥发油抗炎、镇痛中发挥重要作用。
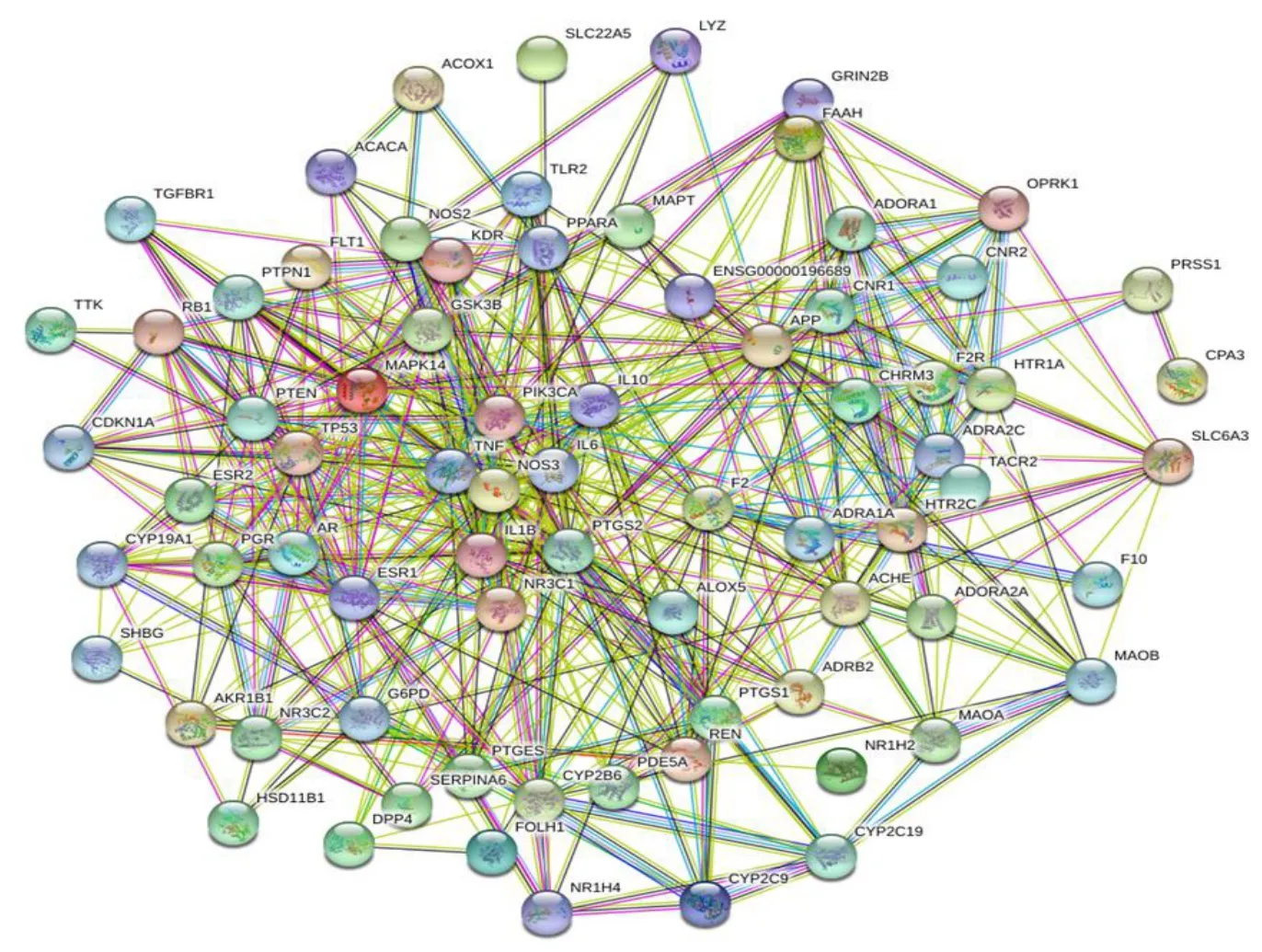
图4 竹叶椒挥发油抗炎、镇痛靶点的PPI 网络Fig.4 PPI network of volatile oil of Z.armatum on anti-inflammation and analgesic

图5 竹叶椒挥发油抗炎、镇痛核心靶点的相互作用关系Fig.5 Key targets interaction of volatile oil of Z.armatumon anti-inflammation and analgesic
3.5 GO 功能分析
借助DAVID 数据库对筛选得到的核心靶点进行GO 功能分析,即从生物过程、细胞组分和分子功能3 个方面进行基因功能注释。共获得130 个GO条目(P<0.01),其中85 个涉及生物过程、16 个涉及细胞组分、29 个涉及分子功能。以基因数进行降序排列,各选取前15 个条目,如图6 所示,生物过程结果显示,竹叶椒挥发油抗炎、镇痛的靶点主要与RNA 聚合酶II 启动子转录的正调控、细胞增殖负调控、信号转导、氧化还原进程、炎性反应等有关;分子功能结果显示,竹叶椒挥发油抗炎、镇痛作用主要与酶结合、锌离子结合、同蛋白结合、受体结合及序列特异性DNA 结合等方面相关;细胞组分结果显示,竹叶椒挥发油可能作用于质膜、膜的整体组成、质膜的组成部分、胞外区、细胞外空间等,从而发挥抗炎、镇痛作用。
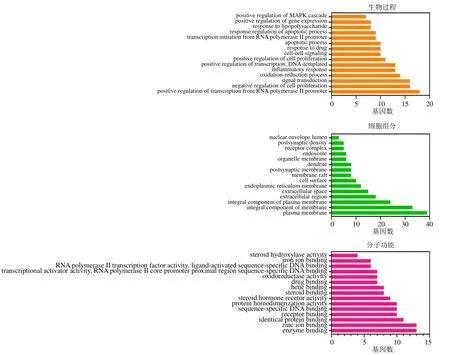
图6 竹叶椒挥发油抗炎、镇痛潜在靶点的GO 富集分析 (前15)Fig.6 GO enrichment analysis of potential anti-inflammation and analgesic targets of volatile oil of Z.armatum(top 15)
3.6 KEGG 靶点通路富集分析
共筛选得到60 条信号通路,选取P值较小的20 条信号通路进行可视化,如图7 所示,竹叶椒挥发油的抗炎、镇痛机制主要与神经活性配体受体相互作用(neuroactive ligand-receptor interaction)、5-羟色胺能突触(serotonergic synapse)、胰岛素抵抗(insulin resistance)、花生四烯酸代谢(arachidonic acid metabolism)、钙信号通道(calcium signaling pathway)、磷酯酰肌醇3 激酶(phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路相关。

图7 竹叶椒挥发油抗炎、镇痛潜在靶点KEGG 富集分析的20 条通路Fig.7 KEGG enrichment analysis of 20 pathways of potential anti-inflammation and analgesic targets of volatile oil of Z.armatum
3.7 竹叶椒挥发油中主要活性成分与核心靶点的分子对接
为进一步验证竹叶椒挥发油抗炎、镇痛核心靶点与活性成分间的相互作用,筛选“成分-靶点-疾病”网络中12 个活性成分(中心度值>3)及2 种临床药物(阿司匹林、塞来昔布)与4 个核心靶点(PTGS2、CHRM3、PPARA、CNR2)进行分子对 接分析,结果如表2 所示,结合能越小,表明配体与蛋白间的亲和力越高,结合能<-5.0 kJ/moL 表明活性成分与靶点具有较强的亲和活性。12 个活性成分与4 个核心靶点的结合能均<-6.5 kJ/moL,表明竹叶椒挥发油活性成分与4 个核心靶点均有较好的亲和能力,其中ZA43、ZA28 与PTGS2、CHRM3、PPARA 和CNR2 的结合能均<-10.0 kJ/mol,且结合体构象较稳定,分子对接模式见图8。

表2 竹叶椒挥发油主要活性成分与核心靶点的结合能Table 2 Binding affinities of active ingredients of volatile oil of Z.armatum with core targets
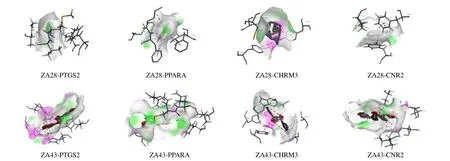
图8 ZA28、ZA43 与4 个核心靶点的分子对接Fig.8 Molecular docking of ZA28 and ZA43 with four core targets
4 讨论
竹叶椒又名山花椒、狗椒、野花椒等,始载于《本草图经》,是我国花椒种质资源的特色品种,主要分布于我国西南各省[13]。竹叶椒在四川产量极为丰富,常用于治疗风湿、疼痛及跌打损伤等[14]。为深入挖掘竹叶椒的药用资源价值,本研究基于中药多成分、多靶点的特点,应用生物网络分析结合分子对接预测竹叶椒挥发油抗炎、镇痛的“成分-靶点”相互作用,进而探索其潜在的作用机制。基于GC-MS 的化学物质组研究定性鉴别竹叶椒挥发油中44 个化学成分,其中芳樟醇、柠檬烯和β-月桂烯占比较高,占比均>14%,与已报道的四川产竹叶椒挥发油组分表征结果一致[15]。然而,相关研究表明浙江产竹叶椒中以桉叶油醇和α-松油醇占比较高,分别为37.96%、17.62%;湖北产竹叶椒则以桉叶油醇和萜品烯占比较高,占比分别为36.19%、21.31%[13,16]。由此可见,与浙江和湖北等产地的竹叶椒相比,本研究所采用的四川产竹叶椒在挥发油组分的化学组成和主要成分含量上可能存在较大差别。因此,可进一步基于挥发油特征成分的“质-量”进行不同产地的竹叶椒质量标志物(quality marker,Q-Marker)的筛选,从而为该药材产地的精准溯源和有效鉴别提供科学依据。
四川产竹叶椒挥发油中主要成分芳樟醇在醋酸、谷氨酸诱导的多种疼痛动物模型中均表现出显著镇痛作用[17-18];柠檬烯对溃疡性结肠炎和呼吸系统炎症损伤均具有改善作用[19-20];月桂烯对热板、福尔马林、坐骨神经压迫刺激诱导的小鼠疼痛均有明显抑制作用[21-22];芝麻素可显著抑制LPS 诱导的小鼠足巨噬细胞中一氧化氮(nitric oxide,NO)、TNF-α、IL-6、前列腺素E2(prostaglandin E2,PGE2)的表达和释放[23],提示竹叶椒挥发油可能通过多种成分协同发挥抗炎、镇痛作用。
为进一步探讨竹叶椒挥发油抗炎、镇痛的作用机制,本研究构建“成分-靶点-疾病”网络筛选其可能的作用靶点蛋白群,并对相关靶点进行组织分布、PPI、GO 功能富集及KEGG 通路富集分析。组织分布结果显示,竹叶椒挥发油所对应的78 个靶点主要富集于淋巴组织、肝脏、心肌细胞和心脏,为其针对特定组织或器官的抗炎、镇痛作用提供了一定依据。富集结果显示,竹叶椒挥发油抗炎、镇痛相关的通路主要涉及神经活性配体受体相互作用、5-羟色胺能突触、花生四烯酸代谢及PI3K/Akt 信号通路等,并涉及RNA 聚合酶II 启动子转录的正调控、酶结合、质膜等多种生物学过程。
综合“成分-靶点-疾病”网络与PPI 分析结果,筛选得到PTGS2(对应21 个成分)、CHRM3(对应9 个成分)、PPARA(对应6 个成分)和CNR2为竹叶椒挥发油抗炎、镇痛的潜在核心靶点。PTGS2是一种PTGS 的诱导型同工酶(COX-2),COX-2是抑制前列腺素介导的炎性反应和疼痛的经典药物靶点。CHRM3 为毒蕈碱型乙酰胆碱受体,在胰腺炎、胆管炎、呼吸道炎性反应等疾病发生中具有重要作用[24-26]。通过M3-乙酰胆碱受体(acetylcholine receptor,AChR)/蛋白激酶C(protein kinase C,PKC)/核因子-κB(nuclear factor-κB,NF-κB)途径介导的CHRM3 受体的激活可能会促进IL-8 表达,调节CHRM3 表达可以作为一种潜在治疗炎性疾病的方法[27]。PPARA 主要参与脂肪酸及其衍生物的氧化代谢,PPARA 激动剂能够有效抑制多种炎性反应[28-30]。在LPS 刺激的人单核细胞中,PPARA的激活能够通过调节活化因子蛋白-1(activator protein-1,AP1)和NF-κB 信号通路,从而抑制基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)、组织因子(tissue factor,TF)等多种促炎分子的产生;小鼠巨噬细胞中PPARA 缺乏后,其抗炎作用减弱,提示PPARA 参与炎性反应的调控[31]。CNR2 作为一种G 蛋白偶联受体,为内源性大麻素系统的重要组成部分,与疼痛感知、炎性反应密切相关[32]。CNR2 激动剂可改善结肠炎、动脉粥样硬化、多发性硬化及缺血再灌注损伤中的炎性反应,并能够有效减轻癌症诱发的骨疼痛[33-34]。分子对接结果显示,竹叶椒挥发油中主要活性成分与4 个核心靶点均具有较好的亲和力,验证了采用网络分析所筛选的PTGS2、CHRM3、PPARA 和CNR2 4 个核心靶点的可靠性。(-)-β-花柏烯、胆甾烯基豆蔻酸酯、芝麻素及β-榄香烯等微量成分与4 个核心靶点的亲和能力较强,结合能均<-8.0 kJ/moL;芝麻素与4 个核心靶点的亲和力均优于阳性药物阿司匹林和塞来昔布,表明竹叶椒挥发油中除含量较高的芳樟醇等成分以外,多种微量成分仍可能通过多靶点协同发挥抗炎、镇痛作用。因此,可进一步结合亲和超滤及配体垂钓等实验技术验证以上活性成分与靶点的亲和作用及相关生物学活性。
综上所述,本研究基于GC-MS 技术定性表征竹叶椒挥发油的化学成分,并结合网络药理学与分子对接筛选并验证其主要活性成分的作用靶点,初步探讨了竹叶椒挥发油抗炎、镇痛的潜在作用机制,为进一步阐明竹叶椒的抗炎、镇痛机制提供了一定的研究方向和数据支持。
利益冲突所有作者均声明不存在利益冲突

