小儿川崎病发病机制及临床诊治的研究进展
路振,张玉玲
(哈尔滨医科大学附属第二医院儿科,哈尔滨 150001)
川崎病又称黏膜皮肤淋巴结综合征,是一种涉及全身的血管病,在儿科临床较常见。川崎病属于全球性疾病,发病率因种族和国家不同而有所差异,在亚裔人群中川崎病的发病率相对较高,其中日本是川崎病发病率最高的国家[1]。日本川崎病全国流行病学调查结果显示,2015—2016年5岁以下儿童川崎病的发病率为(309.0~330.2)/10万[2]。韩国川崎病流行病学调查结果显示,2014年5岁以下儿童川崎病的发病率为194.7/10万[3]。我国地区性流行病学调查结果显示,2000—2004年北京地区5岁以下儿童川崎病的发病率为(40.9~55.1)/10万[4];2008—2012年上海地区5岁以下儿童川崎病的发病率为(30.3~71.9)/10万[5]。川崎病的主要临床表现为急性或持续性发热、口腔黏膜炎、眼结膜充血、淋巴结肿大等。川崎病患儿的主要病理改变是全身中小血管的炎性病变,尤以冠状动脉为主,病程远期若形成冠状动脉血栓,则可引起儿童缺血性心脏病,严重威胁患儿正常生长发育和身体健康[6-7]。此外,小儿川崎病急性期还可出现心包膜炎、心肌炎等症状,进一步诱发严重的并发症(包括心力衰竭),直接威胁患儿生命健康[8]。因此,及时采取有效措施控制患儿病情具有重要意义。现就小儿川崎病发病机制及临床诊治的研究进展予以综述。
1 发病机制
1.1免疫活化 目前认为,川崎病发病的始动因素是病原菌入侵以及由此所致的免疫系统异常活化,当易感儿童受到病原菌侵入时,机体的多种免疫细胞被激活,导致免疫系统异常活化以及炎症反应,其中T淋巴细胞异常活化是川崎病免疫损伤的首要环节[9]。已有研究证实,川崎病的严重程度与CD4+CD25high叉头框转录因子P3(forkhead box P3,FoxP3)+T细胞的数量减少以及CD4+CD25highFoxP3+T细胞/CD4+CD25+FoxP3-T细胞比例失衡密切相关[10]。另有研究发现,与其他疾病所致的发热患儿相比,川崎病患儿血小板及CD4+T细胞上的CD40配体表达上调,而经静脉注射丙种球蛋白(intravenous immunoglobulin,IVIG)治疗3 d后,其表达显著下调;同时该研究还发现CD40配体与川崎病的冠状动脉病变相关[11]。此外,与健康对照者相比,急性期川崎病患儿血清CD19+、CD4+、CD4+/CD8+T细胞水平显著升高,而CD8+T细胞和自然杀伤细胞水平则显著降低[12]。
1.2炎症细胞因子 川崎病患儿体内异常活化的炎症细胞诱导产生大量的炎症细胞因子,进一步导致血管炎性损伤。白细胞介素(interleukin,IL)-6是由中性粒细胞和单核细胞/巨噬细胞合成的多效性细胞因子,在系统性炎症中起重要作用。Wu等[13]研究发现,急性期川崎病患儿血清IL-6水平显著升高,经IVIG治疗后血清IL-6水平降至正常,且血清IL-6水平与C反应蛋白、红细胞沉降率均呈正相关;此外,与IVIG应答者相比,IVIG无应答者的血清IL-6水平显著升高,因此IL-6可能是预测IVIG无反应型川崎病的生物标志物。另有研究发现,在IVIG治疗前,川崎病患儿血清中的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6以及γ干扰素等炎症细胞因子水平均显著升高,而经IVIG治疗后这些炎症细胞因子水平则快速降低,但合并冠状动脉损伤或IVIG无反应型川崎病患儿的血清TNF-α水平在接受治疗后升高,表明炎症细胞因子与川崎病的发生、发展密切相关[14]。还有研究显示,急性期川崎病患儿血清TNF-α水平显著高于恢复期川崎病患儿及健康对照儿童;进一步研究发现,当川崎病患儿处于急性期时,其血清TNF-α水平与肌钙蛋白I水平呈显著正相关,由此认为,急性期川崎病患儿心血管的损害程度与血清TNF-α水平密切相关,同时TNF-α在预测患儿冠状动脉和心肌损伤方面发挥重要作用,具有重要的临床应用价值[15]。
1.3核因子κB(nuclear factor-κB,NF-κB) NF-κB可通过促进基因转录调控免疫反应信号转导途径。研究显示,川崎病患儿单核/巨噬细胞中的NF-κB活性显著升高,其可能在诱导产生血管内皮细胞炎症因子、启动和调节炎症反应、诱导炎症损伤等方面发挥重要作用[16-18]。一项利用小鼠模型研究川崎病病理机制的实验发现,NF-κB具有激活细胞因子(包括IL-12、IL-23以及IL-1β前体等)的能力,辅助性T细胞17在细胞因子的作用下分化、诱导产生IL-17,而IL-17具有促炎作用,参与中性粒细胞、巨噬细胞向炎症部位的聚集,聚集的中性粒细胞分泌多种蛋白酶、自由基,而巨噬细胞可诱导产生TNF-α、粒细胞-巨噬细胞集落刺激因子、IL-6等趋化因子和促炎因子,进一步加重内皮细胞损伤,最终导致血管炎的发生[19]。此外,NF-κB活化还可能参与调节川崎病冠状动脉和心脏炎症反应的发生。张艳兰等[20]通过实验发现,与正常小鼠相比,合并冠状动脉损伤的川崎病小鼠的心脏及冠状动脉组织中NF-κB活化程度显著升高,说明NF-κB可能参与川崎病的冠状动脉损伤。
1.4基质金属蛋白酶(matrix metalloproteinases,MMPs) MMPs是由单核/巨噬细胞、内皮细胞、中性粒细胞等合成分泌的蛋白酶,可降解细胞外基质,而保持细胞外基质完整性的关键是MMPs与金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinases,TIMPs)间的动态平衡。单核细胞和中性粒细胞在向血管内皮细胞迁移、黏附过程中可诱导产生大量的MMPs和炎症细胞因子,导致MMP-9表达水平升高[21]。已有研究证明,与正常儿童相比,川崎病患儿的TIMP-1、MMP-9水平以及MMP-9/TIMP-1均显著升高,提示MMPs与TIMPs之间的动态平衡被打破,MMPs被诱导激活;MMPs在加速降解细胞外基质的同时还可破坏血管基膜,导致血管屏障功能破坏、炎症细胞及炎症细胞因子浸润血管壁,进一步加剧血管炎症损伤[22]。
1.5血管内皮损伤 血管内皮生长因子(vascular endothelial growth factor,VEGF)可增加血管通透性,并能促进内皮细胞增生及超氧化物产生,导致血管损伤[23],而内皮抑素则通过抑制新生血管形成,在血管损伤中发挥保护作用[24],VEGF与内皮抑素共同参与血管损伤和修复过程。研究发现,在川崎病发病机制中血管内皮损伤扮演重要角色,而在川崎病患儿发病期间,VEGF与内皮抑素的平衡出现显著变化,急性期川崎病患儿冠状动脉损伤与VEGF/内皮抑素比值升高密切相关[25]。另有研究表明,与未合并冠状动脉损伤的川崎病患儿相比,合并冠状动脉损伤的患儿VEGF水平显著升高,表明VEGF可能参与调节川崎病血管损伤过程[26]。
2 临床诊断
目前,川崎病的诊断主要依据发热、唇红干裂、皮疹、球结膜充血、手足硬肿以及颈部淋巴结肿大等症状,但临床部分患儿仅具有部分症状,导致川崎病确诊困难,且易出现漏诊。此外,许多疾病与川崎病具有相似的症状,如猩红热、麻疹等疾病也会出现发热、皮疹等症状,因此当川崎病合并感染时确诊更为困难。临床亟须特异性强、灵敏度高的实验室指标辅助确诊。
2.1完全性川崎病 经典的完全性川崎病诊断标准为:在发热>5 d的基础上,满足其他5项临床表现(①非化脓性双眼结合膜充血;②多形性皮疹;③急性期掌跖红斑、手足硬肿,恢复期指/趾端膜状脱皮;④口唇充血、皲裂,草莓舌;⑤非化脓性颈淋巴结肿大)中的4项,并排除其他疾病[27]。日本川崎病协作组于2020年对川崎病的诊断标准进行了第6次修订,新版指南中去除了发热>5 d这一诊断前提,目的是使川崎病患儿得到及时的IVIG治疗,以减少冠状动脉损伤的发生,避免严重并发症的发生;此外,在川崎病诊断指南第6次修订中皮肤症状不再局限于“多形性皮疹”,而是直接采用更为宽泛的“皮疹”症状,且加入了“卡疤红肿”这一皮肤表现,而卡疤红肿更多见于2岁以下婴幼儿;同时,新版指南对完全性川崎病的诊断标准也进行了修订:满足6项临床表现(①发热;②非化脓性双眼结合膜充血;③皮疹;④急性期掌跖红斑、手足硬肿,恢复期指/趾端膜状脱皮;⑤口唇充血、皲裂,草莓舌;⑥非化脓性颈淋巴结肿大)中的5~6项者,无论是否发生冠状动脉损伤,均可诊断为完全性川崎病;若患儿仅满足上述6项临床表现中的4项,则需冠状动脉超声证实存在冠状动脉损伤,才可诊断为完全性川崎病[28]。
目前我国绝大多数儿科医师仍采用川崎病经典诊断标准,但过于机械地套用“发热>5 d”这一诊断前提不利于川崎病的早诊断、早治疗,可能会加重川崎病患儿的冠状动脉损伤。川崎病诊断指南第6次修订则规避了这一弊端,但也可能造成川崎病的过度诊治。同时,IVIG费用较为昂贵,且为血液制品,可能造成医疗资源浪费、增加输血感染风险。因此,临床医师应权衡利弊,早期多次冠状动脉超声检查可能更有助于川崎病患儿及时确诊。
2.2不完全性川崎病 与完全性川崎病相比,不完全性川崎病的临床特征相对较少,既往诊断标准为:在发热>5 d基础上,其他5项临床症状仅满足2~3项,且除外其他疾病[27]。美国心脏病协会于2017年提出了新的不完全性川崎病诊断流程[29],见图1。
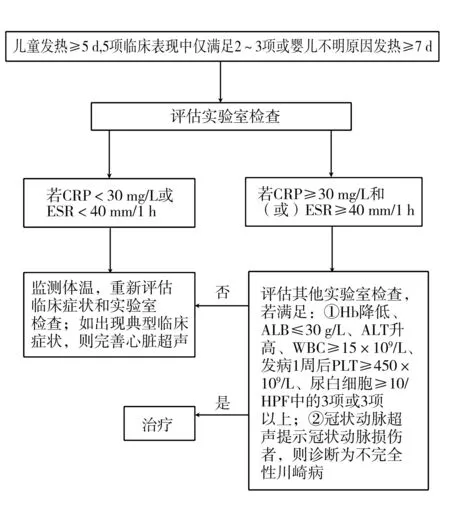
CRP:C反应蛋白;ESR:红细胞沉降率;Hb:血红蛋白;ALB:白蛋白;ALT:丙氨酸转氨酶;WBC:白细胞;PLT:血小板;HPF:高倍视野
3 临床治疗
目前阿司匹林和IVIG仍是川崎病的主要治疗药物。临床上大部分患儿在接受足量(2 g/kg)IVIG治疗后体温降至正常,其他临床症状也逐渐消退,但有10%~20%的川崎病患儿在应用足量IVIG 36 h后仍持续发热或热退后再次出现发热症状,这种现象称为“IVIG无反应型川崎病”[29]。针对IVIG无反应型川崎病的治疗,除了可以继续使用IVIG二次治疗外,还可以联合糖皮质激素,同时TNF-α阻滞剂亦可用于IVIG无反应型川崎病的补救治疗。
3.1阿司匹林 阿司匹林是非选择性环加氧酶抑制剂,主要通过促进环加氧酶1丝氨酸残基的乙酰化反应,使其失活,从而减少血栓素A2的生成,达到抑制血小板凝集的目的[30]。此外,阿司匹林还具有抗炎、抗氧化等作用,可抑制动脉粥样硬化。在小儿川崎病的急性发病期,阿司匹林的用量为30~50 mg/(kg·d),退热后3 d开始减量,2周左右减至3~5 mg/(kg·d),同时随访冠状动脉超声,若患儿无冠状动脉损伤,则用药6~8周后停药;若患儿出现冠状动脉损伤,则需继续用药至冠状动脉完全恢复正常[29]。研究显示,阿司匹林治疗川崎病引起的冠状动脉损伤可能与其降低MMP-9、MMP-9/TIMP-1、前列腺素E2以及TNF-α等水平相关,应用阿司匹林治疗可通过降低炎症细胞因子水平抑制患儿机体的血管炎症反应[31]。目前阿司匹林已成为川崎病标准治疗方案的重要组成部分,但对于急性期川崎病患儿产生的冠状动脉病变,单独使用阿司匹林抑制作用有限,因此临床常应用阿司匹林联合IVIG治疗。但临床应用阿司匹林时应注意药物之间的相互作用及不良反应。研究显示,布洛芬可抑制阿司匹林的抗血小板凝集作用[32],而阿司匹林本身即可通过体温调节中枢发挥解热作用,因此不建议应用阿司匹林治疗的川崎病患儿使用布洛芬退热[33]。此外,儿童长期大剂量使用阿司匹林有诱发瑞氏综合征的风险,因此用药期间应密切观察,并对患儿家属做好宣教[34-35]。若患儿同时患流行性感冒、水痘或接种水痘疫苗后2周内均应避免使用阿司匹林[36]。
3.2IVIG 注射用丙种球蛋白可作为原发性和继发性免疫缺陷病、炎症性疾病以及自身免疫性疾病治疗的替代疗法。急性期川崎病患儿给予IVIG治疗可显著降低冠状动脉损伤的风险,美国心脏病协会推荐川崎病患儿接受IVIG冲击治疗方案(2 g/kg,单次应用)[29]。然而,一项多中心随机对照研究将患病10 d内的川崎病患儿随机分为三组:A组(2 g/kg IVIG单次应用)、B组(1 g/kg IVIG连用2 d)和C组(1 g/kg IVIG单次应用),并随访6个月,结果发现,三组患儿退热时间、总住院时间以及冠状动脉损伤率比较差异均无统计学意义,由于单剂量1 g/kg IVIG治疗成本低,且具有与2 g/kg IVIG相同的疗效,故可考虑作为川崎病的初始治疗方案[37]。目前对于初次使用IVIG的时间仍存在争议,日本第22次全国性川崎病调查结果显示,常规治疗(发病5~7 d用药)与早期治疗(发病≤4 d用药)患者发生冠状动脉扩张或冠状动脉瘤风险的差异无统计学意义;而晚期治疗(发病8~10 d用药)患者发生冠状动脉扩张或冠状动脉瘤的风险较常规治疗及早期治疗均显著增高,故建议在发病7 d内用药[38]。患儿初次接受IVIG治疗后若未产生疗效,可再次行IVIG治疗。
3.3糖皮质激素 糖皮质激素具有潜在的抗炎特性,可显著缓解机体炎症反应,在多种血管炎症性疾病的治疗中发挥重要作用。但将糖皮质激素应用于川崎病的治疗一直存在争议,糖皮质激素可能会增加川崎病患儿冠状动脉损伤的风险,还可促进血栓形成,因此不能单独使用。研究发现,初始治疗时,地塞米松联合单剂IVIG(2 g/kg)可显著缓解川崎病患儿的发热症状、缩短住院时间,同时还可减少IVIG抵抗的发生[39]。研究证明,继续使用IVIG治疗与换用糖皮质激素治疗的IVIG无反应型川崎病患儿在减少冠状动脉损伤方面比较差异无统计学意义,但糖皮质激素在降低C反应蛋白水平和退热方面优势显著,因此对于IVIG无反应型川崎病患儿,与继续使用IVIG相比,换用糖皮质激素的疗效更佳且更经济[40]。
3.4TNF-α阻滞剂 急性期川崎病患儿血浆TNF-α水平升高与冠状动脉瘤的形成密切相关[41]。抗TNF-α治疗在血管炎治疗方面疗效显著,临床工作者开始尝试将TNF-α阻滞剂用于川崎病的治疗。英夫利昔单抗是常用的TNF-α阻滞剂,其与TNF-α结合后可产生一种稳定的非解离免疫复合物,该复合物不能与TNF-α受体结合,因此阻断了下游信号通路。一项回顾性研究发现,与应用二次IVIG治疗的IVIG无反应型川崎病患儿相比,应用英夫利昔单抗治疗的IVIG无反应型川崎病患儿的发热时间以及住院时间均显著缩短,但英夫利昔单抗对川崎病患儿冠状动脉损伤的缓解以及其他并发症的疗效仍需进一步的研究证实[42]。
4 小 结
川崎病的发病机制目前尚未完全阐明,可能与病原菌入侵以及由此所产生的免疫系统异常活化有关。川崎病的一线治疗药物主要包括阿司匹林和IVIG,糖皮质激素和英夫利昔单抗可用于IVIG无反应型川崎病的补救治疗。此外,临床儿科医师需注意最新版的日本川崎病诊断指南不再强调“发热>5 d”这一诊断前提,其目的是使川崎病患儿得到及时的IVIG治疗,减少冠状动脉损害的发生。虽然目前针对川崎病发病机制及临床诊治的研究已经取得了一定进展,但具体机制仍未明确。未来应着重于细胞遗传学与分子生物学方面的研究,使更多有效的靶向药物应用于临床,以改善川崎病患儿的预后。

