嗜热脂肪芽胞杆菌色氨酰-tRNA合成酶BsTrpRS的表达、纯化及其与创新霉素复合物的单晶制备和X-射线衍射分析
樊帅,吕广新,金媛媛,杨兆勇
·论著·
嗜热脂肪芽胞杆菌色氨酰-tRNA合成酶BsTrpRS的表达、纯化及其与创新霉素复合物的单晶制备和X-射线衍射分析
樊帅,吕广新,金媛媛,杨兆勇
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所微生物代谢工程室
获得来源于嗜热脂肪芽胞杆菌色氨酰-tRNA 合成酶(BsTrpRS)与创新霉素复合物的晶体结构,为创新霉素的理性设计提供结构基础。利用大肠杆菌表达系统异源表达获得 BsTrpRS 可溶性表达,采用亲和层析色谱、离子交换色谱和分子排阻色谱纯化目的蛋白,以期获得纯度在 90% 以上的 BsTrpRS,通过等温滴定量热法检测 BsTrpRS 与创新霉素的亲和力。选用悬滴-水蒸汽扩散法筛选蛋白质结晶条件,通过优化结晶条件获得高质量晶体,利用上海光源蛋白质晶体学光束线站收集 X-ray 衍射数据。运用分子生物学方法成功构建含基因的重组质粒,转化 BL21(DE3) 得到重组表达菌株。运用亲和层析、离子交换色谱和分子排阻色谱等蛋白纯化技术,获得高纯度 BsTrpRS 蛋白。利用 ITC 技术确证创新霉素与 BsTrpRS 之间亲和力为 3.2 μmol/L。通过晶体筛选优化,最佳结晶条件为 1.8 mol/L K2HPO4,pH 7.6,37 ℃,0.75%(v/v)1,3-丙二醇,最终获得 X-ray 衍射分辨率为 2.06 Å的 BsTrpRS/创新霉素二元复合物晶体,其晶胞参数为 a = 91.675 Å,b = 91.675 Å,c = 152.37 Å,α = 90.000°,β = 90.000°,γ = 120.000°,晶体的马修斯系数为 2.48 Å3/Da,最小非对称单位内含有 2 个蛋白分子,溶剂百分比为 50.46%。创新霉素与 BsTrpRS 复合物晶体结构的获得,有望对创新霉素小分子结构优化及设计提供指导方向及重要依据。
创新霉素; 色氨酰-tRNA合成酶; 共结晶; X-射线衍射
细菌耐药己经成为21 世纪全球面临的严重挑战之一,尤其革兰氏阳性菌出现了非常严重的耐药性[1],如耐甲氧西林的金黄色葡萄球菌、耐青霉素肺炎链球菌及耐万古霉素的肠球菌;细菌对现有药物的耐药速度己经远远超过新药的研发速度,从而促使恶性循环进一步加剧。与现在临床上应用的药物结构不同,噻喃并吲哚结构母核的化合物创新霉素(chuangxinmycin)[2-3]具有抗耐药菌活性和抗结核杆菌活性,具有发展成为一类新母核结构的抗菌药物的潜力。
创新霉素的抗菌作用是通过选择性抑制色氨酰 tRNA 合成酶(tryptophanyl-tRNA synthetase,TrpRS)[4-5]活性实现的。氨酰 tRNA 合成酶(aminoacyl-tRNA synthetases,aaRSs)催化氨基酸酰胺化与相应 tRNA 结合生成酰胺氨基酸 tRNA,在核苷酸的翻译过程中发挥着重要的作用。此类酶的活性和选择性是生命所必需的。作为蛋白质翻译必需的酶,氨酰 tRNA 合成酶是理想的抗菌药物靶点[6],但必须要注意氨酰 tRNA 合成酶物种间的特异性,以避免对人类产生严重的副作用。以氨酰 tRNA 合成酶作为靶点最成功的例子为莫匹罗星,它的作用靶点为IleRS,通过竞争性结合异亮氨酸和 ATP 的结合抑制 IleRS 的活性[7],可治疗金黄色葡萄球菌感染。创新霉素自发现以来,研究人员就对其进行了化学结构确证、生物合成、化学合成、药理学、毒理学和药代动力学等大量的研究[8-11]。但由于目前关于创新霉素和 TrpRS 的复合物结构尚未见报道,分子机制尚不清楚,至今仍未广泛应用于临床。
本研究主要对嗜热脂肪芽胞杆菌色氨酰-tRNA 合成酶(BsTrpRS)与创新霉素的复合物的立体结构进行研究,构建 BsTrpRS 原核表达载体,利用大肠杆菌表达系统进行BsTrpRS 蛋白的异源表达,经 Co2+亲和层析、离子交换层析和分子筛纯化后,对 BsTrpRS 进行晶体培养获得 BsTrpRS 与创新霉素的复合物晶体,应用生物大分子 X-ray 衍射技术获得复合物的晶体结构数据并进行解析,为创新霉素的理性设计与结构优化提供理论依据,指导开发新的具有更好活性的抗菌药物。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 BsTrpRS 表达菌株BL21(DE3) 和表达质粒 pET-21a(+) 购自美国 Novagen 公司;Co2+-NTA 填料购自日本 Takara 公司;30 K 超滤浓缩管购自美国 Millipore 公司;HiTrap DEAE HP 和 Superose 12 10/300GL 购自美国 Cytiva 公司,其余试剂均为国产分析纯。
1.1.2 仪器 恒温摇床购自英国 New Brunswick 公司;PCR 仪购自美国 Applied Biosystems 公司;MicroCal PEAQ-ITC 等温滴定量热仪购自英国 Malvern Panalytical 公司。
1.2 方法
1.2.1 表达质粒构建 BsTrpRS 蛋白序列(WP_033015631.1)经优化密码子使其适于大肠杆菌表达,人工合成经密码子优化的基因序列。利用其基因序列为模板,设计 PCR 引物,分别为:NdeI-BsTrpRS-F(5' GGAATTCAA AACCATTTTTAGCGGCATTC 3')(下划线部分为加入的I 酶切位点),XhoI-BsTrpRS-R(5' CC GGGCTATGGGTCTGGGTCGTCGCCGC3')(下划线部分为加入的I 酶切位点),经 PCR 扩增和I/I 双酶切处理后,连入已I/I 双酶切 pET-21a(+) 构建表达质粒 pET-21BsTrpRS,利用基因测序确认序列准确无误。
1.2.2 BsTrpRS 表达与纯化 将 pET-21BsTrpRS 质粒转化至 BL21(DE3) 表达菌株接种于 1 L 含 100 μg/ml Amp 的 LB 培养基中。37 ℃,200 r/min 恒温摇床振荡培养至6000.8 ~ 1.0,加入终浓度为 0.5 mmol/L IPTG,200 r/min 20 ℃继续振荡培养 12 h。收集诱导培养的菌体在 4 ℃、5000 r/min条件下离心 10 min,弃上清,用 Lysis buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,10 mmol/L 咪唑,pH 7.4)重悬,利用高压均质机破碎,在 4 ℃、18 000 r/min 条件下离心 30 min,收集上清备用。由于 pET-21a(+) 带有 His6标签,因此可选用 Co2+-NTA 柱特异性吸附从而进行蛋白纯化,首先将收集的上清用 0.45 μm 滤膜过滤,然后与经 Lysis buffer 平衡后的基质在 4 ℃下结合 1 h,再用 Washing buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,20 mmol/L咪唑,pH 7.4)5 倍柱体积冲洗,最后用 Elution buffer(20 mmol/L 磷酸缓冲液,500 mmol/L NaCl,500 mmol/L 咪唑,pH 7.4)洗脱目的蛋白。离子交换层次采用弱阴离子交换柱 HiTrap DEAE HP,利用洗脱液(20 mmol/L Tris 和 2 mol/L NaCl,pH 8.0)进行梯度洗脱,收集出峰样品经 SDS-PAGE 检测后,将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。分子排阻层析流速为0.5 ml/min,收集出峰样品经 SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。
1.2.3 BsTrpRS 结晶条件优化 根据前期报道的 BsTrpRS 结晶条件[12]进行BsTRpRS 和创新霉素复合物晶体的结晶,将 BsTrpRS 浓度调至 8 mg/ml,创新霉素浓度 1.5 mmol/L,以 K2HPO4溶液作沉淀剂,在 16 孔板中用不同浓度的 K2HPO4,pH 7.6 作为池液,将 BsTrpRS 与池液 1:1 混合悬滴,样品放于 23 ℃恒温培养箱,采用悬滴-蒸汽扩散法培养晶体。对观察有晶体出现条件的 pH、蛋白浓度、结晶温度和沉淀剂浓度进行优化,最终获得可用于收集 X-射线衍射数据的单晶体。
1.2.4 BsTrpRS 与创新霉素亲和力评价 ITC 实验由 MicroCal PEAQ-ITC 完成,配置 300 μl 浓度 20 μmol/L BsTrpRS 加入样品池,每隔 180 s 滴定体积为 2 μl 浓度为 150 μmol/L 的创新霉素溶液,样品池温度为 37 ℃,滴定针数为 20 滴,数据用 MicroCal PEAQ-ITC 自带的 Origin 7.0 进行积分,采用 One Set of Sites 模型按照非线性最小方差法拟合滴定反应热。
1.2.5 X-Ray 晶体衍射与数据收集 经冻存的晶体在上海同步辐射光源BL18U1(0.97915 Å)线站上收集数据,使用检测器 Pilatus3 6M 收集衍射数据,衍射数据使用 HKL3000 软件包进行数据还原。
2 结果
2.1 BsTrpRS 表达质粒的构建
对 BsTrpRS 基因序列进行密码子优化,保持氨基酸序列不变的情况下,优化核苷酸序列使其适于大肠杆菌表达,改造完成后的基因序列由华大基因进行全基因合成,密码子优化前后的基因序列对比如图1 所示。
将密码子优化后的作为模板(以下出现的均为密码子优化后的序列),以NdeI-BsTrpRS-F 和 XhoI-BsTrpRS-R 为引物,进行PCR 克隆目的基因,PCR 产物进行琼脂糖凝胶电泳检测,的基因序列理论长度为 984 bp。结果如图2 所示,在约 1000 bp 处有特异性条带,与基因序列理论长度相符。
2.2 BsTrpRS 异源表达与纯化
通过重组质粒转化,成功表达全长的 BsTrpRS 重组细菌。在 37 ℃、200 r/min的条件下,培养至600达到 0.8 ~ 1.0,加入终浓度为 0.2 mmol/L的 IPTG,在 20 ℃、12 h 条件下诱导目的蛋白表达。收集菌体,经高压破碎,18 000 r/min 离心后,取上清过 0.45 μm 滤膜,采用 TALON®Metal Affinity Resin 进行第一步亲和层析纯化,目的蛋白第二步纯化利用弱阴离子交换柱 HiTrap DEAE HP 进行纯化,BsTrpRS 蛋白在洗脱液(20 mmol/L Tris,2 mol/L NaCl,pH 8.0)梯度洗脱,收集出峰样品进行 SDS-PAGE 分析,结果如图3 所示。经离子交换纯化后,BsTrpRS 纯度较高,达 90% 以上,为保证蛋白的均一性,目的蛋白第三步纯化采用分子排阻色谱 Superose 12 10/300GL 进行纯化,分子筛缓冲液为 50 mmol/L Tris,pH 7.2,0.1 mmol/L PMSF,收集出峰样品进行 SDS-PAGE 分析,结果如图4 所示。分子排阻色谱纯化后,BsTrpRS 纯度进一步提高,收集均一性较好的峰尖处蛋白,浓缩后备用。

图1 适于大肠杆菌表达的bstrprs序列密码子优化前后比对(BsTrpRS-before:优化前序列;BsTrpRS-after:优化后序列)
Figure 1 Comparison of wild-type and optimizedgene sequence forexpression (BsTrpRS-before: Wild-type LpxC gene sequence; BsTrpRS-after: Optimized LpxC gene sequence forexpression)

M:核酸标准品;1:基因
M: Marker ; 1:gene
图2基因 PCR 扩增结果
Figure 2 PCR amplification results ofgene

M:蛋白标准品;1 ~ 7:BsTrpRS
M: Protein marker; 1 - 7: BsTrpRS
图3 弱离子交换纯化BsTrpRS 的SDS-PAGE 分析
Figure 3 SDS-PAGE analysis of BsTrpRS purified by DEAE ion-exchange chromatography
2.3 BsTrpRS 与创新霉素复合物的结晶
对初筛条件中的 pH、蛋白浓度、沉淀剂浓度、结晶温度和添加剂进行优化,最终在蛋白浓度为 5.5 mg/ml,池液条件为 1.8 mol/L K2HPO4,pH 7.6,结晶温度为 37 ℃,添加剂为 1,3-丙二醇(0.75% v/v)时,结晶条件最优,晶体如图5 所示。将优化后的晶体液氮冻存,用 X 射线衍射仪筛选衍射分辨率较高的晶体,经液氮保存后,送至上海光源(SSRF)BL18U1 线站采集数据,衍射具体参数为:波长0.97915 Å,扫描步长为 1°,曝光时间 0.5 s,检测器距离 350 mm,收集 360 张衍射图(图6),并使用 HKL3000 进行数据处理,经数据还原,确定 BsTrpRS 与创新霉素复合物晶体结构空间群为3121(或3221)。衍射数据的分辨率为 2.06 Å,晶胞参数为:a = 91.675 Å,b = 91.675 Å,c = 152.37 Å,α = 90.000°,β = 90.000°,γ = 120.000°。衍射数据的统计结果见表 1。

M:蛋白标准品;泳道1 ~ 4:BsTrpRS
M: Protein marker; 1 - 4: BsTrpRS
图4 分子排阻色谱纯化BsTrpRS 的SDS-PAGE 分析
Figure 4 SDS-PAGE analysis of BsTrpRS purified by size exclusion chromatography

图5 BsTrpRS/创新霉素复合体晶体(× 64)
Figure 5 The crystal of chuangxinmycin in complex with BsTrpRS (× 64)

图6 BsTrpRS 与创新霉素复合物晶体 X 射线衍射图(最大分辨率为 2.06 Å)
Figure 6 Crystal X-ray diffraction pattern of BsTrpRS- chuangxinmycin complex (shown at 2.06 Å resolution)

表 1 BsTrpRS/创新霉素晶体数据
注:括号内为最外壳层数据。
Note: Values in parentheses refer to the highest resolution shells.
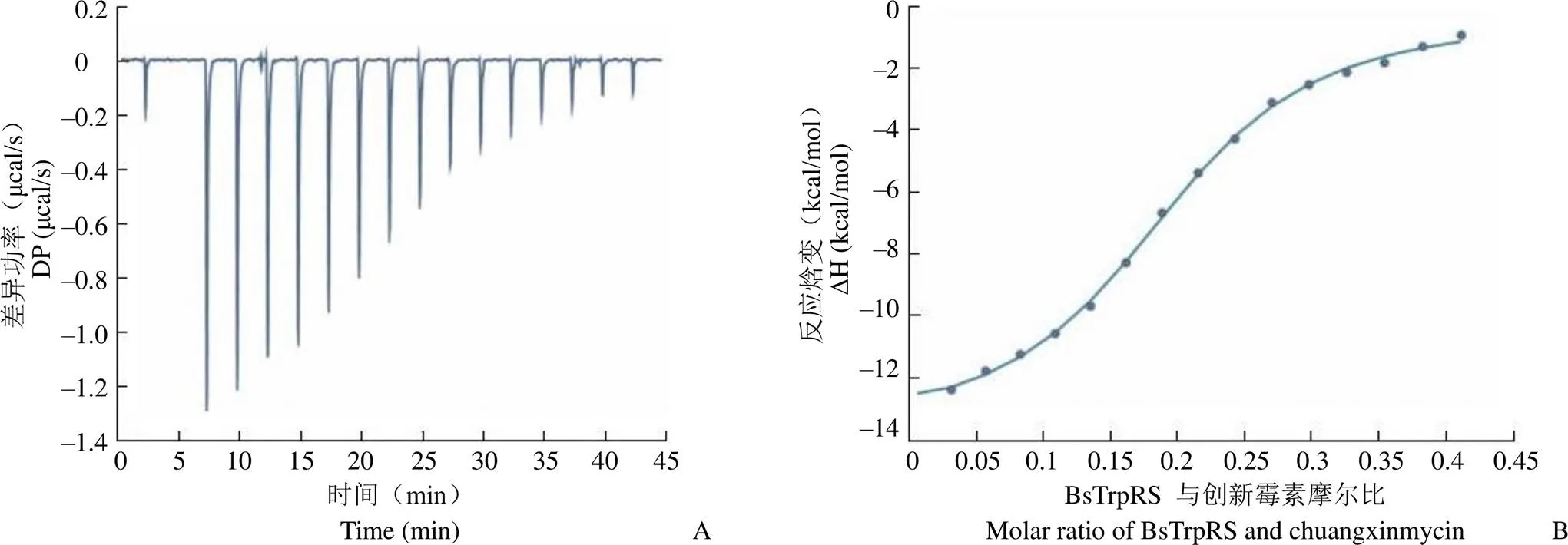
图7 BsTrpRS 与创新霉素相互作用的产生的 ITC 图谱
Figure 7 ITC raw data and binding isotherm for chuangxinmycin interacting with the BsTrpRS
2.4 BsTrpRS 与创新霉素亲和力评价
利用 ITC 检测创新霉素与 BsTRpRS 的相互作用,结果如图7 所示。通过对反应热函数用 One Set of Sites 模型进行拟合,得到创新霉素与 BsTrpRS 的结合常数、焓变和熵变,创新霉素与 BsTrpRS 的结合亲和力在微摩尔数量级,为3.2 μmol/L,根据结合热力学特性表明,创新霉素与 BsTrpRS 的结合是放热反应,其中 ∆H 为–13.5 kcal/mol,–T∆S 为 6.0 kcal/mol,因此氢键是介导创新霉素与 BsTrpRS 结合的主要作用力。这些分子互作的实验结果证明获得的结晶中的分子为 BsTrpRS 与创新霉素的复合体。
3 讨论
TrpRS 在生物体内的主要作用是催化 ATP 活化 Trp 并转移至 tRNA,确保色氨酸遗传密码的翻译。TrpRS 对其底物 Trp 和 tRNA 的特异性识别对于维持蛋白质合成的保真度至关重要。来源于的 BsTrpRS 的晶体结构已被解析,其含有两个高度保守特征序列的 RF 结构域,两个保守特征序列即为 KMSKS(Lys-Met-Ser-Lys- Ser)和 HIGH(His-Ile-Gly-His)。KMSKS 有助于氨基酸活化,HIGH 在氨基酸活化期间稳定 ATP 并使氨基酸转移的 tRNA 的 3' 端,C 末端α 螺旋结构域是 tRNA 反密码子的结合位点。作为蛋白质翻译必需的酶,TrpRS 是理想的抗菌药物靶点。创新霉素是游动放线菌产生的具有全新结构的天然产物,其抑制活性具有物种选择性,对细菌来源的 TrpRS 的亲和力是哺乳动物源的上千倍,故创新霉素是极具潜力的新靶点抗生素先导物。由于目前关于创新霉素和 TrpRS 的复合物结构尚未见报道,分子机制尚不清楚。从发现至今,创新霉素的研究进展缓慢,至今仍未广泛应用于临床。本文利用大肠杆菌异源表达系统可实现来自的BsTrpRS 的大量表达。采用 Co2+亲和层析、离子交换和分子排阻色谱等得到可用培养结晶的高纯度的样品。ITC 实验证明 BsTrpRS 与创新霉素可以形成稳定的复合体,利用共结晶法可培养 BsTrpRS/创新霉素复合体的单晶,为下一步解析BsTrpRS/创新霉素复合体的晶体结构,抑制机制和理性设计药物先导物打下了坚实的基础。
[1] Finch, R. Current challenges in antimicrobial resistance and healthcare-associated infections: role and organization of ARHAI.J Antimicrob Chemother, 2012, 67 Suppl 1:i3-i10.
[2] Wang YC. Overview of chuangxinmycin study. Chin Pharm J, 1992, 27(9):520-522. (in Chinese)
王玉成. 创新霉素研究概况. 中国药学杂志, 1992, 27(9):520-522.
[3] Liu ZY, Zhu JT, Jin J, et al. Synthesis and antibacterial activity evaluation of Chuangxinmycin prodrugs. Chin Med Biotechnol, 2016, 11(4):314-318. (in Chinese)
刘宗英, 朱俊泰, 金洁, 等. 创新霉素前药衍生物的合成及抗菌活性研究. 中国医药生物技术, 2016, 11(4):314-318.
[4] Pang YLJ, Poruri K, Martinis SA. tRNA synthetase: tRNA aminoacylation and beyond. Wiley Interdiscip Rev RNA, 2014, 5(4): 461-480.
[5] Williams TL, Yin WY, Carter CW Jr. Selective inhibition of bacterial tryptophanyl-tRNA synthetases by indolmycin is mechanism-based.J Biol Chem, 2016, 291(1):255-265.
[6] Fang P, Guo M. Evolutionary limitation and opportunities for developing tRNA synthetase inhibitors with 5-binding-mode classification. Life (Basel), 2015, 5(4):1703-1725.
[7] Brown MJ, Mensah LM, Doyle ML, et al. Rational design of femtomolar inhibitors of isoleucyl tRNA synthetase from a binding model for pseudomonic acid-A. Biochemistry, 2000, 39(20):6003- 6011.
[8] Xu XB, Liu J, Zhang JJ, et al. Nickel-mediated inter- and intramolecular C-S coupling of thiols and thioacetates with aryl iodides at room temperature. Org Lett, 2013, 15(3):550-553.
[9] Zuo LJ, Zhao W, Jiang ZB, et al. Identification of 3-demethylchuangxinmycin from Actinoplanes tsinanensis CPCC 200056. Acta Pharm Sinica, 2016, 51(1):105-109. (in Chinese)
左利杰, 赵薇, 江志波, 等. 济南游动放线菌CPCC 200056产生的3-去甲创新霉素发现与鉴定. 药学学报, 2016, 51(1):105-109.
[10] Shi Y, Jiang Z, Li X, et al. Biosynthesis of antibiotic chuangxinmycin from Actinoplanes tsinanensis. Acta Pharm Sinica B, 2018, 8(2):283- 294.
[11] Xu X, Zhou H, Liu Y, et al. Heterologous expression guides identification of the biosynthetic gene cluster of chuangxinmycin, an indole alkaloid antibiotic. J Nat Prod, 2018, 81(4):1060-1064.
[12] Doublié S, Bricogne G, Gilmore C, et al. Tryptophanyl-tRNA synthetase crystal structure reveals an unexpected homology to tyrosyl-tRNA synthetase. Structure, 1995, 3(1):17-31.
Prokaryotic expression and purification of tryptophanyl-tRNA synthetase fromand preliminary crystallographic study on its complex with chuagnxinmycin
FAN Shuai, LYU Guang-xin, JIN Yuan-yuan, YANG Zhao-yong
Author Affiliation: Department of Microbial Pathway Engineering, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Chinese Academy of Medical Sciences, Beijing 100050,China
Solving the crystal structure of Tryptophanyl-tRNA Synthetase (BsTrpRS) fromin complex with chuangxinmycin will provide us more insight into the function of chuangxinmycin in physiology and pharmacology, and also help us design and optimize the chuangxinmycin-based drugs.The soluble expression of BsTrpRS protein was obtained byexpression system. The target protein was purified by affinity chromatography, ion exchange chromatography and molecular size exclusion chromatography in order to obtain BsTrpRS, with purity of more than 90%. The binding affinity between BsTrpRS and chuangxinmycin was evaluated using isothermal titration calorimetry analysis. High quality crystal for X-ray diffraction was obtained on the protein crystallography beamline (BL18U1) at the Shanghai Synchrotron Radiation Facility by employing vapor diffusion suspension method.The recombinant plasmid containinggene was successfully constructed by molecular biological method, and the strain BL21 (DE3) with high expression of BsTrpRS protein was obtained by optimization. High purity BsTrpRS protein was obtained by affinity chromatography, ion exchange chromatography and molecular size exclusion chromatography. The binding affinity of the BsTrpRS/chuangxinmycin was 3.2 μmol/L. The complex crystals of BsTrpRS and chuangxinmycin was obtained at ptimum conditions (1.8 mol/L K2HPO4, 0.75% v/v 1,3-propylene glycol, pH 7.6, 37 ℃), and the resolution of diffraction data up to 2.06 Å. The Matthews coefficient of the crystal is 2.48 Å3/Da, which corresponds to nearly 50.46% solvent content with two subunits of BsTrpRS protein in the asymmetric unit.The crystal structure of BsTrpRS with chuangxinmycin is expected to provide guidance and basis for the optimization and design of small molecular analogues of chuangxinmycin.
chuangxinmycin; tryptophanyl-tRNA synthetase; co-crystallization; X-ray diffraction
YANG Zhao-yong, Email: zhaoyongy@imb.pumc.edu.cn
中国医学科学院医学与健康科技创新工程项目(2019-I2M- 1-005);国家自然科学基金面上项目(81872782)
杨兆勇,Email:zhaoyongy@imb.pumc.edu.cn
2020-12-15
10.3969/j.issn.1673-713X.2021.03.005

