不同饮食摄入对小鼠糖脂代谢、肠道菌群的影响
周青青,蒋丰岭,王家妮,罗雅亭,程如越,沈曦,李鸣,何方
(四川大学华西公共卫生学院,四川 成都 610041)
近年来,随着经济的飞速发展和生活水平的提高,人们的生活方式、饮食结构也发生了很大的改变。同时,肥胖症、心血管疾病、非酒精性脂肪肝(non-alcoholic fatty liver diseases,NAFLD)等代谢相关疾病逐渐成为威胁人类健康的主要因素[1]。目前的研究发现,除先天的基因影响,不健康的饮食习惯在代谢性疾病的发病中发挥着重要作用[2],比如已有研究表明高脂饮食和高脂高胆固醇饮食是诱导肥胖和非酒精性脂肪肝的重要风险因子[3]。
越来越多的证据表明,肠道菌群能够调节膳食脂肪、脂溶性维生素的吸收,碳水化合物的分解及氨基酸合成等[4],肥胖、NAFLD等代谢性疾病与肠道菌群结构的改变和多样性失调关系密切[5]。研究显示高脂、高胆固醇饮食会导致肠道菌群的结构发生变化,体现在拟杆菌门和双歧杆菌水平下降,厚壁菌门和变形菌门水平上升。动物实验和人体研究都有证据表明肥胖个体肠道中厚壁菌门与拟杆菌门比例(F/B)会增加[6-7],而F/B的上升被认为是许多代谢相关疾病肠内细菌异常的重要特征[8-9]。
短链脂肪酸(short-chain fatty acids,SCFAs)和胆汁酸是肠道菌群的主要代谢产物。短链脂肪酸是含碳原子数6个及以下的挥发性有机脂肪酸,在肠道中乙酸、丙酸和丁酸的含量较高,具有保护肠黏膜屏障、提供能量、调节免疫、抗肿瘤等多种生理功能[10]。胆汁酸的主要作用是乳化脂肪,有利于脂溶性食物的消化吸收。研究表明,肠道菌群能够通过激活核胆汁酸的法尼醇X受体(farnesol X receptors,FXR)信号通路调节胆汁酸代谢,促进NAFLD的发展[11]。因此,深入了解饮食对肠道菌群代谢产物的影响可进一步明确肠道菌群和宿主代谢性疾病的关系。
由于目前国内外的研究更多是关于高脂饮食与肠道菌群及机体代谢的关系,对含胆固醇的高脂高胆固醇饮食的比较研究还较少,因此,本研究拟采用高脂饮食和高脂高胆固醇饮食喂养小鼠,观察不同饮食摄入对小鼠糖脂代谢、肠道菌群及其代谢产物的影响,为进一步阐明膳食与肥胖、NAFLD等代谢性疾病的关系提供理论依据。
1 材料与方法
1.1 试剂与仪器
乙醚(色谱纯)、无水乙醇(分析纯):成都金山化学试剂有限公司;血糖试纸:上海罗氏制药有限公司;高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、肝脏 TC、肝脏 TG 测定试剂盒:长春汇力生物技术有限公司;粪便细菌DNA提取试剂盒:北京天根生化科技北京有限公司;AMPure XT磁珠:美国Beckman Coulter公司;Qubit试剂盒:美国Invitrogen公司;Accu-Chek Active活力型血糖仪:上海罗氏制药有限公司。
1.2 实验动物及分组处理
四周龄无特定病原体(specific pathogen free,SPF)级雌性BALB/c小鼠30只[许可证号:SCXK(川)2020-030],购自成都达硕生物科技有限公司,小鼠饲养于四川大学华西公共卫生学院实验动物中心(实验许可证号:SYXK2018-011),将小鼠随机分为普通饮食组(normal diet,ND)、高脂饮食组(high fat diet,HFD)和高脂高胆固醇饮食组(high fat high cholesterol diet,HFHCD),每组10只,ND组采用普通饲料(三大营养素供能比分别为脂肪10%,碳水化合物70%,蛋白质20%);HFD组采用高脂饲料(D12492,美国 Research Diets,三大营养素供能比分别为脂肪60%,碳水化合物20%,蛋白质20%);HFHCD组采用高脂高胆固醇饲料(D12109C,美国Research Diets,三大营养素供能比分别为脂肪40%,碳水化合物40%,蛋白质20%),喂养12周至实验结束。高脂饲料每4 057 kcal添加1 mg胆固醇,高脂高胆固醇饲料每4 057 kcal添加11.25 g胆固醇。
1.3 体重及脏器系数测定
每周测定小鼠体重。实验结束后,准确称量小鼠肝脏、脾脏、肾脏、胰腺、腹腔脂肪。计算小鼠的脏器系数和脂体比。脏器系数=脏器重量(mg)/体重(g),腹腔脂肪脂体比=脂肪重量(mg)/体重(g)。
1.4 空腹血糖及口服葡萄糖耐量测定
小鼠禁食不禁水8 h,尾尖采血并用血糖仪测定小鼠的空腹血糖(fasting blood glucose,FBG)(0 min),后每只小鼠按体重经口灌胃2.0 g/kg葡萄糖,使用血糖仪测定灌胃后30、60、90、120 min的血糖值。
1.5 血脂和肝脏脂质测定
用全自动生化分析仪检测血清高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、总胆固醇(TC)、总甘油三酯(TG)。肝脏组织经磷酸缓冲盐溶液匀浆后离心处理,按试剂盒说明书测定肝脏TC、TG。
1.6 粪便细菌基因组DNA提取
收集小鼠粪便冻存于-80℃,按照粪便细菌总DNA提取试剂盒说明书的步骤提取粪便样品中的DNA。
1.7 16SrDNA测序和生物信息学分析
将引物的5′端连上barcode和测序通用引物。在含有50 ng模板DNA的25 μL反应混合物(用ddH2O调整体系容积到25 μL)中进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,上游引物:338F 5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物:806R 5′-GGACTACHVGGGTWTCTAAT-3′[12],各 2.5 μL。反应体系还包括12.5 μL PCR染液。反应程序:98℃ 30 s;98 ℃ 10 s,54℃30 s,72℃ 45 s,35个循环。PCR 产物经AMPure XT磁珠纯化后,经Qubit试剂盒定量和文库检测,使用 bcl2fastq(v1.8.4)和 FLASH 软件(v1.2.11)对原始测序数据进行预处理,采用Qiime(v1.9.1)进一步分析序列,相似性在97%以上的序列将通过序列聚类得到操作分类单元(operational taxonomic units,OTU),并生成OTU表,同时,对OTU进行丰度、Alpha多样性计算,以分析样品内物种丰富度和均匀度信息。根据二代测序结果,分别在门、属水平上选择相对丰度大于0.1%的群落进行优势菌群分析。
1.8 粪便胆汁酸和盲肠短链脂肪酸检测
每只小鼠取100 mg粪便,离心收集上清液,用液相色谱质谱仪检测胆汁酸。收集小鼠盲肠内容物,取100 mg粪便于离心管中,加入内标(异己酸)溶液和乙醚固定,用气相色谱法测定粪便中的乙酸、丙酸和丁酸含量。
1.9 数据处理与分析
采用Graphpad prism 7.0软件对数据进行统计分析,服从正态分布的计量资料用均数±标准差(±s)表示,并采用单因素方差分析对服从正态分布的多组独立样本进行组间比较。p<0.05被认为具有统计学意义,检验均为双尾。
2 结果与分析
2.1 小鼠体重和血糖
不同饮食摄入组小鼠的体重变化见图1。

图1 实验期间不同饮食摄入各组小鼠的体重变化Fig.1 Changes in body weight of mice in different diets during the experiment
由图1可知,实验期间3组小鼠体重稳步增长,但差异不显著。
对3组小鼠尾尖采血进行空腹血糖和口服葡萄糖耐量测定见图2。
由图2可知,HFD、HFHCD组小鼠0 min空腹血糖高于ND组(p<0.05),30 min血糖ND组和HFD组均显著高于 HFHCD 组(p<0.05),且在 60、90、120 min血糖均呈现出HFD组显著高于ND组和HFHCD组,差异具有统计学意义(p<0.05)。
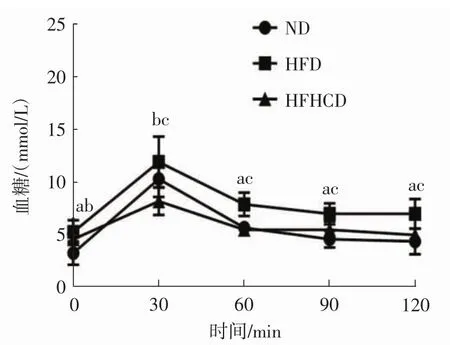
图2 各组小鼠口服葡萄糖耐量试验测定结果Fig.2 Oral glucose tolerance test results of mice in each group
2.2 小鼠肝脏系数和脂体比
实验结束后准确称量各组小鼠肝脏和脂肪重量,计算所得的肝脏系数见图3,脂体比结果见图4。

图3 各组小鼠肝脏系数结果Fig.3 Liver coefficient results of mice in each group
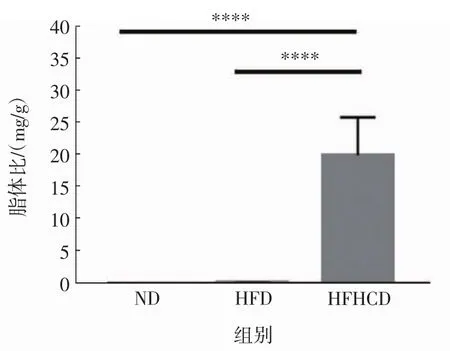
图4 各组小鼠脂体比结果Fig.4 Liposome ratio of mice in each group
由图3、图4可知,HFHCD组小鼠的肝脏系数和脂体比均显著高于ND组和HFD组(p<0.000 1),而ND组和HFD组小鼠之间没有统计学差异(p>0.05)。
2.3 小鼠血脂和肝脏脂质水平
实验结束,用全自动生化分析仪检测小鼠血脂水平见图5,肝脏脂质结果见图6。
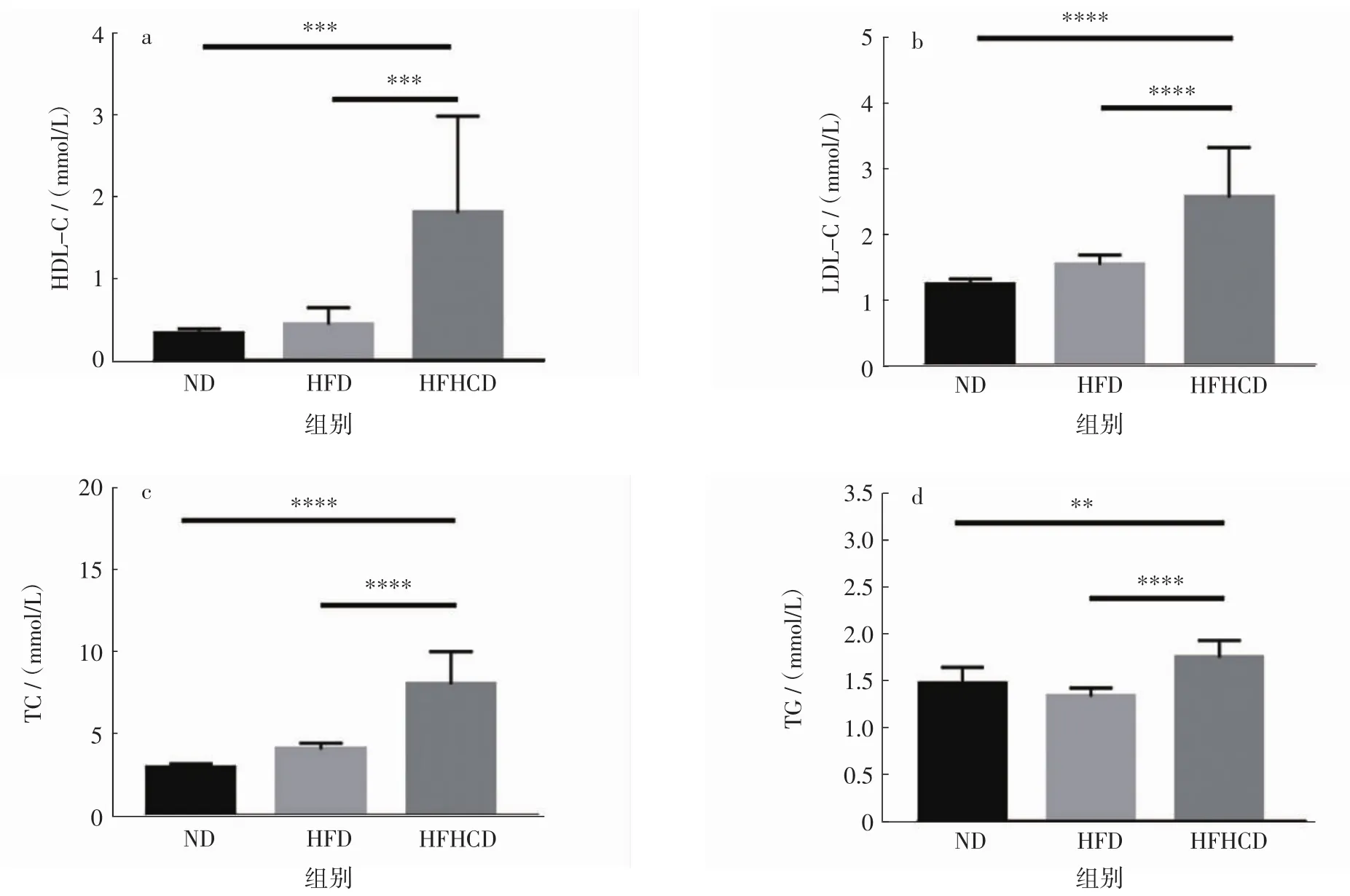
图5 各组小鼠血清HDL-C、LDL-C、TC、TG测定结果Fig.5 The determination results of serum HDL-C,LDL-C,TC and TG in each group of mice
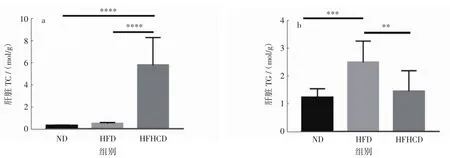
图6 各组小鼠肝脏TC、TG测定结果Fig.6 Results of determination of TC and TG in liver of mice in each group
由图5可知,HFHCD组小鼠血清的 HDL-C、LDL-C、TC和TG水平均高于ND组和HFD组小鼠,HFD组和ND组小鼠的血脂水平差异无统计学意义(p>0.05)。
由图6可知,本次实验中HFHCD组小鼠的肝脏TC含量显著高于ND组和HFD组(p<0.000 1)。HFD组小鼠的肝脏TG显著高于ND组和HFHCD组(p<0.01),HFHCD组与ND组的肝脏TG差异不显著(p>0.05)。
2.4 小鼠粪便肠道菌群多样性与群落结构分析
2.4.1 小鼠粪便肠道菌群多样性分析
主坐标分析(principal co-ordinates analysis,PCoA)用于研究样本群落组成的相似性或差异性,各组小鼠肠道菌群主坐标分析结果见图7。

图7 各组小鼠肠道菌群主坐标分析(PCoA)Fig.7 Principal coordinate analysis(PCoA)of intestinal flora of mice in each group
图7中每个点表示一个样本,相同形状代表同一组,当同种形状的点距离越近,不同形状的点距离越远时,表示不同组菌群结构差异越明显[13],由图7可知,3组间群落远远分开,HFD、HFHCD和ND组均具有明显差异。
Alpha多样性分析能反映特定生态系统内微生物群落的丰富度和均匀度,采用Alpha多样性分析指数进行统计,结果见表1。Observed_species指数和Chao1指数越大,说明菌群丰富度越高,Shannon指数越大,说明群落多样性越高,PD_whole_tree指数越大说明菌群对进化历史保存的差异越大。
由表1可知,HFHCD组小鼠的Shannon、Chao1、PD_whole_tree和Observed_species指数均显著低于ND组和HFD组(p<0.05),粪便菌群多样性和丰富度均降低;与ND组相比,HFD组肠道菌群α多样性相关指数有下降趋势,但差异没有统计学意义(p>0.05)。
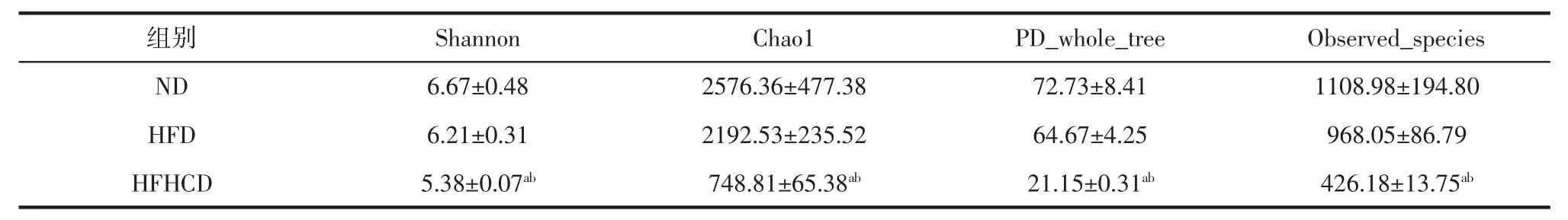
表1 α-多样性指数(n=4/组)Table 1 α-Diversity index(n=4/group)
2.4.2 小鼠粪便肠道菌群群落结构分析
表2、表3分别表示3组小鼠肠道菌群在门水平、属水平上的注释结果。
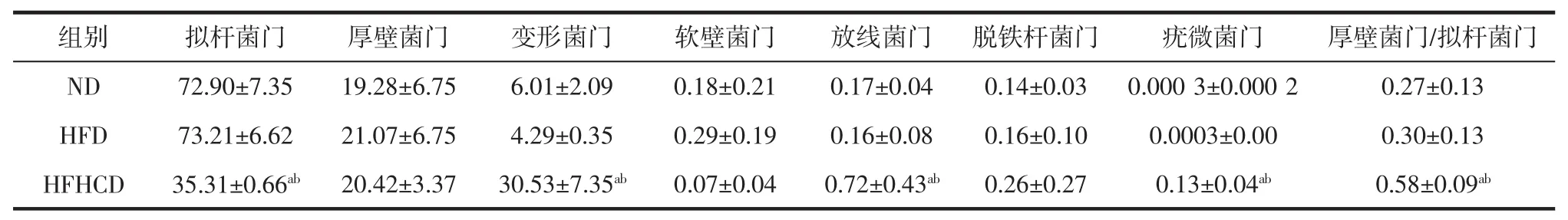
表2 各组小鼠肠道菌群门水平相对丰度前六特征菌(n=4/组)Table 2 The top six characteristic bacteria in the relative abundance of the intestinal flora of each group of mice(n=4/group) %
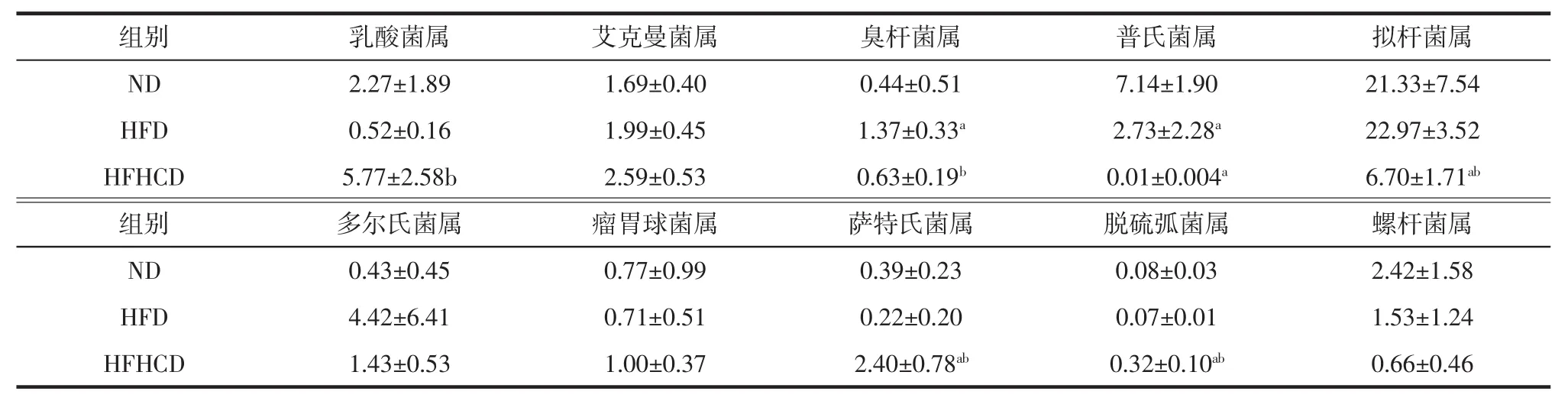
表3 各组小鼠肠道菌群属水平相对丰度前十特征菌(n=4/组)Table 3 The top ten characteristic bacteria in the relative abundance of the intestinal flora of each group of mice(n=4/group) %
由表2可知,在门分类水平上,ND组和HFD组小鼠优势菌由拟杆菌门、厚壁菌门、变形菌门组成;HFHCD组小鼠的拟杆菌门相对丰度显著低于ND组和HFD组(p<0.05),而变形菌门、疣微菌门、放线菌门相对丰度、厚壁菌门和拟杆菌门比例显著高于ND组和HFD组(p<0.05),3组间厚壁菌门相对丰度无显著差异。
由表3可知,在属水平,与ND组相比,HFD和HFHCD组小鼠的普氏菌属均显著减少。HFD组的臭杆菌属显著高于ND组和HFHCD组。与ND组和HFD组相比,HFHCD组小鼠的拟杆菌属、萨特氏菌属、脱硫弧菌属和艾克曼菌属显著升高;与HFHCD组比较,乳酸菌属含量显著高于HFD组,而与ND组无显著差异。
2.5 粪便胆汁酸和盲肠短链脂肪酸
实验结束后测定各组小鼠的胆汁酸水平,包括脱氧胆酸和胆酸两项指标,结果见图8。
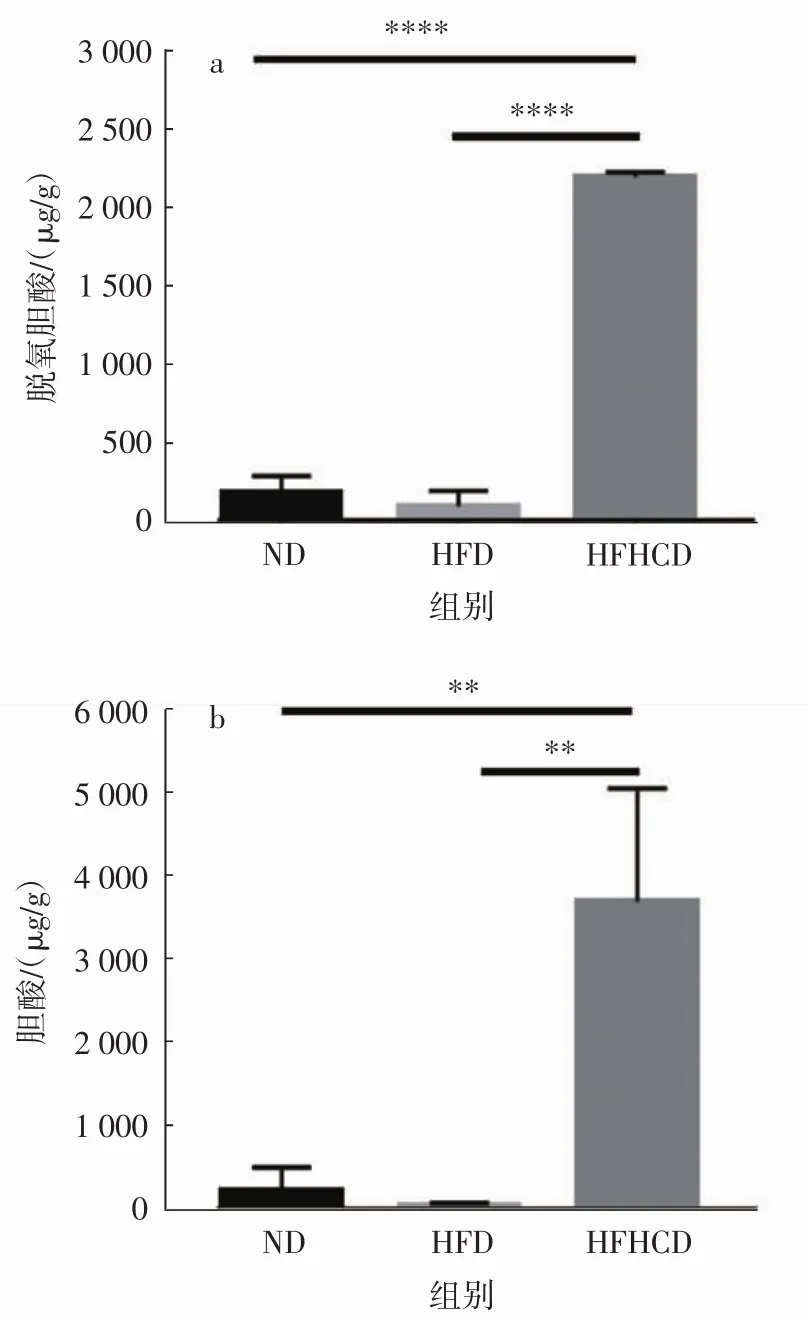
图8 各组小鼠胆汁酸测定结果Fig.8 Deoxycholic acid and cholic acid determination results of mice in each group
图8显示HFHCD组小鼠的脱氧胆酸、胆酸含量均显著高于ND组和HFD组。
采集3组小鼠粪便,测定粪便中乙酸、丙酸和丁酸3种短链脂肪酸含量,结果见表4。
由表4可知,HFD组小鼠的丙酸、丁酸含量显著低于ND组(p<0.05),其它各组差异不显著。

表4 各组小鼠粪便短链脂肪酸含量(n=3/组)Table 4 The content of short-chain fatty acids in the feces of mice in each group(n=3/group)
3 讨论
本研究分别使用高脂饲料和高脂高胆固醇饲料喂养两组实验小鼠,模拟了当前较为普遍的西方饮食习惯。两种饮食均导致小鼠空腹血糖显著上升,且高脂饮食组小鼠的OGTT结果显示,其60、90 min和120 min血糖均显著高于普通饮食组和高脂高胆固醇组。Utzschneider等用高脂饮食诱导大鼠发生早期糖尿病症状时,其空腹血糖水平升高[14-15]。这些结果说明高脂饮食和高脂高胆固醇饮食均可导致小鼠血糖调节受损,且高脂饮食对糖代谢异常的影响强于高脂高胆固醇饮食。
肝脏是胆固醇代谢转变的重要场所,本研究发现小鼠摄入的含量较高的脂肪和胆固醇不能被完全代谢,大量蓄积在腹腔脂肪和肝脏中,导致了机体肝脏胆固醇水平以及血脂水平异常。而单纯摄入高脂饮食仅造成了肝脏甘油三酯蓄积,对整体的脂代谢影响并不显著。付晓昉等研究发现长期高脂饮食不仅使小鼠脂代谢紊乱,还导致血清游离脂肪酸水平升高,多个组织器官发生胰岛素抵抗[16]。这些结果表明高脂饮食导致的脂代谢异常可能需要较长时间持续作用,而高脂高胆固醇饮食对于机体脂代谢和胆固醇代谢的影响是显著的,且明显强于高脂饮食,这可能与大量的胆固醇导致的肝脏代谢功能障碍有关。
高脂高胆固醇饮食显著降低了肠道菌群α多样性,在门水平上,HFHCD组小鼠肠道F/B较ND组和HFD组显著升高。高F/B的个体从相同食物中获得的能量较普通个体更高,高F/B已被证实与啮齿类和人类肥胖相关[17]。高脂高胆固醇饮食显著增加了小鼠肠道变形菌门含量,远大于高脂饮食的影响,说明高胆固醇摄入可能更能诱导肠道变形菌门增加。在属水平,HFHCD组乳杆菌属较单纯的HFD组显著增加,与高脂高胆固醇饮食与NAFLD关联性相一致。有研究发现在NAFLD患者与健康人群的比较中,患非酒精性脂肪肝病人群肠道中乳酸杆菌属的种类有所增加,而瘤胃菌属减少,乳杆菌可能与挥发性有机化合物如乙酸盐和乙醇的产生有关[18],这也许与肥胖和NAFLD的发病机制有关。高脂高胆固醇饮食还显著降低了拟杆菌属含量,使艾克曼菌属(Akkermansia)显著增加;与ND组相比,HFD和HFHCD组小鼠的普氏菌属均显著减少。研究表明,拟杆菌属和普氏菌属这两种肠道细菌都与碳水化合物的分解能力有关[19]。Akkermansia能改善糖尿病小鼠的肝脏功能,降低葡萄糖和脂质代谢异常,减轻氧化应激,抑制炎症反应[20]。这些结果表明高脂高胆固醇饮食可导致肠道菌群多样性降低且群落结构异常,而高脂饮食对肠道菌群的影响较为有限。
SCFAs被证实可以直接影响宿主代谢,与肠上皮屏障功能及免疫系统密切关联[21],可能对肥胖及相关代谢紊乱有改善作用[22-23],SCFAs减少可能导致葡萄糖和脂质代谢减弱、免疫力下降和肠道菌群多样性减少。本研究中,只有高脂饮食引起小鼠丙酸、丁酸含量较普通饮食组显著减少,而高脂高胆固醇饮食对SCFAs产量无显著影响,表明小鼠肠道SCFAs代谢可能对膳食脂肪更为敏感,而与胆固醇的含量无明显关联。
胆汁酸能够调节机体胆固醇的水平,Yoshimoto等[24]研究表明,肥胖动物肠道中增加的脱氧胆酸可以与肠道细菌结合,通过肠肝循环到达肝脏,可诱导肝组织的炎症和肿瘤的发生。本研究中,HFHCD组小鼠的脱氧胆酸、胆酸含量均显著高于ND组和HFD组,说明胆固醇的添加促进了肠道内次级胆汁酸的生成,这可能与改变的肠道菌群结构有关,即高胆固醇饮食可能富集了肠道内代谢胆汁酸的细菌。NAFLD的发病机制目前尚未完全明确,但多项研究表明其与饮食、肠道菌群和胆汁酸水平相关。Devkota等[25]的研究表明,饮食中的脂肪酸能够通过改变胆汁酸池中的胆汁酸成分,进而使肠道菌群发生改变。
4 结论
综上所述,本研究结果进一步显示了饮食对机体糖脂代谢、肠道菌群及其代谢产物的影响。高脂高胆固醇饮食导致小鼠腹腔脂肪蓄积、血脂、肝脏脂质和胆固醇代谢异常,肠道菌群多样性降低且群落结构紊乱以及肠道内次级胆汁酸的增加;而高脂饮食造成了糖代谢异常、肝脏甘油三酯的显著升高和肠道菌群结构的轻度异常以及丙酸、丁酸含量的降低。表明高脂饮食和高脂高胆固醇饮食都是代谢性疾病的危险因素,且高脂高胆固醇饮食的影响可能更大,再次证明了饮食、肠道菌群与代谢性疾病的密切关系。同时表明不同饮食成分可通过不同的作用机理影响肥胖、非酒精性脂肪肝等代谢性疾病的发生。因此饮食相关的代谢性疾病防治上需要根据不同的饮食内容制定不同的对策,但各种饮食相关的代谢性疾病在肠道菌群方面的发病机制还需要进一步研究。

