响应面优化提取山茱萸籽油及其对游泳运动大鼠生理生化指标的影响
贡新烨,蔡协清
(南京工业大学,江苏 南京 211816)
山茱萸属于山茱萸科山茱萸属植物,在我国有着悠久的种植历史[1],主产于山西、陕西、山东、江苏、浙江等省份[2]。山茱萸作为我国名贵木本药材之一,通常以干燥成熟果肉入药,其富含多种营养成分[3],包括碳水化合物、维生素C,柠檬酸、黄酮类化合物、熊果苷等成分。山茱萸籽约占整个果实质量的80%,是其果肉药物化利用后的主要废弃部分[4-5]。因此,对山茱萸籽资源的研究有利于提高山茱萸的综合利用价值。
山茱萸籽油中富含多种不饱和脂肪酸,其中油酸含量大约为35.8%,亚油酸含量大约为34.6%[6]。摄入不饱和脂肪酸对于人体的健康有至关重要的作用,其中亚油酸是人体自身无法合成的必需脂肪酸,主要的功能是软化血管,并在新陈代谢过程中起着重要的作用,亚油酸可以降低机体的血脂血压,起到预防动脉粥样硬化和心脑血管疾病等功效[7]。另外,山茱萸籽油中还含有多酚类成分,其具有较强的抗氧化活性,对自由基有较好的清除作用。鉴于山茱萸籽油具有良好的利用价值,本文将采用微波辅助溶剂法来制备山茱萸籽油,并研究其对游泳运动大鼠生理生化指标变化的干预影响。
1 材料与方法
1.1 材料与试剂
山茱萸籽:定远县琪荣农林种养经营部;石油醚(30℃~60℃)、无水乙醇、正己烷、丙酮(分析纯):天津市科密欧化学试剂有限公司;血糖试剂盒、甘油三酯试剂盒、血尿素氮(blood urea nitrogen,BUN)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、肌酸激酶(creatine kinase,CK)试剂盒、谷草转氨酶[glutamic-oxal(o)acetic transaminase,GOT]试剂盒、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)试剂盒:南京建成生物工程所。
SPF 级雄性 SD 大鼠:40只,体重在(150±5)g,浙江普康生物技术股份有限公司,SYXK(浙)2019-0032。
1.2 仪器与设备
XL-500型粉碎机:南京耀天干燥设备有限公司;MKX-E1A型微波萃取仪:青岛迈威微波化学设备有限公司;J-SKY型分析天平:巨鼎天衡(苏州)称重设备有限公司;DHG-9055A型鼓风干燥机:金坛区金城致杰实验仪器厂;TG16-WS型高速离心机:常州金坛良友仪器有限公司;HH-s6型恒温水浴锅:济南欧莱博科学仪器有限公司。
1.3 方法
1.3.1 山茱萸籽油的提取
提取工艺流程如下[9-10]。
挑选山茱萸籽→干燥→粉碎→加入提取溶剂→微波辅助→减压蒸馏→干燥至恒重
挑选无虫蛀山茱萸籽,45℃干燥3 h,去除水分,粉碎至60目,得到山茱萸籽粉末。称取适量的山茱萸籽粉末,放置于锥形瓶中,加入一定液料比的提取溶剂,放置于微波萃取仪中,在不同的微波功率、提取温度、提取时间下进行提取,提取结束后,蒸馏出溶剂,并在45℃下干燥至恒重得到山茱萸籽油。
Y/%=(M1-M2/m)×100
式中:Y为山茱萸籽油得率,%;M1为山茱萸籽油质量,g;M2为锥形瓶质量,g;m为山茱萸籽粉末质量,g。
1.3.2 单因素试验
固定提取温度40℃、提取时间50 min、微波功率300 W,设定不同液料比 4∶1、6∶1、8∶1、10∶1、12∶1(mL/g);固定提取时间 50 min、微波功率 300 W、液料比 8∶1(mL/g),设定不同提取温度 30、35、40、45、50℃;固定提取温度40℃、液料比8∶1(mL/g)、微波功率300 W,设定不同提取时间 30、40、50、60、70 min;固定提取温度40℃、液料比8∶1(mL/g)、提取时间50 min,设定不同微波功率 100、200、300、400、500 W,研究各因素对山茱萸籽油得率的影响。
1.3.3 动物分组及运动方案
选取SPF级雄性SD大鼠40只,体重(150±5)g,大鼠分笼饲养,饲养温度(23±2)℃。随机分成2组,每组20只大鼠,分成对照组、实验组。大鼠空腹过夜后,将大鼠放入到游泳池内,大鼠的尾部负重其体重5%的铅丝,从大鼠进入到游泳池开始,到大鼠力竭(头部沉入水中8 s不能浮出)的这段周期记为游泳时间[11]。实验组游泳前,20只大鼠灌胃10 mg/g山茱萸籽油,游泳力竭后,20只大鼠再次灌胃10 mg/g山茱萸籽油(灌胃剂量参照程耀明的小鼠实验方法并加以改进[12]);对照组20只大鼠游泳前后各灌胃蒸馏水10mg/g,试验时间持续6周。游泳前和游泳2 h后,采取眼眶血,离心取血浆,并对血糖、甘油三酯、血尿素氮(BUN)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、肌酸激酶(CK)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)等指标根据试剂盒的说明书检测分析。
1.4 统计学分析
本文使用SPSS 18.0软件进行数据分析,数据均使用均值±标准差来表示,采取组间进行对比,P<0.05表示具有统计学意义。
2 结果与分析
2.1 提取溶剂对山茱萸籽油得率的影响
以山茱萸籽油得率为考察指标,考察4种提取溶剂对山茱萸籽油得率的影响,结果见图1。

图1 提取溶剂对山茱萸籽油得率的影响Fig.1 Effect of extraction solvent on yield of Cornus officinalis seed oil
从图1可知,正己烷相比于其它3种溶剂对山茱萸籽油得率的影响最大,所以选择正己烷作为提取溶剂进行后续试验[13]。
2.2 单因素试验
2.2.1 液料比对山茱萸籽油得率的影响
液料比对山茱萸籽油得率的影响见图2。

图2 液料比对山茱萸籽油得率的影响Fig.2 Effect of liquid to material ratio on the yield of Cornus officinalis seed oil
由图2可知,随着液料比的增加,山茱萸籽油得率逐渐提高,当液料比为10∶1(mL/g)时,得率达到最高。这是由于液料比的增加使得物料与溶剂之间接触更充分,有利于油脂的提取,继续增大液料比,会使得油脂与提取溶剂之间分离时间变长,成本上升,同时溶剂量增加会使得山茱萸籽内多余成分析出,影响得率[14],故选择液料比为 10∶1(mL/g)。
2.2.2 提取温度对山茱萸籽油得率的影响
提取温度对山茱萸籽油得率的影响见图3。

图3 提取温度对山茱萸籽油得率的影响Fig.3 Effect of extraction temperature on yield of Cornus officinalis seed oil
由图3可知,随着提取温度的增加,山茱萸籽油得率逐渐升高,当提取温度升高到40℃时,得率达到最高,继续提高温度,得率出现降低趋势。这是因为温度的升高,使得油脂易析出到溶剂中,而温度过高会导致溶剂挥发,造成得率降低[15],故选择提取温度为40℃。
2.2.3 提取时间对山茱萸籽油得率的影响
提取时间对山茱萸籽油得率的影响见图4。

图4 提取时间对山茱萸籽油得率的影响Fig.4 Effect of extraction time on yield of Cornus officinalis seed oil
由图4可知,随着提取时间的增加,山茱萸籽油得率逐渐升高,在提取时间为60 min时达到最高,继续延长时间,得率不再升高。因此,选择提取时间为60min。
2.2.4 微波功率对山茱萸籽油得率的影响
微波功率对山茱萸籽油得率的影响见图5。
由图5可知,随着微波功率的加强,山茱萸籽油得率逐渐升高,在微波功率为400 W时达到最高,继续加强微波功率,得率出现降低趋势。微波功率的加强,可以使山茱萸籽内的细胞破碎速度加快,进而使油脂更容易析出到溶剂中,继续增加微波功率会使得溶剂挥发加剧,导致溶剂流失,得率降低[16]。因此,选择微波功率为400 W。

图5 微波功率对山茱萸籽油得率的影响Fig.5 Effect of microwave power on yield of Cornus officinalis seed oil
2.3 响应面法试验结果与分析
在单因素试验的基础上,以山茱萸籽油得率(Y)为指标,选择液料比(X1)、提取温度(X2)、微波功率(X3)为因素,进行三因素三水平响应面试验设计,试验因素与水平见表1。

表1 Box-Behnken试验设计因素水平Table 1 Box Behnken design factor level
响应面分析方案与结果见表2,方差分析见表3。

表2 Box-Behnken试验设计与结果Table 2 Box Behnken experimental design and results
利用Design-Expert软件对表3试验数据进行分析,得到微波辅助溶剂法提取山茱萸籽油的多元回归方程:Y=31.18+0.47X1+0.59X2+0.13X3+0.070X1X2-0.16X1X3-0.31X2X3-0.96X12-1.02X22-1.57X32。
由表3可知,模型P<0.01(极显著),失拟项P值为0.150 5(不显著),因变量与所有自变量之间的线性关系显著R2=0.997 5,R2Adj=0.994 3,说明该方程的拟合度较好,表明回归模型达到极显著,可以反映得率和各因素之间的关系,试验误差小,试验预测数据具有良好的可靠性,故可以用该模型对山茱萸籽油的提取试验进行预测和分析。
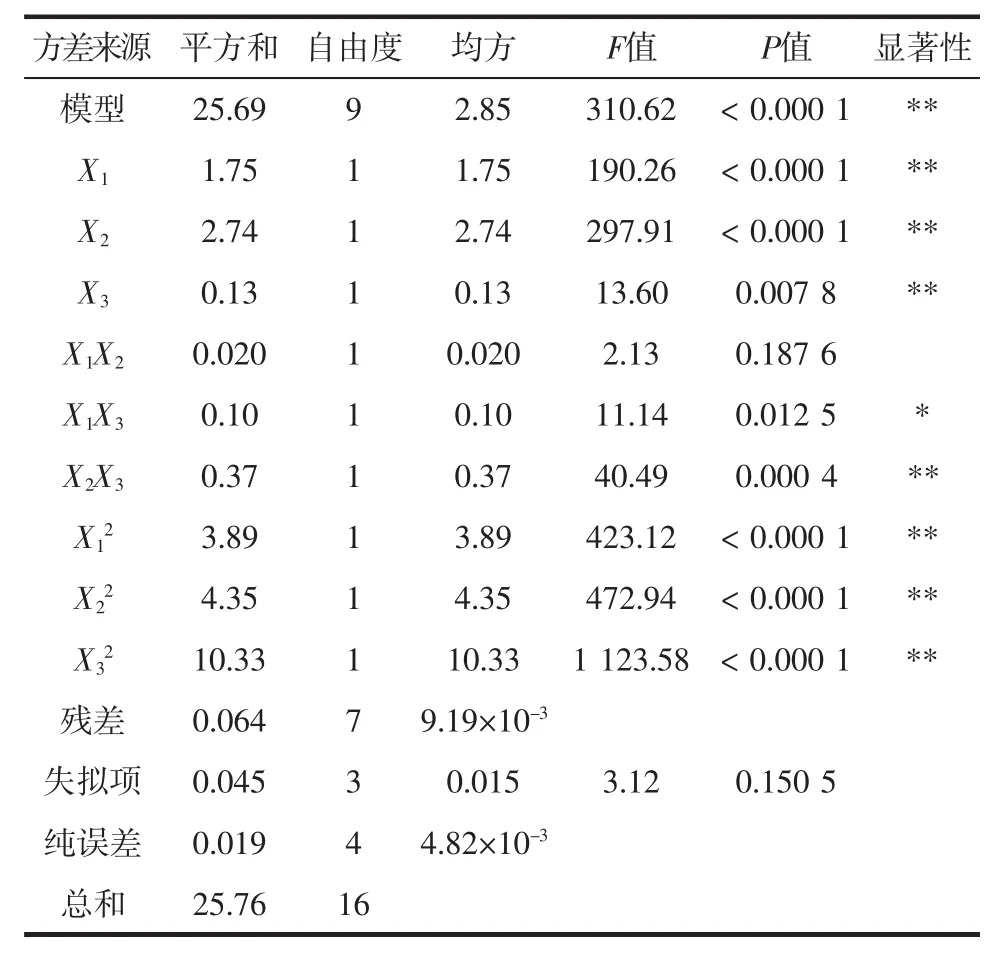
表3 响应面回归模型ANOVA分析结果Table 3 ANOVA analysis results of response surface regression model
从各个因素的显著性水平差异可知,液料比、提取温度、微波功率影响为极显著,对山茱萸籽油得率影响顺序为,提取温度>液料比>微波功率,X1X3达到显著水平(P<0.05)、X2X3达到极显著水平(P<0.01),并且各个因素的二次项对山茱萸籽油得率的影响均达到了极显著水平(P<0.01)。
试验得出山茱萸籽油最佳提取条件为:液料比10.51∶1(mL/g)、提取温度41.49℃、微波功率 399.79W,在此条件下山茱萸籽油的得率为31.33%。根据试验的可操作性,将试验条件调整为液料比11∶1(mL/g)、提取温度41℃、微波功率400 W,进行3次验证试验,得出山茱萸籽油平均得率为31.25%,与预测值相近。因此,响应面法优化得到的山茱萸籽油工艺条件准确可靠。
2.4 山茱萸籽油对游泳运动大鼠游泳时间的影响
山茱萸籽油对游泳运动大鼠游泳时间的影响见图6。
由图6可知,实验组大鼠游泳时间显著大于对照组大鼠,表明山茱萸籽油具有明显的延长游泳时间的作用,能够提高大鼠的耐力,缓解疲劳[17]。
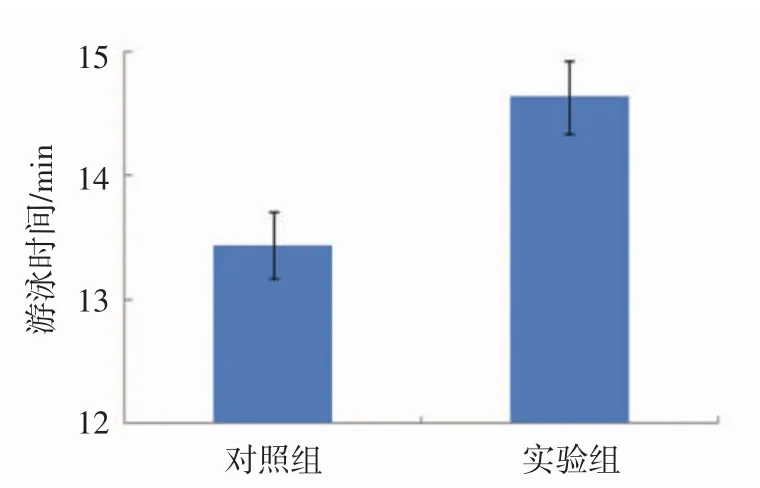
图6 山茱萸籽油对游泳运动大鼠游泳时间的影响Fig.6 Effect of Cornus officinalis seed oil on swimming time of swimming rats
2.5 山茱萸籽油对游泳运动大鼠血液生理生化指标变化的干预影响
山茱萸籽油对游泳运动大鼠血液生理生化指标变化的干预影响见表4。
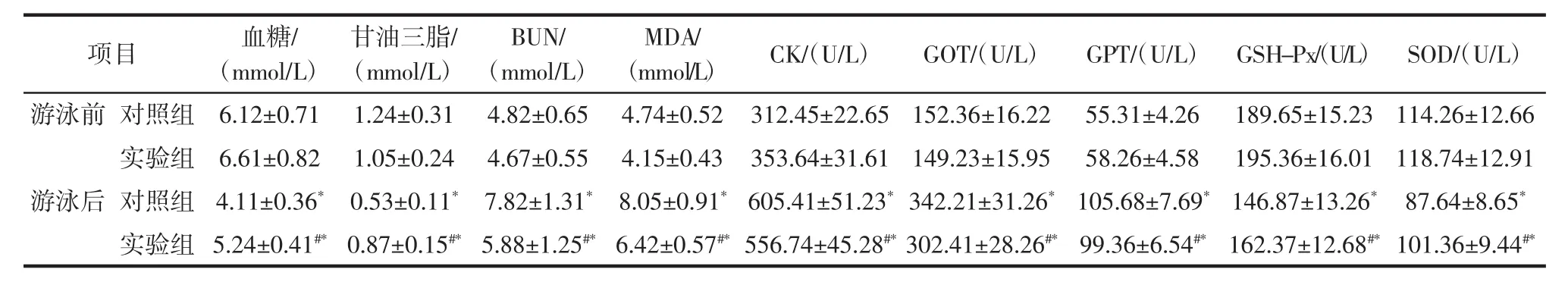
表4 山茱萸籽油对游泳运动大鼠血液生理生化指标变化的干预影响Table 4 Intervention effect of Cornus officinalis seed oil on blood physiological and biochemical index changes of swimming rats
从表4得出,游泳前2组大鼠各项指标均在正常范围内,没有显著性差异(P>0.05)。对照组大鼠游泳后血糖、甘油三酯、GSH-Px、SOD水平明显下降(P<0.05),对照组大鼠游泳后 BUN、MDA、CK、GOT、GPT水平明显升高(P<0.05),实验组大鼠游泳后与对照组大鼠游泳后相比,血糖、甘油三酯、GSH-Px、SOD水平呈升高趋势(P<0.05),BUN、MDA、CK、GOT、GPT 水平呈降低趋势(P<0.05)。说明大鼠经过游泳力竭运动之后体内肝脏、肌肉等脏器组织代谢加快,代谢产物堆积,体内产生大量的自由基,这些机体内脂质过氧化反应的代谢产物对细胞具有严重的损伤作用[18-20]。而游泳后实验组大鼠经过灌胃山茱萸籽油,各项指标均明显优于灌胃蒸馏水的对照组,山茱萸籽油由于含有多酚类成分,其具有较强的抗氧化活性,对自由基有较好的清除作用,同时山茱萸籽油中富含多种不饱和脂肪酸,可以起到促进体内脂肪分解的作用,并且可以降低机体的血脂,起到对大鼠生理生化指标变化的干预作用。
3 结论
采用微波辅助溶剂法提取制备山茱萸籽油,得出最佳提取条件为:液料比11∶1(mL/g)、提取温度41℃、微波功率400 W。大鼠游泳运动实验表明,对照组大鼠游泳后血糖、甘油三酯、GSH-Px、SOD水平明显下降(P<0.05),对照组大鼠游泳后 BUN、MDA、CK、GOT、GPT水平明显升高(P<0.05),同时灌胃山茱萸籽油的实验组大鼠游泳后与对照组大鼠游泳后相比血糖、甘油三酯、GSH-Px、SOD 水平呈升高趋势(P<0.05),BUN、MDA、CK、GOT、GPT 水平呈显著降低趋势(P<0.05),试验组大鼠各项指标均明显优于灌胃蒸馏水的对照组,起到对大鼠生理生化指标变化的干预作用。另外,山茱萸籽油具有明显延长游泳时间的作用,提高大鼠的耐力,缓解疲劳。

