两种自动勾画方法对上腹部危及器官勾画结果对比分析
高山宝,侯震,李双双,刘娟,闫婧
南京大学医学院附属鼓楼医院 肿瘤中心,南京 江苏 210008
引言
目前,有多种自动勾画软件已经开始在放疗中使用,可以自动勾画靶区和危及器官(Organs-At-Risk,OARs),为临床节省了大量时间。然而由于患者的个体差异,靶区的自动勾画结果目前还需要人工修改后才能临床使用[1-4],但是OARs的自动勾画已经与人工勾画差别不大[5-8]。目前自动勾画OARs轮廓主要有两种技术路线:一是利用基于卷积神经网络的深度学习(Deep Learning,DL)算法和具有相应勾画数据的图像训练并建立自动勾画模型;另一种是基于图谱库(Atlas)形变配准进行自动勾画。在日常使用中,基于两种不同技术路线的自动勾画软件在头颈部、胸部和盆腔的OARs勾画均可以满足临床要求,然而对上腹部OARs的勾画结果差异很大[9-11]。为了确定哪种技术路线更适用于上腹部OARs的自动勾画,本研究对比了基于DL和Atlas的自动勾画方法对上腹部放射治疗OARs勾画效果,为临床工作提供参考。由于基于同样的技术建立的模板都会因人而异,如建立Atlas模板病例数、软件版本的不同会导致勾画ORAs的不同[12-14],DL算法所使用的模型结构、调试参数及训练病例的差异也会导致勾画结果有所差异[15]。为了减小这些由技术条件导致的差别,使研究结果具有普适性,本研究所使用的软件均是目前商用的成熟产品(已取得CFDA认证),自动勾画所使用的通用模板均经过反复调整测试达到最优化。
1 资料与方法
1.1 临床资料
回顾性选择2015—2017年南京鼓楼医院肿瘤中心收治的27例放疗部位位于上腹部的患者的CT图像,所有患者均采用仰卧位,使用胸腹部热塑膜固定,扫描前饮水400 mL,图像采集使用Brilliance 6排螺旋CT模拟定位机(荷兰飞利浦公司),层厚为5 mm。
1.2 手动勾画和基于Atlas自动勾画危及器官
将扫描获取的CT图像分别传至Pinnacle3治疗计划系统工作站。先由高年资专业放疗医师在上腹部显示模式下(窗宽:400,窗位:800)手动勾画左右肾、肝脏和脊髓。然后使用 Pinnacle3治疗计划系统的Auto Segmentation功能模块选择Abdomen这一选项自动勾画上述病例CT影像中的OARs,该模块采用基于Atlas的方法实现自动勾画。
1.3 基于深度学习自动勾画危及器官
将扫描获取的CT图像分别传至 AccuContour工作站(Manteia数据科技有限公司提供),运行AccuContour,选取上腹部选项中的左右肾、肝脏和脊髓,自动勾画上述病例CT影像中的OARs,该软件基于采用卷积神经网络的DL算法,由医院方面提供标准勾画数据,由Manteia公司进行数据训练并最终形成符合医院标准的自动勾画模型。
1.4 评价指标
以医生手工勾画作为标准与自动勾画结果比较,计算两组勾画结果的豪斯多夫距离(Hausdorff Distance,HD)、平均最小距离(Mean Distance to Agreement,MDA)、戴斯相似性系数(Dice Similarity Coefficient,DSC)、Jaccard相似系数(Jaccard similarity coefficient,Jaccard)。
1.4.1 HD
用来衡量A、B 在三维空间上的表面距离,其计算公式为:

‖·‖是点集A和B点集间的距离范式。这里,式(1)称为双向Hausdorff距离,是Hausdorff距离的最基本形式;式(2)中的h(A,B)和式(3)中的h(B,A)分别称为从A集合到B集合和从B集合到A集合的单向Hausdorff距离。即h(A,B)实际上首先对点集A中的每个点ai到距离此点ai最近的B集合中点bj之间的距离‖ai-bj‖进行排序,然后取该距离中的最大值作为h(A,B)的值,h(B,A)同理可得。由式(1)知:双向Hausdorff距离H(A,B)是单向距离h(A,B)和h(B,A)两者中的较大者,它度量了两个点集间的最大不匹配程度。
1.4.2 MDA
与HD类似用来衡量 A、B 在三维空间上的表面距离,其计算公式为:
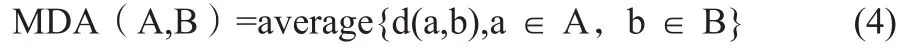
MDA是两个勾画的点对之间距离的平均值。
1.4.3 DSC
用于计算A与B两个集合之间的重叠区域所占比例,其计算公式为:

其值的范围从0到1,越接近于1,表示两种勾画方式的重合性越好。
1.4.4 Jaccard系数
用于度量A、B两个集合之间的相似性,其计算公式为:

其中,0≤J(A,B)≤1,J值越大,勾画的相似度越高。
1.5 统计学方法
采用SPSS 19.0对以上各参数进行配对t检验,结果以(±s)表示,P<0.05为差异有统计学意义。
2 结果
表1列出了AccuContour(DL-based) 和Auto Segmentation(Atlas-based)两个模型对左右肾、肝脏和脊髓的勾画准确性指标。基于Atlas勾画的右肾和肝脏显示常用的DSC指标均大于0.7,表明两个自动勾画的轮廓和手工勾画的轮廓相差不大,勾画效果可以接受[16-17]。而左肾的勾画效果很差,DSC系数(0.43±0.37)和Jaccard系数(0.35±0.31)均低于0.5,表明大部分左肾的Atlas的勾画都需要重新手工进行。基于DL算法的左右肾和肝脏的勾画效果都很好,DSC系数在0.9左右,Jaccard系数在0.8左右。而对于脊髓,四个评估指标均不令人满意。
表1 基于DL与Atlas方法自动勾画结果评价指标(±s)

表1 基于DL与Atlas方法自动勾画结果评价指标(±s)
危及器官HD/mm MDA/mm DSC Jaccard DL Atlas P值 DL Atlas P值 DL Atlas P值 DL Atlas P值左肾 14.77±5.46 48.29±28.85 <0.001 1.42±0.52 15.79±13.95 <0.001 0.90±0.04 0.43±0.37 <0.001 0.83±0.07 0.35±0.31 <0.001右肾 16.31±9.91 21.91±13.09 0.015 2.07±2.41 4.02±4.93 0.031 0.87±0.12 0.77±0.22 0.009 0.79±0.15 0.66±0.22 0.002肝脏 36.44±26.88 26.93±13.35 0.147 3.09±4.09 3.05±1.22 0.957 0.92±0.06 0.89±0.03 0.079 0.85±0.08 0.81±0.04 0.034脊髓 88.66±27.69 85.32±29.28 0.496 11.37±6.08 11.23±6.76 0.893 0.60±0.09 0.63±0.08 0.008 0.43±0.09 0.47±0.09 0.008
从上表中的比较结果可见,DL在左右肾的勾画上的4个评估参数均优于Atlas且差异有统计学意义(P<0.05);对肝脏勾画,只有Jaccard相似系数的评估DL优于Atlas,差异有统计学意义(P=0.03)。而对于脊髓的勾画,DSC和Jaccard系数均显示DL劣于Atlas,差异有统计学意义(P<0.05)。
基于DL的自动勾画运用在上腹部时的结果总体上优于基于Atlas的自动勾画结果。如图1所示,肝脏的体积大且有的边界不清,DL算法识别时有的病例会将靠近的软组织器官也勾画在内,致使HD和MDA偏大,基于Atlas的自动勾画对肝脏的整体形状识别较好,符合Atlas特征,但边界的分割不如DL算法准确,所以Jaccard系数显示DL算法勾画的肝脏轮廓更接近于手工勾画。

图1 两种方法对肝脏的勾画结果
左右肾由于是相对独立的脏器,DL算法识别准确,有着明显的优势。基于Atlas的自动勾画运用在左肾上时结果很差的原因是27例中有11例匹配到脾脏上导致DSC和Jaccard系数等于或接近于0。如图2所示,脊髓的勾画两种方法在四项评估指标上都不高,究其原因是人工勾画脊髓时只到第二腰椎下缘就结束了,而自动勾画因无法判断脊髓末端位置从而将马尾神经当作了脊髓,DL算法在勾画脊髓时DSC和Jaccard系数劣于Atlas,是因为勾画的轮廓包括了整个脊髓腔导致偏大,这也是该软件以后需要改进的地方。

图2 两种方法对肾脏和脊髓的勾画结果
3 讨论
目前,已经有多款基于Atlas自动勾画的软件上市并运用于临床工作,例如MIM软件(MIM Software Inc.,Cleveland,OH)、Eclipse 治疗计划系统中的 SmartAdapt模块和Velocity模块(Varian Medical Systems,Palo Alto,CA)、ABAS软 件(Atlasbased autosegmentation,Elekta Medical System,Stockholm,Sweden)。这些软件用来勾画OARs,可以将放射肿瘤医师从这些大量且重复的工作中解放出来,节约了宝贵的时间。从临床使用效果来看,这些软件在勾画头颈部、胸部和盆腔的OARs时效果较好,究其原因,这些部位的骨性标志和肺或空腔使得Atlas中的结构标记容易通过刚性配准映射到目标图像上,再略加形变即可取得不错的效果。但是在腹部OARs大都是软组织密度,且有的界限不明确,使得形变配准时容易产生偏差。本研究所用的AccuContour软件使用了unet_2d或vnet模型结构,在数据集导入后,系统自动按一定的比例将数据用于训练、验证和测试。训练数据会被用于实际的模型训练,验证数据可以帮助对模型进行批量大小、窗口采样方式、学习率等参数的调整,以及在训练过程中对于训练效果的监测,测试数据用于最后的效果评价(绝大多数数据集使用DSC),所以基于DL的自动勾画能够与人工勾画保持很高的相似性,对软组织边界的判断更加精准[18-19]。
本研究所示,上腹部OARs自动勾画的难点在于如何区分脊髓和马尾神经。因这两种OARs在CT影像中的显示均为软组织密度(CT值约20~40),人工勾画时也是通过第二腰椎来判断两者的分割位置,现有用来区分脊髓和马尾神经或是椎间盘的自动勾画算法也是在基于MR图像上实现的[20-21]。本研究所用的AccuContour软件勾画脊髓使用的是unet_2d模型,其优势在于处理单层CT图像是全分辨率输入,相较于unet_3d的采样输入,边界判断更加准确。但是若需要判断第二腰椎则需要用unet_3d来处理,目前GPU内存是瓶颈[22],虽然全分辨率输入需要处理的数据量大增,但是能够保持OARs相邻层面的连续性,避免出现图1中对靠近肝脏的胃肠道判断错误的情况。所以从本研究DL算法中的缺陷可以看出从二维到三维也是DL算法发展的必经之路,简化三维DL算法将是未来的发展方向。
本研究所用的AccuContour软件还可以自动勾画胃、十二指肠、胰腺等上腹部OARs,而这些脏器没有相对固定的形状,Atlas也无法建立合适的模板,所以Auto Segmentation功能模块只提供了研究所用的四种上腹部OARs的自动勾画,而DL算法模板却可以勾画得相当准确,可见DL算法模板更适合用于上腹部OARs的自动勾画。
4 总结
综合本研究来看,在自动勾画上腹部OARs时,基于Atlas建立的模板在判断各软组织器官的边界上有着先天的不足,而目前基于DL算法建立的模板已经能够提供更加准确地勾画,可以替代Atlas用于临床。虽然现在的DL算法模板还不是3D数据处理,但是依然可以尝试着用于某些肿瘤靶区的自动勾画,如鼻咽癌肿瘤临床靶区(Clinical Target Volume,CTV),直肠癌CTV,宫颈癌CTV等,这些CTV均包括了特定范围的淋巴引流区,肿瘤放疗医师在勾画时费时费力,建立了合适的模板就可以节省大量的时间精力。又或是为物理师建立模板用于勾画上述肿瘤调强治疗计划所用的辅助限制剂量区域,同样也可以节省物理师的工作时间。所以利用基于卷积神经网络的DL算法在以后的放疗工作中有着广阔的应用前景,必将越来越多地在临床工作中得到使用。

