响应面法优化超声辅助提取葵花盘中的绿原酸
张燕丽,尹佳乐,陈越,宋振康,闫小娟,张海悦,
1.长春工业大学化学与生命科学学院(长春 130012);2.吉林省富生特医食品有限公司(长春 130012)
向日葵(Helianthus annuusL.)又称太阳花,隶属于菊科向日葵属(Helianthus)[1]。向日葵的原产地为北美洲,约在明朝时引入中国,如今可知最早记载向日葵的中国文献为明朝人王象[2]。向日葵一身是药,其种子、花盘、茎叶、茎髓、根、花等均可入药。其中花盘主要营养成分是7%~9%粗蛋白、6.5%~10.5%粗脂肪、17.1%粗纤维、10%灰粉、43.9%无氮浸出物、40.0%~48.9%粗淀粉、2.4%~3.0%果胶。
绿原酸具有抗菌[3]、抗病毒[4]、抗炎[5]、保肝[6]、降血脂[7]、调节免疫、保护神经[8]、降压、抗氧化[9]、抗衰老、抗肌肉骨骼老化[10]、抗肿瘤[11-12]、抗白血病[13]和降血糖[14]等生物活性,被广泛应用于医药保健、化工、食品[15]及化妆品等领域。但由于技术条件的限制,我国绿原酸的纯品依靠进口,价格昂贵。中国向日葵生产种植发展成为仅次于油菜籽、大豆、棉籽和花生的第五大油料作物,年总产量位居世界第6位,但对向日葵副产品的利用仍不十分合理,尤其是向日葵花盘,中国的大部分地区都用于饲养牲畜[16]。因此,合理利用已有的丰富资源,大力开展绿原酸提取纯化与绿原酸产品的研究开发,对中国植物资源开发利用具有现实意义和经济意义。
提取绿原酸的方法有水提法[17-18]、醇提法[19-20]、微波辅助提取法[21-23]、超声波法[24]等。研究主要针对超声波辅助提取技术应用于蒲公英[25]、山银花[26]等,但响应面法优化超声辅助提取葵花盘中的绿原酸尚未有文献报道。试验通过响应面优化超声波辅助提取葵花盘中绿原酸的工艺条件,为向日葵花盘的开发应用提供参考。
1 材料与方法
1.1 主要材料与试剂
葵花盘(河北源创生物科技有限公司);绿原酸标准品(中国药品检验研究所);无水乙醇(陕西森弗天然制品有限公司);其余试剂均为分析纯。
1.2 主要仪器与设备
电子分析天平(JA2003N型,上海精密科学仪器有限公司);紫外风光光度计(SKD-08S,上海沛欧分析仪器有限公司);数控超声波清洗器(KQ5200DE,昆山市超声仪器有限公司);电冰箱(NR-B25WS1,无锡松下冷机有限公司);电热恒温水浴锅(SKD-200,上海沛欧分析仪器有限公司)。
1.3 试验方法
1.3.1 原料预处理
将葵花盘除杂,经纯水清洗,将其放入70 ℃烘干箱中烘干,烘干至恒重粉碎,过0.150 nm筛后装在密封袋中,备用。
1.3.2 绿原酸标准曲线绘制
准确称取0.001 g绿原酸标准品,置于50 mL容量瓶中,用无水乙醇定容。摇匀即可得质量浓度20 μg/mL绿原酸标准品溶液。量取1.0,2.0,3.0,4.0,5.0和6.0 mL绿原酸标准品分别置于6个10 mL容量瓶里,用无水乙醇定容,摇匀,以无水乙醇作参比,在最大吸收波长330 nm处测定其吸光度,以绿原酸的质量浓度为x轴,吸光度为y轴,绘制绿原酸标准曲线,其回归方程为Y=0.051 2X-0.087 6,R2=0.999 1,线性关系良好。
1.3.3 葵花盘中绿原酸的检测
准确吸取1 mL绿原酸提取液,用无水乙醇定容至50 mL容量瓶中。以无水乙醇作为参比液,用紫外可见分光光度计在200~700 nm范围内扫描。
1.3.4 绿原酸得率计算
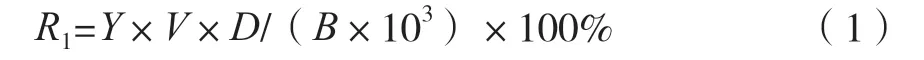
式中:R1为绿原酸得率,mg/g;Y为根据回归方程计算所得的绿原酸质量浓度,μg/mL;V为提取液体积,mL;D为稀释倍数;B为葵花盘质量,g;103为质量换算系数。
1.3.5 葵花盘绿原酸的提取方法筛选
1.3.5.1 水提取法
准确称取30 g样品于250 mL锥形瓶中,设计:温度分别为40,50,60,70和80 ℃;料液比分别为1∶20,1∶30,1∶40,1∶50和1∶60(g/mL);时间分别为10,20,30,40和50 min。在此条件下提取3次,过滤合并滤液,得到最优提取条件:温度70 ℃,料液比1∶40(g/mL),时间50 min。
1.3.5.2 乙醇提取法
准确称取30 g样品于250 mL锥形瓶中,设计:温度分别为40,50,60,70和80 ℃;料液比分别为1∶20,1∶30,1∶40,1∶50和1∶60(g/mL);时间分别为10,20,30,40和50 min;乙醇体积分数分别为20%,30%,40%,50%和60%。在此条件下提取3次,过滤合并滤液,得到最优提取条件:温度60 ℃、料液比1∶40(g/mL)、时间40 min。
1.3.5.3 超声提取法
准确称取30 g样品于250 mL锥形瓶中,设计:温度分别为40,50,60,70和80 ℃;料液比分别为1∶20,1∶30,1∶40,1∶50和1∶60(g/mL);超声时间分别为10,20,30,40和50 min;乙醇体积分数分别为20%,30%,40%,50%和60%。在此条件下提取3次,过滤合并滤液,得到最优提取条件:温度60℃,料液比1∶40(g/mL),时间40 min。在上述最优条件下各做3组平行试验做对比。
1.3.6 单因素试验设计
准确称取30 g葵花盘粉,置于250 mL锥形瓶中。在乙醇体积分数40%、料液比1∶40(g/mL)、超声时间30 min、超声功率80 W的条件下,分别考察超声温度40,50,60,70和80 ℃对葵花盘绿原酸得率的影响;在超声温度60 ℃、料液比1∶40(g/mL)、超声时间30 min、超声功率80 W的条件下,分别考察乙醇体积分数20%,30%,40%,50%和60%对葵花盘绿原酸得率的影响;在乙醇体积分数40%、超声温度60℃、超声时间30 min、超声功率80 W的条件下,分别考察料液比1∶20,1∶30,1∶40,1∶50和1∶60(g/mL)对葵花盘绿原酸得率的影响;在料液比1∶40(g/mL)、乙醇体积分数40%、超声温度60 ℃,超声功率80 W的条件下,分别考察超声时间10,20,30,40和50 min对葵花盘绿原酸得率的影响;在料液比1∶40(g/mL)、乙醇体积分数40%、超声温度60 ℃、超声时间30 min的条件下,分别考察超声功率60,70,80,90和100 W对葵花盘绿原酸得率的影响。
1.3.7 响应面优化葵花盘中绿原酸提取工艺
根据单因素试验结果,采用中心组合Box-Behnken设计方案,以超声温度、乙醇体积分数、料液比3个因素为自变量进行组合优化,进行响应面分析,设计见表1。

表1 响应面设计因素与水平
2 结果与分析
2.1 葵花盘绿原酸检测结果
通过全波长扫描图得到葵花盘绿原酸的最大吸收波长330 nm,根据文献[27]报道,此处属于绿原酸的特征吸收峰,因此确定葵花盘中含有绿原酸。
2.2 葵花盘中绿原酸提取方法选择结果
从表2可以看出,超声辅助醇提法的得率最高,因此选择响应面优化超声辅助醇提法提取葵花盘中的绿原酸。
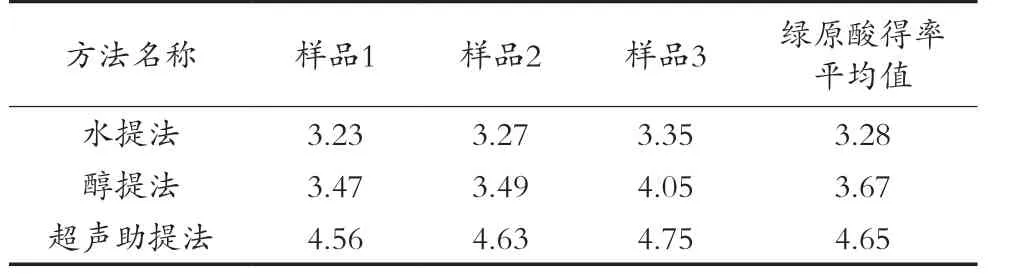
表2 3种提取方法的绿原酸得率比较 单位:mg/g
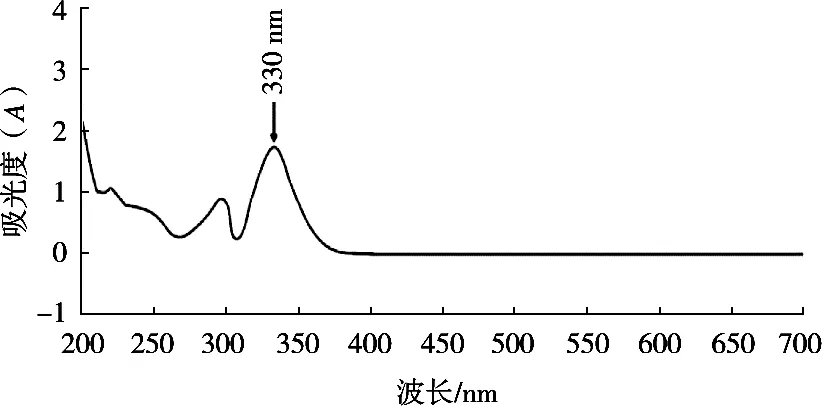
图1 葵花盘绿原酸紫外吸收光谱图
2.3 单因素试验结果
2.3.1 超声温度对葵花盘中绿原酸得率的影响
由图2可知,在40~60 ℃之间葵花盘中绿原酸得率随着超声温度升高而增大,因为温度升高,分子运动加快,使得细胞破裂进一步导致葵花盘中绿原酸的溶解及扩散速度加快。故在超声温度60 ℃时,葵花盘中绿原酸得率达到最大值5.14(mg/g)。在60~80 ℃之间,随着温度升高,绿原酸得率反而下降,可能是因为随着温度升高,葵花盘中绿原酸一部分有效成分被分解。故超声温度范围优选50~70 ℃。
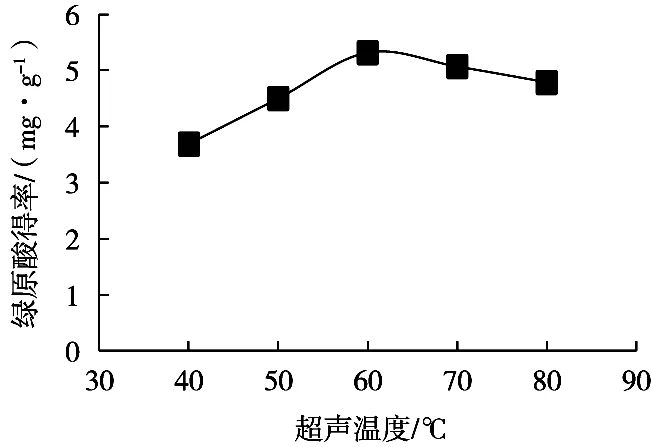
图2 超声温度对葵花盘绿原酸得率的影响
2.3.2 乙醇体积分数对绿原酸得率的影响
由图3可知,随着乙醇体积分数升高,葵花盘绿原酸得率逐渐增加,乙醇体积分数40%时葵花盘绿原酸得率达到最大值5.38(mg/g)。继续增大乙醇体积分数,可能是由于一些醇溶性杂质、色素、亲脂性强的成分溶出量增加,导致绿原酸得率出现下降现象,故乙醇体积分数范围宜选30%~50%。
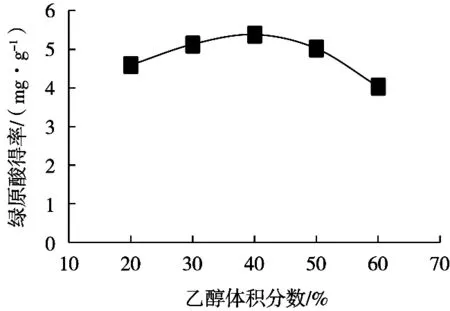
图3 乙醇体积分数对葵花盘绿原酸得率的影响
2.3.3 料液比对绿原酸得率的影响
由图4可知,随着料液比增大,葵花盘绿原酸得率先增大后减小,在上升阶段,固体与液体比例增加,前后得率之间差异增加。料液比1∶40(g/mL)时,得率达到最大值5.15(mg/g)。因此,料液比范围优选1∶30~1∶50(g/mL)。
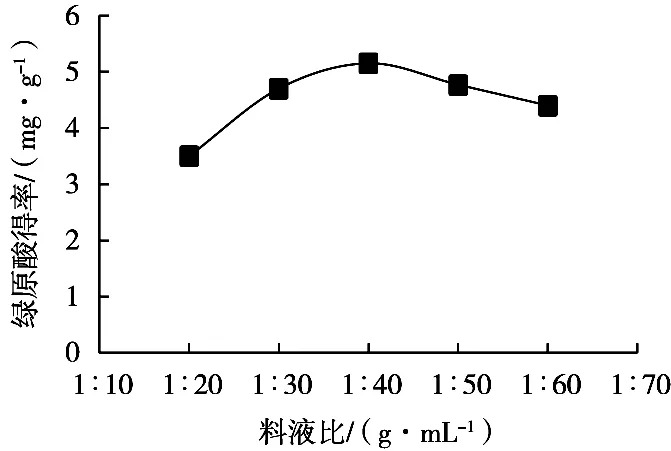
图4 料液比对葵花盘绿原酸得率的影响
2.3.4 超声时间对绿原酸得率的影响
由图5可知,在超声时间0~40 min内,随着超声时间延长,绿原酸得率逐渐增加,并在超声时间40 min时,绿原酸得率达到最大值5.49(mg/g),可能是由于超声波的空穴效应促进溶质的传递,加速绿原酸的溶出;超声时间大于40 min时,得率有所减少,这是因为绿原酸溶出率减小,同时超声波会导致部分绿原酸降解。综上,超声时间选取40 min。
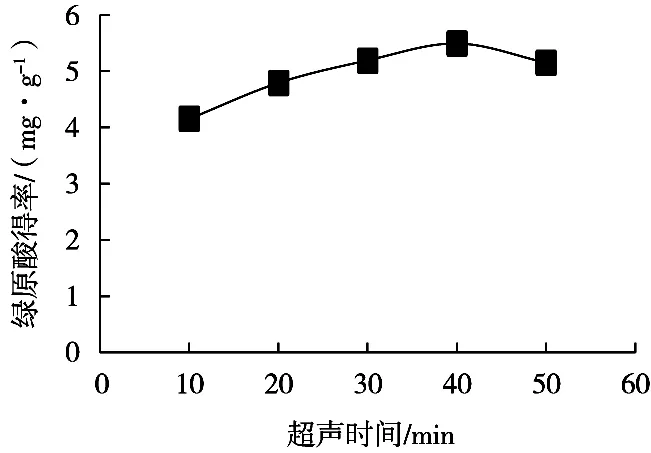
图5 超声时间对绿原酸得率的影响
2.3.5 超声功率对绿原酸得率的影响
由图6可以看出,随着超声功率增大,绿原酸得率先增大后减小。超声能够产生空化作用,这种空化效应对物料的细胞结构产生破坏,使得有效成分很容易渗出,从而得率提高;同时,超声对萃取溶剂起到搅拌作用,减小界面阻力从而促进物料与溶剂边界层的物质交换。综上,超声功率选择90 W。
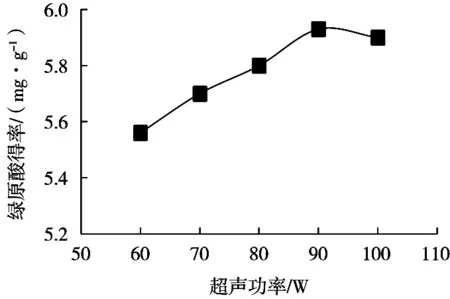
图6 超声功率对绿原酸得率的影响
2.4 响应面试验结果与分析
2.4.1 响应面中心组合设计结果
在单因素试验结果基础上,采用中心组合Box-Behnken设计方案,试验方案设计及结果见表3。
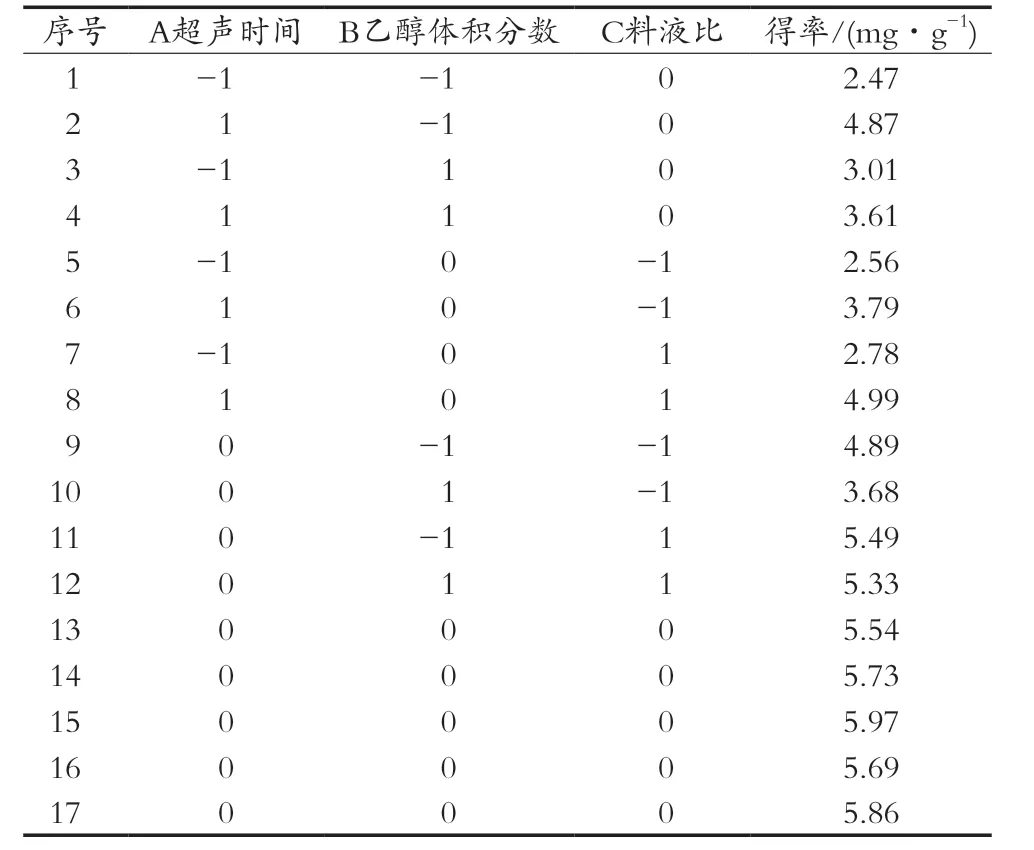
表3 响应面分析方案及试验结果
2.4.2 回归模型的建立以及方差分析
由表4可知,A和A2对绿原酸提取的影响极其显著,B、C 对提取的影响非常显著。由F值得大小可以推断出,这3个因素在所规定的范围内对葵花盘绿原酸提取的影响程度依次为A(温度)>C(料液比)>B(乙醇体积分数)。应用Box-Behnken软件进行响应面回归分析,对超声温度、乙醇体积分数、料液比3个因素进行拟合,得到多元响应面回归模型:R1=5.76+0.81A-0.26B+0.46C-0.45AB+0.25AC+0.26BC-1.79A2-0.48B2-0.44C2。回归模型p<0.000 1,失拟项p=0.255 2>0.05,R2=0.989 3,说明回归方程显著、失拟项不显著,响应面回归方程拟合程度良好。

表4 葵花盘中绿原酸得率回归模型方差分析表
2.4.3 响应面和等高线图结果
由图7可以直观地看出超声温度、乙醇体积分数和料液比对葵花盘绿原酸的提取均有显著影响及各因素之间交互作用的显著程度。通过响应面曲面的坡度可以直接反映因素发生变化时葵花盘绿原酸得率的响应灵敏度,等高线图呈椭圆形时说明两因素交互作用显著[28]。从图7中可以看出超声温度和料液比的交互作用明显。
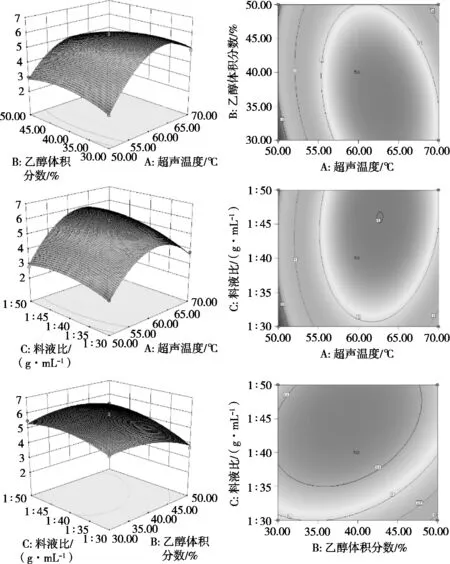
图7 各因素交互作用对绿原酸得率影响的响应面和等高线图
2.4.4 验证性试验
采用软件优化分析得出最佳提取条件:超声温度62.94 ℃、乙醇体积分数37.32%、料液比1∶45.29(g/mL)。在此条件下,模型预测葵花盘绿原酸得率为6.03 mg/g。为便于控制葵花盘绿原酸提取条件,提取参数设置为超声温度60 ℃、乙醇体积分数40%、料液比1∶50(g/mL)。在此条件下开展绿原酸提取的3次平行验证试验,结果显示葵花盘绿原酸得率平均值为6.01(mg/g),实际值与理论值基本相符,说明模型对葵花盘绿原酸提取工艺条件参数优化可靠可行,具有一定实用价值。
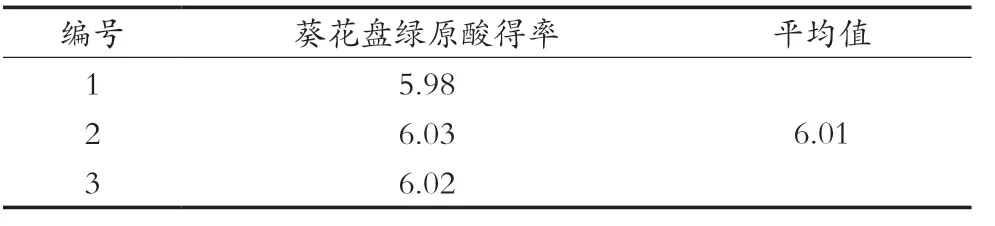
表5 最佳工艺的验证 单位:mg/g
3 结论与讨论
试验利用超声波辅助醇提法对葵花盘绿原酸进行提取,通过单因素试验和响应面试验对提取工艺进行优化,确定最佳工艺参数,提取葵花盘绿原酸最优条件为超声温度60 ℃、乙醇体积分数40%、料液比1∶50(g/mL)、超声时间40 min、超声功率90 W。在此条件下,葵花盘绿原酸得率为6.01 mg/g,与回归方程的预测值接近,具有一定的实用价值。后续将对葵花盘中的绿原酸进行分离纯化和活性功能的研究,为葵花盘绿原酸的深入研究提供理论依据。

