零乳糖牛乳中糠醛类化合物含量变化
扶晓菲
1.乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院(上海 200436);2.食品营养与安全协同创新中心(无锡 214122)
乳糖是乳及乳制品中常见的二糖,部分亚洲人群对乳糖显示出不耐受的情况,无法饮用含有乳糖的乳及乳制品。乳糖不耐受症(lactose intolerance,LI)是中国婴幼儿的常见疾病之一,由肠道乳糖酶的相对或完全缺乏导致,严重时甚至会引起骨质疏松,影响婴幼儿发育[1]。寻找零乳糖乳制品等替代产品,摄入外源性乳糖酶、益生菌等常被认为是LI的3种典型治疗手段[2]。零乳糖牛奶、奶酪、黄油等乳糖含量更低,同时富含更多葡萄糖、半乳糖以及转化得到的低聚半乳糖,能为LI人群提供必要的营养物质,可以促进身体健康并增强运动耐力[3-4]。其中,零乳糖牛奶通常需要经巴氏杀菌,冷却,加乳糖酶水解,再经巴氏杀菌或超高温灭菌,最后再经冷却和包装得到,常见加工方式有三种,分别是常温、低温、无菌乳糖酶解[5]。
乳糖经水解所得的半乳糖和葡萄糖,均为醛糖,具有还原性,水解反应方程式如图1所示。同时研究指出,在乳制品热处理过程中,还原糖经加热自身发生异构化反应或与蛋白质发生美拉德反应生成的糠醛类化合物,是加热程度和储藏变化的衡量指标之一[6]。糠醛类化合物是美拉德反应的重要产物,研究最多的主要有4种,分别是5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)、2-糠醛(2-furfural,F)、甲基糠醛(5-methylfurfural,MF)及2-呋喃甲基酮(2-furamethylketone,FMC),相关报道多集中在前两种物质[7-8]。欧盟食品安全委员会指出HMF的摄入上限为1.6 mg/d,过量摄入则可能在人体内积蓄,损害内脏,具有潜在毒性[9]。

图1 乳糖水解反应方程式
HMF形成动力学的研究报道,在3种单糖模拟体系和糖-酶解液模型体系中,HMF的积累量与反应时间和反应温度均呈现正相关[10-11]。其次,Chávez-Servin等[12]的报道表示,纯配方奶喂养的半岁左右婴儿每日HMF摄入量约为0.63~3.25 mg,所以具有超过推荐摄入上限值的可能性。因此推测零乳糖乳及乳制品由于富含半乳糖和葡萄糖两类还原糖,贮存过程可能更易生成糠醛类化合物,过度摄入对人体不利,因而有必要探究货架期内各类零乳糖产品中糠醛类化合物的含量变化情况。
试验首先研究了巴氏杀菌奶中添加乳糖酶后糠醛类化合物等物质的含量变化;进而对比了市售3大类液态乳中糠醛类化合物的含量;最后探究了在常温和60 ℃两种条件下UHT零乳糖液态乳中糠醛类化合物随贮藏时间的含量变化。研究有利于了解零乳糖液态乳中糠醛类化合物的含量分布情况及变化趋势,为零乳糖产品的安全贮藏、市场应用拓展作出理论指导。
1 材料与方法
1.1 材料与试剂
草酸二水合物(纯度99.5%~102.5%),上海安谱实验科技有限公司;三氯乙酸(纯度≥99.0%),国药集团化学试剂有限公司;糠醛标准品,5-羟甲基糠醛(纯度98%,CAS号:67-47-0)、2-糠醛(纯度99.5%,CAS号:98-01-1)、5-甲基糠醛(纯度99.6%,CAS号:620-02-0),德国Dr.Ehrenstorfer公司;2-呋喃甲基酮(纯度95.5%,CAS号:1192-62-7);乙腈、甲醇均为色谱纯,德国默克股份两合公司;乳糖酶(5 200 NLU/g),丹麦Chr-Hansen,Horsholm公司。
1.2 仪器与设备
AL104电子天平,梅特勒-托利多仪器上海有限公司;PL2002电子天平,梅特勒-托利多仪器上海有限公司;Milli-Q超纯水机,默克化工技术(上海)有限公司;ICH1102恒温培养箱,美墨尔特有限公司;SK5210HP超声清洗仪,上海科导超声仪器有限公司;DK-8B电热恒温水槽,上海精宏实验设备有限公司;WNB45恒温水浴锅,美墨尔特有限公司;ZWY-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;Beckman Avanti J-30I落地式离心机,美国贝克曼库尔特有限公司;1200型高效液相色谱仪,美国安捷伦科技有限公司。
1.3 方法
1.3.1 高效液相色谱分析条件
选用填料粒径为3 μm的反相C18色谱柱,色谱柱:Waters Atlantis T3(3.0 mm×15 cm,3 μm);流动相:流动相A为水,流动相B为乙腈;梯度洗脱:0~10.0 min,5% B~95% B,10.0~12.0 min,95%B~95% B,12.0~12.1 min,95% B~5% B,12.1~20.0 min,5% B~5% B;流速 0.6 mL/min;色谱柱温度:30℃;进样量:5 μL;进样盘温度:4 ℃;紫外检测器波长:280 nm。
1.3.2 样品的前处理
用分析天平称取15 g液态奶样品,加入5 mL 0.15 mol/L的现配草酸,于100 ℃水浴加热25 min后,取出冷却至室温;再加入3 mL质量浓度40 g/mL三氯乙酸溶液A,振荡10 min后再离心15 min;取上清液转移至25 mL容量瓶,滤渣加入5 mL 4 g/mL三氯乙酸溶液B,振荡10 min后,离心15 min;合并上清液,加入5 mL 4 g/mL三氯乙酸溶液B定容至刻度;取1 mL液体过0.22 μm尼龙滤膜,进液相色谱仪分析。
1.3.3 乳糖酶酶解试验
依据已有试验数据,由于生奶与巴氏杀菌奶中糠醛类化合物含量十分接近,且考虑实际实验室的操作的可行性,选用巴氏杀菌奶乳替代生奶来开展试验[13]。糖酶酶解试验,目的在于以巴氏杀菌奶为研究对象,探究了乳糖酶添加及保温酶解时间对糠醛类化合物的影响,其中重点考察还原性双糖体系(乳糖)与还原性单糖体系(葡萄糖和半乳糖)对糠醛类化合物生成的影响。
某品牌巴氏杀菌奶,购于上海某超市;将巴氏杀菌奶分装至各玻璃瓶,其中对照组奶样中乳糖酶添加量为1.5 g/kg,室温放置;试验组巴氏杀菌奶样奶样中乳糖酶添加量为1.5 g/kg,置于40 ℃的水浴锅中加热保温。自0 min时刻起,依次间隔20,40,60,80,100和120 min各取出奶样,参照GB 23780.8—2009,检测乳糖、葡萄糖、半乳糖,同时检测糠醛类化合物的含量。
1.3.4 市售奶样对比试验
市售奶样对比试验,选取了巴氏灭菌零乳糖、UHT灭菌乳、UHT零乳糖3大类液态乳进行试验,目的在于比较巴氏杀菌和超高压灭菌两种热处理工艺,以及常规乳制品和零乳糖液态乳中糠醛类化合物的含量,初步了解了各类市售乳品的糠醛含量差异,进一步验证不同工艺和不同糖体系造成的糠醛生成的差异,以期为乳制品的选择提供试验依据。
某品牌巴氏杀菌乳A1,购于上海某超市;某品牌巴氏杀菌零乳糖调制乳B1,购于上海某超市;京东超市购买市售UHT灭菌乳C1、C2、C3共计3种;京东超市购买市售UHT零乳糖调制乳D1、D2、D3、D4、D5、D6、D7共计7种;检测并对比其中所含糠醛类化合物的量。
1.3.5 加速保存试验
加速保存试验指的是在特定条件下进行,用于衡量评估短期时间内零乳糖液态乳质量影响的试验,通常选择偏离产品标签推荐的贮存条件来进行试验设计,从而达到初步预测UHT零乳糖灭菌乳稳定性的目的,并为设置长期试验条件、优化加工工艺等提供依据及支持性信息,进而为零乳糖液态乳的运输、贮存提供理论指导。
某品牌UHT零乳糖灭菌乳,即1.3.4中的D3样品,购于京东超市;将零乳糖奶分别置于室温避光条件(推荐储存条件25±2 ℃)与60 ℃的恒温箱中,放置30 d。分别于0,5,10,20和30 d取样,试验设计见表1,检测糠醛类化合物的含量。
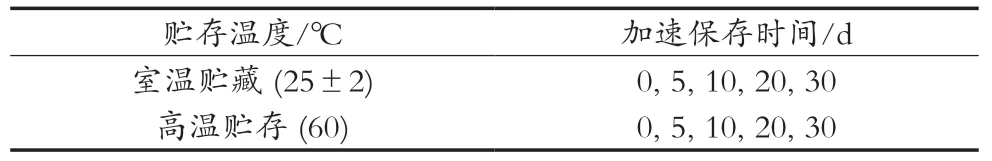
表1 加速保存试验设计
2 结果与分析
2.1 乳糖酶和酶解方式的影响
经不同加热酶解时间处理的巴氏杀菌奶中的乳糖、葡萄糖、半乳糖的含量变化如图2所示。依据试验数据可知,空白组至0 min为乳糖酶酶解时间,0~120 min为酶解保温时间。由于奶样中乳糖酶添加量为1.5 g/kg,酶量相对充足,乳糖酶添加后,乳糖迅速被彻底分解为葡萄糖、半乳糖,0 min时刻含量便降低至不可检测。对比不加酶的空白点数据,乳糖含量迅速从初始值4.1 μg/100 g奶降至0 min时刻的不可检测,反之葡萄糖和半乳糖含量均从不可检测升至0 min时刻的2.1 μg/100 g奶和2.2 μg/100 g奶,随后二者含量均基本保持稳定,再无明显变化。
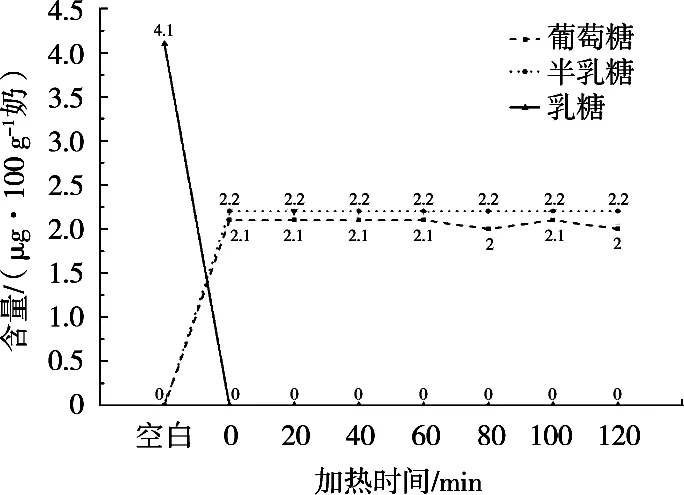
图2 糖类含量随酶解时间的变化
乳糖酶对巴氏杀菌奶中HMF、F含量的影响如图3所示。结合图2可知,乳糖酶反应迅速,0 min时刻便反应完毕,乳糖酶在充分水解乳糖为葡萄糖和半乳糖的同时造成了HMF含量的迅速上升,即还原性单糖体系相比还原性双糖体系,对HMF的影响在加热条件下的影响最为明显。具体表现:对比不添加乳糖酶的空白奶样,在不加热酶解条件下,HMF含量迅速由1.63 μg/100 g剧增至0 min时刻的30.51 μg/100 g,含量升高近5倍;而在40 ℃加热酶解条件下,HMF含量迅速由1.60 μg/100 g剧增至0 min时刻的31.1 μg/100 g,含量升高近5倍;而F含量均无明显变化。
酶解保温,即图3中0~120 min时刻,目的在于确保牛乳中的乳糖充分水解,但对HMF与F含量的影响有限。HMF在乳糖酶充分水解的0 min时刻已达到较大值,不加热酶解组中HMF自0 min时刻起在29.93~37.57 μg/100 g范围内波动;加热酶解组中HMF自0 min时刻起在30.27~38.70 μg/100 g范围内波动;而第120分钟的F含量与第0分钟相比均无显著变化。

图3 糠醛类化合物含量随酶解时间的变化
2.2 不同加工工艺的影响
加工工艺对巴氏杀菌奶中HMF与F含量的影响如图4所示。李文[14]采用HPLC法对比研究各类UHT灭菌奶中HMF的含量时证实,UHT零乳糖奶中的HMF含量远远高于UHT灭菌奶(135 ℃,15 s),约为后者的10倍。Ferrer等[15]报道指出,富含乳糖及半乳糖的UHT灭菌奶中HMF含量范围在22.65~66.44 μg/100 g,试验中C组中HMF的含量范围在36.97~41.87 μg/100 g,与既有报道相符,且与B组中HMF含量接近。
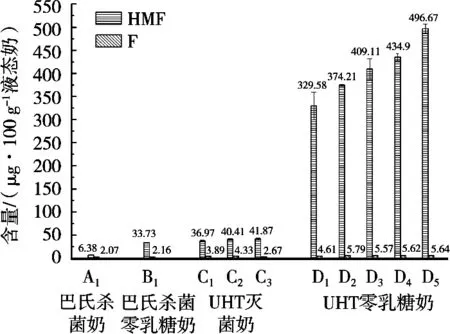
图4 各类液态乳中糠醛含量分布情况
零乳糖奶是含有葡萄糖和半乳糖的单糖体系,相比含有乳糖的普通奶组成的双糖体系更有利于糠醛类化合物生成。对比巴氏杀菌奶组与巴氏杀菌零乳糖组,即A组和B组,热加工工艺均为巴氏杀菌,HMF含量差异明显,F含量变化不明显。B组的HMF含量与A组的HMF相差约5倍;B组的F含量与A组相差不显著。对比UHT灭菌奶组与UHT零乳糖组,即C组和D组,热加工工艺均为超高压灭菌,但HMF含量差异明显,F含量相对差异不明显。D组的HMF含量与C组相差近10倍,而F含量相差不明显;上述结果与酶解试验中结果一致,单糖体系更有利于糠醛类化合物生成。
UHT的热加工强度较高,进一步加剧了HMF和F的生成。对比巴氏杀菌零乳糖奶组与UHT零乳糖组,即由B组和D组数据可知,在同样的单糖体系中,D组HMF含量范围在190.27~496.67 μg/100 g,而B组中的HMF含量仅为33.73 μg/100 g,相差显著;同样F含量范围在4.61~5.79 μg/100 g,而B组中的F含量为2.16 μg/100 g,有一定差异。相比巴氏杀菌工艺,UHT超高温灭菌由于灭菌温度更高,更有利于美拉德反应的进行,导致HMF和F生成量更高。
2.3 加速保存条件
李宇栋[16]通过探究4 ℃和37 ℃两种条件下储存时间为56 d的UHT灭菌奶中HMF含量变化规律,结果显示在第28天,4 ℃条件下储存的UHT灭菌奶中HMF没有显著性变化,而37 ℃条件下的HMF含量则由第0天的1 000 μg/100 g上升至约1 200 μg/100 g。
高温条件对UHT零乳糖奶中HMF与F的含量具有显著影响,结果如图5所示。高温条件与常温避光条件相比HMF含量明显升高,高温保存条件下HMF的含量整体呈现上升趋势,HMF含量由132.46 μg/100 g逐增至1 689.01 μg/100 g;而在推荐保存条件即常温避光保存条件下,HMF由132.46 μg/100 g升高至203.55 μg/100 g左右,含量变化较小;高温条件与常温避光条件的F含量差异也明显,高温条件下F含量由3.69 μg/100 g逐渐升至89.67 μg/100 g;而常温避光保存下第30天的F含量与第0天相比无显著变化,F的含量在3.64~6.27 μg/100 g范围内波动。

图5 零乳糖奶在两种保存条件下糠醛类化合物的含量变化
3 结论
试验研究发现,乳糖酶添加、加工工艺以及60 ℃高温贮存影响了零乳糖奶样中糠醛类化合物的生成,且对HMF的含量差异影响较大。具体体现:(1)酶解试验中,HMF在乳糖酶添加后含量迅速上升,同种工艺条件下的零乳糖奶中HMF含量也明显高于对应的普通奶样,这可能是由于乳糖水解生成的葡萄糖和半乳糖的单糖体系相对于双糖体系,美拉德反应更加剧烈,促进了HMF和F的生成;(2)不同加工工艺下,零乳糖奶中的HMF含量存在差异,UHT工艺由于较高的热加工条件,导致了UHT零乳糖奶的HMF含量显著高于UHT灭菌奶;(3)加速保存试验证明了HMF含量和F含量均在高温保存条件下明显上升。此次研究提示,为确保居民乳品摄入的安全、优质,乳品行业在零乳糖奶的推荐推广、工艺优化、安全储存等方面任重道远。

