亚麻酸纳米乳制备工艺
朱月霞,戚嘉怡,喻樊 ,缪怡烨
1.盐城师范学院药学院(盐城 224051);2.江苏省滩涂生物资源与环境保护重点建设实验室(盐城 224002);3.南京工业大学(南京 210000)
亚麻酸(linoleic acid,LA)是一种天然的疏水不饱和脂肪酸,有助于食品的风味和稠度,并使人在进食时感到饱足,对动物和人体无毒[1]。亚麻酸外观呈淡黄色液体,容易氧化[2]。另外,亚麻酸能降血脂、治疗肥胖症、预防非酒精性肝炎,还能对癌症有一定的治疗作用,包括减少癌细胞的生成、转移和减少肿瘤面积[3-6]。但动物体内不能合成亚麻酸,只能从外界获取。
近年来对亚麻酸的剂型的研究中,制备成胶囊[7-8]较多,也有制备成脂质体[9]。但将亚麻酸制备成纳米乳的报道很少。纳米乳是由水、油、乳化剂和助乳化剂组成的胶体分散体系,具有热力学稳定性好、液滴小等特点,粒径在10~200 nm之间,作为载体可以提高药物的生物利用度[10-11]。此次试验将亚麻酸制成纳米乳,对亚麻酸的应用具有重要的意义,为亚麻酸的剂型研究提供了参考。
1 材料
1.1 主要仪器与设备
台式电动离心机(常州国华电器有限公司);UV-1800型紫外可见分光光度计(日本岛津公司);B11-3型恒温磁力搅拌器(上海司乐仪器有限公司);JEM-1400 plus透射电子显微镜(日本)。
1.2 主要材料与试剂
亚麻酸(许昌元化生物科技有限公司);油酸(上海阿拉丁生化科技股份有限公司);大豆油(上海泰坦科技股份有限公司);棕榈酸异丙酯(山东优索化工科技有限公司);肉豆蔻酸异丙酯(山东优索化工科技有限公司);聚山梨酯80(Tween-80,国药集团化学试剂有限公司);Span-80(上海展云化工有限公司);OP-10(上海阿拉丁生化科技股份有限公司);1, 2-丙二醇(上海展云化工有限公司);聚乙二醇-400(国药集团化学试剂有限公司);焦性没食子酸(邻苯三酚,上海展云化工有限公司);三羟甲基氨基甲烷(Tris,上海蓝季生物有限公司);DPPH(上海蓝季生物有限公司);营养琼脂培养基(杭州微生物试剂有限公司);大肠杆菌(CMCC(B)44102);金黄色葡萄球菌(CMCC(B)26003);等。
2 试验方法
2.1 标准曲线的绘制
以无水乙醇为溶剂制备质量浓度为1 mg/mL的亚麻酸母液,在190~1 100 nm范围内用紫外分光光度计进行扫描。结果显示,亚麻酸的乙醇溶液在234 nm处出现最大吸收峰,故最大吸收波长选择234 nm。稀释亚麻酸母液制备梯度浓度0.1,0.2,0.3,0.4,0.5,0.6,0.7和0.8 mg/mL,横坐标为亚麻酸溶液的质量浓度,纵坐标为吸光度,对其进行线性回归,得亚麻酸标准曲线方程。
2.2 亚麻酸纳米乳的制备
2.2.1 亚麻酸纳米乳辅料的筛选[12]
选择大豆油、棕榈酸异丙酯、肉豆蔻酸异丙酯、油酸为备选油相,Tween-80、Span-80、OP-10为备选乳化剂,1, 2-丙二醇、聚乙二醇-400为备选助乳化剂。取适量的亚麻酸置离心管,加适量油相、乳化剂和助乳化剂,观察二者是否相融以及融合后的现象,并且测定各混合组分的吸光度,通过计算亚麻酸在各种溶剂中的溶解度来筛选最适的辅料。
2.2.2 伪三元相图筛选亚麻酸纳米乳处方[13]
将油相与乳化剂和助乳化剂组成的混合乳化剂(Km=1∶1,2∶1和3∶1)按照质量比1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2和9∶1的比例混合,在磁力搅拌器上恒温恒速搅拌,缓缓滴加纯化水,观察体系溶液由浑浊变澄清或由澄清变浑浊的现象,记录临界点,计算各组分百分比。用Origin Pro 8.0软件绘制伪三元相图。
2.2.3 亚麻酸纳米乳的制备
称取处方量的亚麻酸、油相、乳化剂、助乳化剂,缓缓滴加纯化水,在磁力搅拌器上充分搅拌混匀,可制得略带淡蓝色乳光且外观澄清的亚麻酸纳米乳。
2.3 抗氧化活性
2.3.1 羟自由基清除率
采用水杨酸法[14]测定亚麻酸的羟基自由基清除活性。在还原性过渡金属Fe2+和H2O2存在的情况下,Fenton反应可以形成羟基自由基,H2O2是所有还原性二氧化合物中反应最活跃的,被认为会引发细胞损伤[15]。Fenton反应为H2O2+Fe2+=OH-+H2O+Fe3+,且生成物在510 nm处有特征吸收。
制备质量浓度为5 mg/mL的样品溶液。各溶液的加入量如表1所示,依次加入9 mmol/L的FeSO4、9 mmol/L的乙醇-水杨酸、8.8 mmol/L的H2O2后摇匀,于37 ℃水浴加热15 min后取出,以不加双氧水的体系为参比溶液,摇匀测定吸光度。

表1 羟自由基清除试验 单位:mL
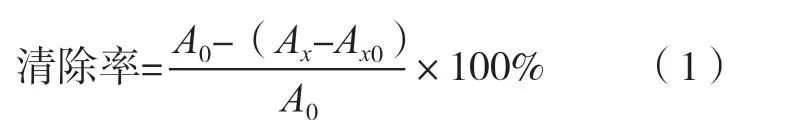
式中:A0为空白对照的吸光度;Ax为加样品的吸光度;Ax0为不加显色剂H2O2的吸光度。
2.3.2 超氧自由基清除率
采取邻苯三酚自氧化法[16]测定亚麻酸的超氧自由基的活性。
在比色皿中依次加入0.1 mol/L Tris-HCl,3 mmol/L的邻苯三酚和样品溶液后摇匀测定样品,即Ai,设置测定波长325 nm,并每隔30 s读数1次,至300 s为止,参比溶液为0.1 mol/L Tris-HCl溶液。同时空白以10 mmol/L的HCl溶液代替邻苯三酚同上进行测定,即A0。清除率按式(2)计算。
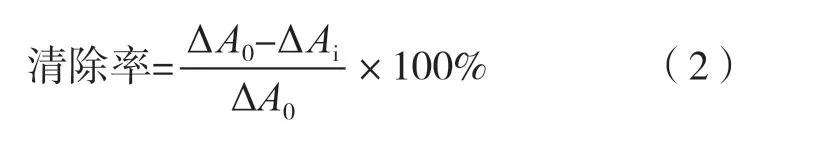
2.3.3 DPPH自由基清除率
DPPH法是一种准确、简便的试验,用于测定样品的抗氧化能力。深紫色的稳定DPPH自由基溶液在517 nm处显示出强吸收带。在抗氧化剂存在下,由于抗氧化分子1, 1-二苯基-2-苦基肼(黄色)的DPPH自由基(紫色)减少,吸光度降低[17]。
各溶液的加入量如表2所示。分别移取不同体积的样品溶液,超纯水补足至1 mL,再加1 mL的DPPH溶液,充分摇匀后避光反应30 min,参比溶液为超纯水,在517 nm波长下测定吸光度,即Aj。另外1 mL样品溶液加1 mL的无水乙醇作为空白对照测定吸光度,即Ai。同时1 mL的超纯水加1 mL的DPPH溶液测定吸光度,即A0。清除率按式(3)计算。

表2 DPPH自由基清除试验 单位:μL
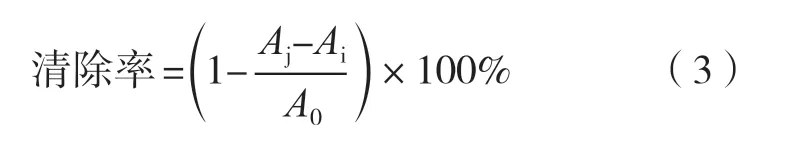
2.4 纳米乳的表征
2.4.1 包封率
包封率是衡量纳米乳液质量的一个重要指标,采用微柱离心法[18]对亚麻酸纳米乳的包封率进行检测。SephadexG-75葡聚糖凝胶在去离子水中浸泡过夜,充分溶胀。取2.5 mL注射器去掉内芯,取一点棉花垫入注射器内,然后剪下合适大小的滤纸垫入其中,将浸泡好的SephadexG-75少量多次加入,静置一段时间后放入离心机中,以100 r/min离心1 min,得到高度约1 cm的独立凝胶柱。取100 μL空白纳米乳,加入微型凝胶柱的顶端,静置预饱和20~30 min。取30 μL制备好的亚麻酸纳米乳,加于微型凝胶柱的顶端,加2 mL纯化水,并用100 r/min离心1 min,收集洗脱液,连续操作,每次收集的洗脱液加入容量瓶中,用无水乙醇定容。测定吸光度,直至吸光度接近0说明洗脱完成,并以管数为横坐标,吸光度为纵坐标,绘制洗脱曲线。根据洗脱曲线选择需要洗脱的管数,并将这几管的洗脱液合并,用无水乙醇定容至10 mL。同时,取30 μL亚麻酸纳米乳,用无水乙醇定容至10 mL。用紫外分光光度计在234 nm处分别测定亚麻酸洗脱前和洗脱后的吸光度,根据式(4)计算包封率。

式中:C柱后为微柱离心后纳米乳中的药物的质量浓度;C柱前为微柱离心前纳米乳中的药物的总质量浓度。
2.4.2 形态观察[19]
取适量制得的亚麻酸纳米乳,蒸馏水稀释100倍,滴在铜网上,静置一段时间,用滤纸吸干,滴加2%磷钨酸溶液负染5~10 min,自然挥发干,通过透射电子显微镜观察纳米乳形态。
2.5 抑菌活性[20]
取培养好的大肠杆菌和金黄色葡萄球菌菌液,至超净台操作。每支试管中加900 μL的生理盐水,再用移液枪取100 μL培养好的大肠杆菌菌液加至第一支试管混匀,记为10-1CFU/mL。再取100 μL第一支试管中菌液至第二支试管,以此类推,将菌液稀释至10-7CFU/mL。金黄色葡萄球菌的稀释操作同上。
制备质量浓度为0.50,0.25和0.125 mg/mL的亚麻酸纳米乳溶液,同时阴性对照空白纳米乳也稀释相应的质量浓度,配制质量浓度为5 mg/mL的阳性对照青霉素标准液。灭菌后营养琼脂培养基后倒平板,加5 μL上述稀释好的菌液涂布后放至水平位置待用,在培养皿中等间距放3~4个牛津杯(内径6 mm,外径7.8 mm,高10 mm),并加入200 μL上述不同质量浓度的溶液,放入37 ℃恒温培养箱中培养16~18 h,然后测量抑菌圈直径。
3 结果与分析
3.1 标准曲线
亚麻酸的乙醇溶液在234 nm处出现最大吸收峰,故最大吸收波长选择234 nm。以亚麻酸溶液的质量浓度为横坐标,吸光度为纵坐标进行线性回归,亚麻酸标准曲线方程为y=1.006 1x+0.109 7(r2=0.994 1),表明亚麻酸在质量浓度为0.1~0.8 mg/mL内线性关系良好。
3.2 亚麻酸纳米乳的制备
3.2.1 亚麻酸在各辅料中的溶解度
从表3可以看出,在4种油相中,亚麻酸在油酸中的溶解度最大;在3种乳化剂中,亚麻酸在Tween-80中的溶解度较好;在2种助乳化剂中,亚麻酸在1, 2-丙二醇中的溶解度较高。因此,以油酸为油相,Tween-80为助乳化剂,1, 2-丙二醇为助乳化剂做进一步研究。
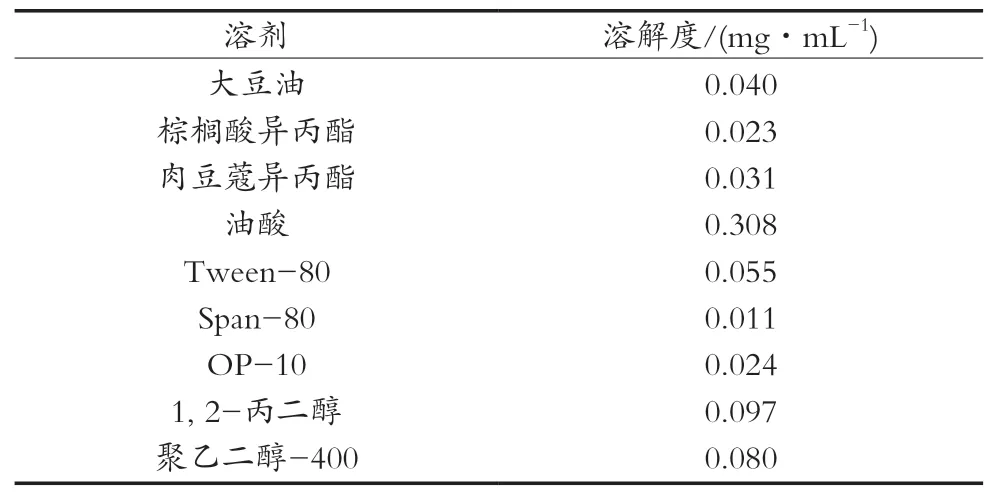
表3 各种不同溶剂中亚麻酸的溶解度
3.2.2 伪三元相图
绘出伪三元相图后,用image J软件比较不同Km值的相图面积。由图1和表4可知,当油酸-Tween-80-1, 2-丙二醇-水的处方在Km=2∶1时面积最大,根据纳米乳外观,选择1∶9比例的油相与混合乳化剂。

表4 不同Km值的伪三元相图面积
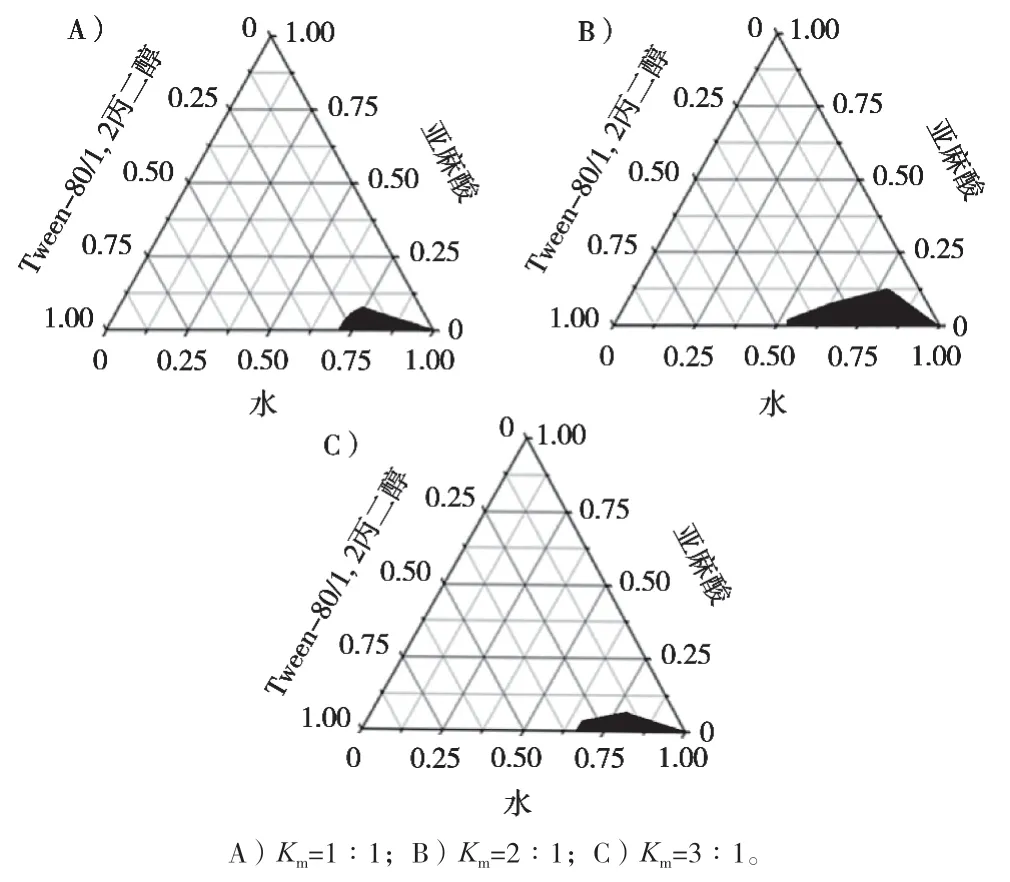
图1 不同Km值下空白纳米乳的伪三元相图
3.2.3 制备亚麻酸纳米乳
确定亚麻酸纳米乳的最佳配方:亚麻酸2.26%、油酸2.26%、Tween-80 13.53%、1, 2-丙二醇6.76%、纯化水75.19%。称取亚麻酸、油相、乳化剂、助乳化剂,缓慢纯化水,在磁力搅拌器充分搅拌混匀不断搅拌,制备的亚麻酸纳米乳略带淡蓝色乳光且外观澄清。
3.3 抗氧化活性
3.3.1 羟自由基清除率
载药纳米乳的组成为亚麻酸、油酸、Tween-80、1, 2-丙二醇,测得A0为0.863(见表5)。

表5 载药纳米乳的羟自由基清除率
结果表明含亚麻酸的载药纳米乳的羟自由基清除率大,同时含油酸的空白纳米乳也有一定的羟自由基清除作用(见表6)。
表6 空白纳米乳的羟自由基清除率
3.3.2 超氧自由基清除率
采用的样品质量浓度为0.15 mg/mL,计算得载药纳米乳的超氧自由基清除率为23.08%,空白纳米乳的超氧自由基清除率为17.58%。考虑到油酸的影响,所以对同时不含油酸和亚麻酸的组分也进行了测定,不含油相组分的超氧自由基清除率为12.09%。结果发现相比较空白纳米乳,含亚麻酸的载药纳米乳的超氧自由基清除率较大,有一定的超氧自由基清除作用。相比较不含油相的纳米乳,空白纳米乳的清除率较高,则表明油酸也有一定的超氧自由基清除率。
3.3.3 DPPH自由基清除率
样品质量浓度为5 mg/mL的载药纳米乳和空白纳米乳,由表7可以发现,空白纳米乳的DPPH自由基清除率很小,是由于样品质量浓度的影响。但是从数据中可以发现载药纳米乳的DPPH自由基清除率比空白纳米乳的大,说明亚麻酸有一定的DPPH自由基清除能力。

表7 DPPH自由基清除率测定结果
3.4 纳米乳的表征
3.4.1 包封率
根据图2的洗脱曲线,选择前4管的洗脱液合并测定吸光度。经紫外分光光度计测定,微柱离心后的吸光度为0.297,微柱离心前的吸光度为0.390。根据标准曲线计算得C柱后为0.186 mg/mL,C柱前为0.279 mg/mL,包封率为66.7%。
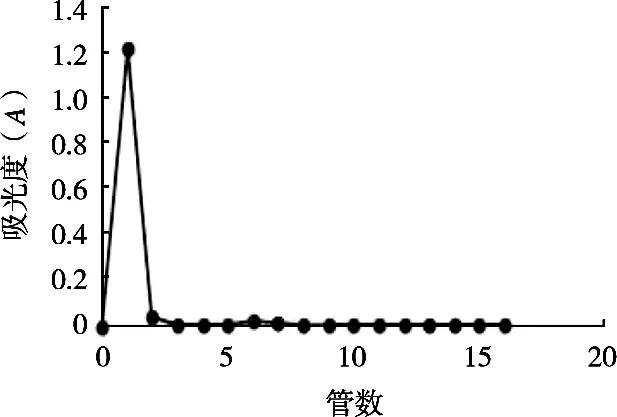
图2 亚麻酸的洗脱曲线
3.4.2 形态观察
由图3可以看出,纳米乳微观形态呈球形,乳滴分布均匀无粘连,粒径约176 nm。

图3 亚麻酸纳米乳透射电镜微观形态
3.5 抑菌活性
由表8可知,空白纳米乳无抑菌性,亚麻酸纳米乳的抑菌效果低于青霉素标准液,3个浓度的亚麻酸纳米乳对两种菌均有较好的抑菌效果,在质量浓度0.5 mg/mL的抑菌效果最好。

表8 抑菌试验结果
4 讨论与结论
采用伪三元相图筛选亚麻酸纳米乳的最适处方,目测观察浑浊到澄清现象来判断相转变的临界点。试验发现,并不是所有的比例均能形成纳米乳,纳米乳是透明或透明略带乳光的液体状,而有些是形成乳白色不透明的液体状,后需加很大比例的水才会逐渐变成透明样,一些不易形成的点绘制伪三元相图时,选择由黏状的液晶态到液体状的临界点来绘图。
考察了亚麻酸的抗氧化活性,包括羟自由基、超氧自由基、DPPH自由基三个方面。清除羟自由基是一种重要的抗氧化活性,羟自由基具有很高的反应活性,使其能够与活细胞中广泛存在的分子(如糖、氨基酸、脂类和核苷酸)发生反应。超氧自由基对细胞成分非常有害,它容易与DNA和蛋白质发生反应,需要在生物系统中立即清除。DPPH存在一个稳定的自由基,常被用于测定天然化合物的自由基清除活性,在DPPH试验中研究了亚麻酸作为氢原子或电子供体将DPPH转化为缩合型DPPH-H的能力。试验发现,含油酸的组分与不含油相的组分相比较高,说明油酸有一定的自由基清除能力,而当组分中加入亚麻酸后清除率有很大的提高,说明亚麻酸自由基清除能力强。采用牛津杯法测定亚麻酸的抑菌活性,试验发现亚麻酸纳米乳有较好的抑菌效果。

