生马铃薯通过酶法脱支制备抗性淀粉
王六强,张新武,孔红建,王杨,张娇娇
河南省食品工业科学研究所有限公司,郑州市抗消化淀粉生产技术与应用重点实验室(郑州 450053)
淀粉是自然界中非常富裕的能量资源,特别是在人们生活中有着重要作用和需求。长期以来,淀粉被认为可以被人体完全消化和吸收,然而,20世纪80年代,英国生理学家Flan Englystt在研究中发现在被包埋的不溶性膳食纤维中含有淀粉成分,并称之为Resistant starch,简称RS,即抗性淀粉。在随后的试验中发现,从加工食品中分离出的某些常见的淀粉,无法在人工模拟消化环境中被淀粉酶水解,至此,抗性淀粉的研究引起国外学者的关注。根据联合国粮农组织(FAO)1990年的定义,抗性淀粉指的是“健康者小肠中不吸收的淀粉及其降解产物”,但能在大肠中发酵的淀粉及其淀粉降解物的总称[1]。抗性淀粉的化学性质还没有较为明确的分类,但根据淀粉的来源和试验性质分析,可将其分4个类别,分别为RS1(物理包埋淀粉)、RS2(抗性淀粉颗粒)、RS3(老化淀粉)、RS4(化学改性淀粉)[2]。
在食品加工中,抗性淀粉具有特殊的生理功能和特性,可作为食品加工辅助产品,适合用于制造高品质食品,在生物行业、医学行业、食品加工行业引起广泛关注[3]。如食品加工中,在低水分的食品中添加普通的膳食纤维,会使得食品的口感、品质下降,而抗性淀粉的作用与膳食纤维类似,但又比膳食纤维具有更出色的生理功能,不但不影响食品的口感和品质,还能使食品的口感更佳酥脆,使食品具有更加出色的蓬松性[4]。在医学行业,抗性淀粉被食用后,可以直接进入人体的小肠里分解,产生大量脂肪酸,对保持肠道健康和预防一些血糖疾病等有重要作用[5-6]。人体健康与碳水化合物的关系密不可分,因此抗性淀粉具有重要的研究价值和意义。
抗性淀粉的制备主要分为物理法、化学法和酶法改性3种。其中,物理法、化学法具有不同程度的缺点。如化学法中主要采用酸水解法,其脱支作用专一性差,并且酸碱试剂在后续产品处理中更加麻烦,存在一定污染问题[7]。酶法脱支可分为均相脱支和异相脱支,前者是淀粉在高温糊化后加入酶,降温脱支处理;后者是不经过糊化的淀粉,在较低温度下进行部分脱支处理[8]。普鲁兰酶可在水解过程中切断支链淀粉中的α-1, 6糖苷键,是水解产物中含有更多的直链分子,耐高温α-淀粉酶可以适当地切短分子链,将这2种酶结合使用,可使长度均匀且长度适中的直链淀粉在相互重新排列形成抗性淀粉时效率更高,最终得率得到极大提升[9]。与物理化学方法相比,酶法脱支具有能耗少、成本低、效率高、更加绿色无污染等优点,制备食品更加安全卫生,因此受到广泛关注。
试验以新鲜马铃薯为原料,以抗性淀粉得率为考察目标,研究耐高温α-淀粉酶用量和作用时间,以及普鲁兰酶用量、作用时间、作用温度等多种因素对抗性淀粉制备得率影响,在单因素试验的基础上后,设计正交试验来分析最佳工艺条件,以期提高抗性淀粉得率[10]。试验为抗性淀粉的制备和应用提供参考。
1 材料与方法
1.1 试验材料与试剂
新鲜马铃薯(市售);耐高温α-淀粉酶、普鲁兰酶(诺维信(中国)生物技术有限公司);胃蛋白酶溶液、葡萄糖淀粉酶(河南仰韶生化工程有限公司);抗性淀粉检测试剂盒(爱尔兰Megazyme公司);其他化学试剂均为国产分析纯。
1.2 主要仪器与设备
YXQ-LS-100A型立式压力灭菌锅(上海博讯实业有限公司);TDZ5-WS台式离心机(湖南湘仪实验室仪器开发有限公司);SHA-C型恒温振荡器(常州智博瑞仪器制造有限公司);DHGT-9053A型鼓风干燥箱(上海精宏实验设备有限公司);723N型分光光度计(上海佑科仪器仪表有限公司);HR1844型破碎机(珠海经济特区飞利浦家庭电器有限公司)。
1.3 试验方法
1.3.1 马铃薯抗性淀粉制备工艺

马铃薯抗性淀粉的制备方法参考李珊珊等[12]方法,并加以改良。
1.3.2 抗性淀粉含量测定方法
抗性淀粉检测操作采用AOAC-GOPOD法[13]。准确称取100 mg样品,加入4.0 mLα-胰淀粉酶,于37 ℃振荡16 h,加入4.0 mL无水乙醇,离心10 min,收集上清液,沉淀用50%乙醇洗涤3次,合并上清液,沉淀水浴,加入2 mL 2 mol/L的KOH,磁力搅拌,加入8 mL 1.2 mol/L的醋酸钠缓冲溶液,混匀,加入0.1 mL AMG,于50 ℃水浴30 min。RS含量<10%时,将处理后溶液直接离心;RS含量>10%时,根据抗性淀粉的含量定容溶液,取少量溶液离心。用GOPOD法测定还原糖的含量。抗性淀粉含量为还原糖含量×0.9。
1.3.3 单因素试验
单因素试验在耐高温α-淀粉酶用量3 NU/g、作用时间30 min;普鲁兰酶用量5 NPUN/g、作用时间8 h、作用温度60 ℃基础上,变换相应因素水平:耐高温α-淀粉酶用量(1,3,5,7和9 NU/g);耐高温α-淀粉酶作用时间(10,20,30,40和50 min);普鲁兰酶用量(2,4,6,8和10 NPUN/g);普鲁兰酶作用时间(2,6,10,14和18 h);普鲁兰酶作用温度(50,55,60,65和70 ℃),按照抗性淀粉的制备方法,考察不同因素对抗性淀粉得率的影响。
1.3.4 正交试验
在单因素试验的基础上,进行五因素四水平的正交试验分析,选取的5个因素,分别为耐高温α-淀粉酶用量和作用时间,以及普鲁兰酶用量、作用时间、作用温度。设计水平安排见表1。

表1 正交试验方案设定
2 结果与分析
2.1 单因素试验的结果与分析
2.1.1 耐高温α-淀粉酶用量对抗性淀粉得率的影响
由图1所示,在单因素试验中,耐高温α-淀粉酶用量较少时,抗性淀粉得率受到较大影响,耐高温α-淀粉酶用量3 NU/g时,得率达到最高,为10.1%,而超过3 NU/g时,得率又略有下降。分析认为,酶量的多少决定了切割淀粉的程度,酶量大时,直链分子被酶切太短,不利于分子间重新结合形成所需淀粉分子,酶量过小时,直链分子酶切不够完全,达不到较好的切割效果,同样不利于抗性淀粉形成。
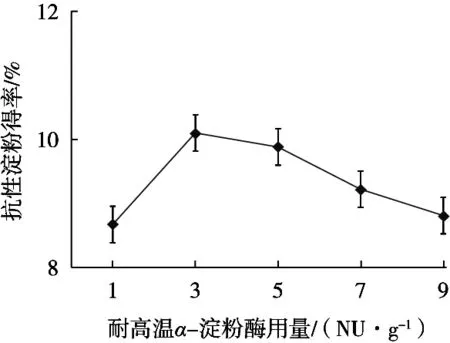
图1 耐高温α-淀粉酶用量对抗性淀粉得率的影响
2.1.2 耐高温α-淀粉酶作用时间对抗性淀粉得率的影响
由图2所示,在单因素试验中,随着耐高温α-淀粉酶作用时间增加,抗性淀粉得率先增大后减小,耐高温α-淀粉酶作用时间30 min时,抗性淀粉得率达到最高,为10.08%。分析认为,耐高温α-淀粉酶切割淀粉分子需要一定作用时间,时间过短,淀粉分子水解程度不够,切割成的分子链过长,不易形成抗性淀粉,时间过长时会将分子链切得太短,使得分子运动过快,也不利于形成抗性淀粉。

图2 耐高温α-淀粉酶作用时间对抗性淀粉得率的影响
2.1.3 普鲁兰酶用量对抗性淀粉得率的影响
由图3所示,在单因素试验中,普鲁兰酶用量对抗性淀粉的得率存在一定程度的影响。普鲁兰酶用量少于4 NPUN/g,随着用量增大,抗性淀粉得率明显增大,而之后抗性淀粉得率逐渐下降。普鲁兰酶用量4 NPUN/g时,抗性淀粉得率为10.02%。分析认为,普鲁兰酶对抗性淀粉的最佳脱支效果存在一定上限。抗性淀粉的脱支效果已达到要求,继续进行脱支酶解,直链分子再次被切割为更小的淀粉分子,分子聚合度过低,不利于重新结晶形成抗性淀粉。
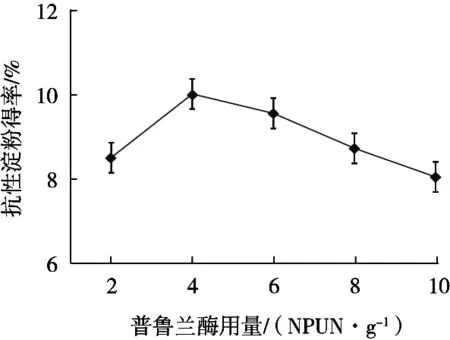
图3 普鲁兰酶用量对抗性淀粉得率的影响
2.1.4 普鲁兰酶作用时间对抗性淀粉得率的影响
由图4所示,在单因素试验中,普鲁兰酶作用时间过长或过短,均会使抗性淀粉的得率降低,作用时间10 h左右时,抗性淀粉得率达到最高,为9.82%。分析认为酶作用需要一定时间,作用时间延长,会使酶切割更多分子,从而影响抗性淀粉形成。

图4 普鲁兰酶作用时间对抗性淀粉得率的影响
2.1.5 普鲁兰酶作用温度对抗性淀粉得率的影响
由图5所示,普鲁兰酶作用温度55 ℃左右时,抗性淀粉的得率达到最高,为10.24%,且作用温度升高或降低均对得率均存在较大影响。分析认为,酶的活性受到温度的影响较大:温度低,则酶的活力不足,不能充分水解支链上的α-1, 6-糖苷键;温度过高,部分酶失去活性,也不利于抗性淀粉形成,只有在酶最佳作用温度下,可以达到最好脱支效果。

图5 普鲁兰酶作用温度对抗性淀粉得率的影响
2.2 正交试验的结果与分析
通过表2正交试验结果可知,最优水平组合为A2B3C2D3E2,即耐高温α-淀粉酶用量3 NU/g、作用时间30 min;普鲁兰酶用量4 NPUN/g、作用时间10 h,作用温度55 ℃。在此条件下制备抗性淀粉,通过3组平行试验,由表3可知,抗性淀粉得率为10.45%±0.03%,比较正交试验其他组合,则最优组合得率最高。通过极差分析可知,各因素对抗性淀粉制备条件影响大小为耐高温α-淀粉酶用量>普鲁兰酶作用时间>普鲁兰酶作用温度>耐高温α-淀粉酶作用温度>普鲁兰酶用量。
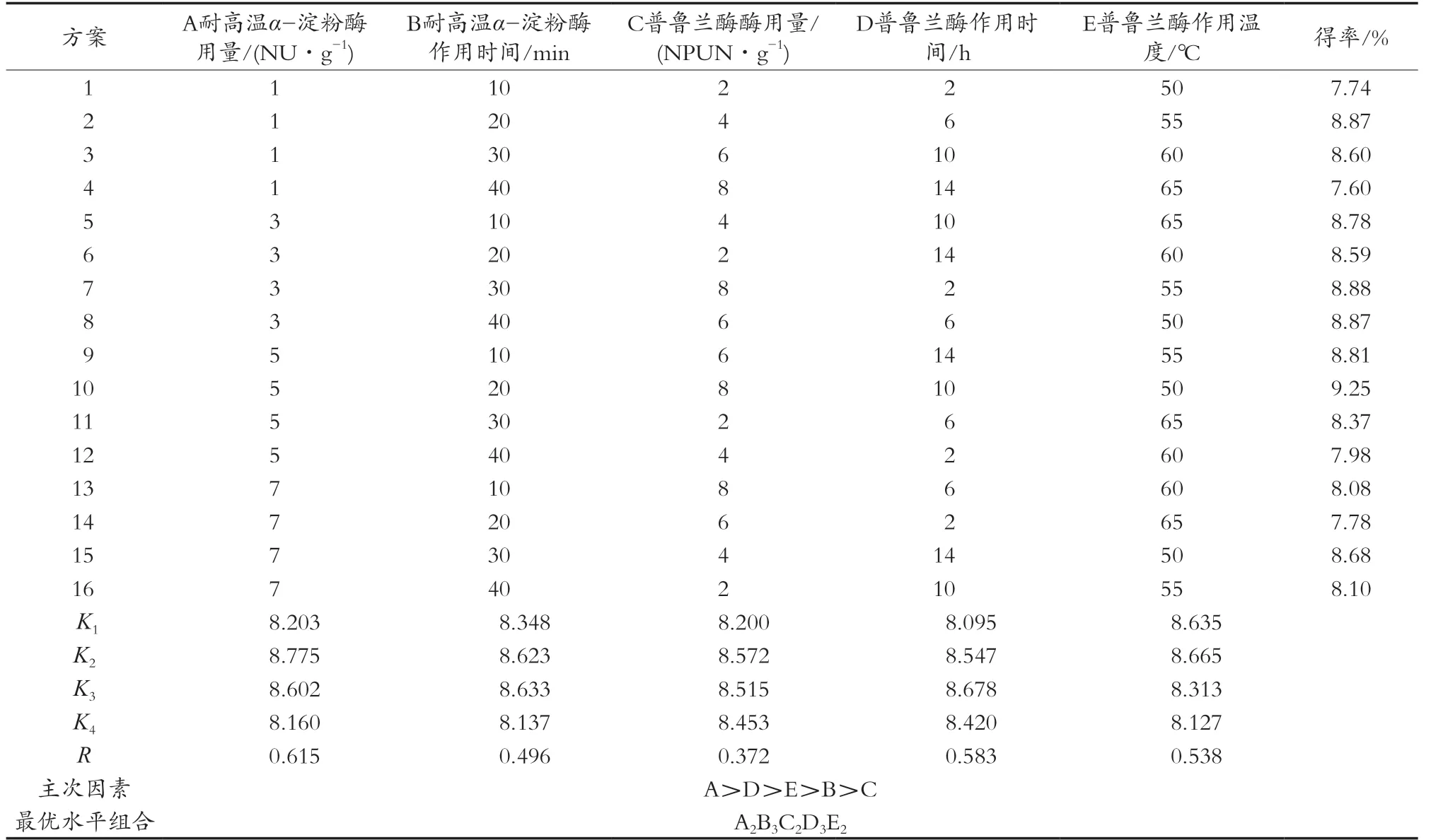
表2 正交试验方案及结果

表3 验证试验结果 单位:%
分析认为,耐高温α-淀粉酶和普鲁兰酶分别属于内切酶和异淀粉酶,主要起切割糖苷键作用。支链淀粉中的α-1, 6糖苷键被切开,有利于得到更多的直链分子;同时,α-1, 4糖苷键的断开,使直链淀粉长度更加平均,有利于分子间的重新排列形成抗性淀粉,使其产率得到极大提高。由抗性淀粉制备原理可知,抗性淀粉主要是由于直链淀粉凝沉作用产生的,直链淀粉的含量对抗性淀粉的形成有显著影响,因此,直链淀粉分子含量越高,越有利于淀粉分子相互结合形成抗性淀粉。耐高温α-淀粉酶的作用可以适当地切短分子链,产生长度均匀适中的淀粉分子链,普鲁兰酶的作用可以切割α-1, 6葡萄糖苷键,从而在淀粉水解时产生更多的直链淀粉,有利于分子重新凝结。因此耐高温α-淀粉酶和普鲁兰酶联合作用,直接影响到抗性淀粉形成。通过正交试验结果可以得出抗性淀粉得率的最佳条件,通过结果对比可以看出,耐高温α-淀粉酶用量是其中最重要的影响因素[14]。
3 结论与讨论
针对不同种类的抗性淀粉,国内外学者采取多种方法制备,在英国和美国有相应的抗性淀粉产品进行工业化生产,但新技术创新较少,且大多数研究应用基于非颗粒性RS3,其他种类的商品化生产和应用较少。国内食品行业对于抗性淀粉的研究相对较少,起步较晚,有较大的研究发展空间[15]。
酶法脱支是一种制备抗性淀粉的有效方法,对淀粉性质产生不同作用。通过正交试验对制备抗性淀粉工艺进行优化,确定最优工艺条件:耐高温α-淀粉酶用量3 NU/g、作用时间30 min;普鲁兰酶用量4 NPUN/g、作用时间10 h、作用温度55 ℃。在此条件下,抗性淀粉得率为10.45%±0.03%。其中,耐高温α-淀粉酶用量是抗性淀粉形成的重要条件,在最佳条件下,抗性淀粉得率显著增加。试验为国内抗性淀粉加工技术和工艺优化提供参考。
21世纪以来生活水平得到极大提高,饮食更佳丰富美味,但随之而来的糖尿病、高血压、高脂肪等现代病逐渐困扰越来越多的人群,健康观念得到普遍重视。因此,开发推广健康、绿色安全的新型食品,对健康饮食具有重大意义。抗性淀粉弥补普通膳食纤维的缺点,在功能性食品的生产和应用中有重要研究价值和广阔发展前景,特别是对健康生活具有重要作用[16]。

