鸭凝血因子Ⅷ的原核表达及多克隆抗体制备
刘 英,唐小涓,刘静静,张雯瑾,赖泓江,李德龙,2*
(1. 西南大学动物医学院,重庆402460;2. 西南大学医学研究院免疫学研究中心,重庆402460)
鸭疫里默氏菌(Riemerellaanatipestifer)是严重危害养鸭业的疫病之一,极易感染2~3周龄雏鸭[1-3]。鸭感染鸭疫里默氏菌后以严重肝损伤为主要特征,表现为典型的纤维素性肝包炎、内皮细胞损伤、血管通透性增加。内皮细胞是血管壁的重要组成部分,在调节血流、血小板激活、白细胞黏附等过程中发挥重要作用[4-5]。内皮细胞功能障碍是多种渗出性炎症发生过程中的促进因素,因此分离得到鸭肝窦内皮细胞对研究R.anatipestifer 致病机制有重大意义。Ⅷ因子常用来鉴定肝窦内皮细胞。但是,目前Ⅷ因子相关试剂和试剂盒主要集中在人或小鼠上,市面上缺乏鸭Ⅷ因子的相关试剂。因此,本研究拟制备鸭凝血因子Ⅷ多克隆抗体,为后续鸭肝窦内皮细胞鉴定提供试验材料。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
6~8周龄试验小鼠购自西南医科大学实验动物中心。
1.1.2 试剂
HRP 标记的山羊抗鼠IgG 购自Sigma 公司;DNA Ligation Kit、胶回收试剂盒、质粒抽提试剂盒等购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 鸭Ⅷ因子克隆与分析
根据NCBI 鸭Ⅷ因子序列(GenBank 登录号XM_027465529.1)设计6 对引物,分段扩增Ⅷ-1、Ⅷ-2、Ⅷ-3、Ⅷ-4、Ⅷ-5和Ⅷ-6,并设计相应引物,见表1。引物由武汉金开瑞生物工程有限公司合成。
雏鸭放血处死后,采集肝脏,提取总RNA,反转录为cDNA 后 PCR 扩增。反应条件:94 ℃ 4 min,(94 ℃ 30 s,52~55 ℃ 30 s,72 ℃ 1.5 min)×35 个循环,72 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳检测。
将回收的目的片段与T-载体连接,转化至E. coliDH5α,涂布LB 平板(Amp+),挑取单菌落,摇菌后提取质粒,鉴定正确后送武汉金开瑞生物工程有限公司测序,并利用生物学软件进行分析。

表1 鸭Ⅷ因子各基因片段引物序列Tab.1 The primer sequences of each gene fragment of duck factor Ⅷ
1.2.2 重组蛋白的诱导表达
根据抗原表位软件对鸭Ⅷ因子进行分析,发现其主要抗原表位位于C端,另依据E.coli最适密码子进行合成,即Ⅷ-C(m)。以pET-32a(+)构建重组表达质粒pET-Ⅷ-C(m),转化至E. coliBL21(DE3),挑菌,37 ℃ 摇菌至OD≈0.8;IPTG(1.0 mmol/L)诱导后离心,PBS重悬,菌体经超声破碎后离心,收集上清和沉淀,进行12%SDS-PAGE。
1.2.3 免疫抗原制备
Ⅷ-C(m)经SDS-PAGE分离,切取凝胶条带,烘干,研磨,加0.9%生理盐水充分匀浆,制备免疫抗原。
1.2.4 多克隆抗体制备
将16 只小鼠随机分为2 组,每组8 只,分别皮下注射Ⅷ-C(m)和0.1 mL PBS。以相同剂量加强免疫2 次,每次加强免疫间隔14 d。试验结束后处死小鼠,分离血清备用。
1.2.5 多克隆抗体效价检测
将Ⅷ-C(m)用pH 值9.6 碳酸盐缓冲液稀释(5 mg/L),4 ℃过夜;5%脱脂奶粉封闭,37 ℃孵育2 h;鼠抗Ⅷ-C(m)血清,37 ℃孵育 1 h;HRP 标记山羊抗鼠 IgG,37 ℃孵育1 h;TMB避光显色15 min,2 mol/L H2SO4终止反应。判定标准:S/N=(样品OD450)(/阴性对照OD450),S/N>2.1 为阳性。
2 结果与分析
2.1 Ⅷ-C克隆与序列分析(见图1)
由图 1 可知,PCR 扩增后得到 1 个 993 bp 的片段,经NCBI BLAST 比 对 ,与 鸭 Ⅷ(GenBank 登 录 号 XM_027465529.2)的相似性为99.39%。结果显示,成功获得Ⅷ-C基因。
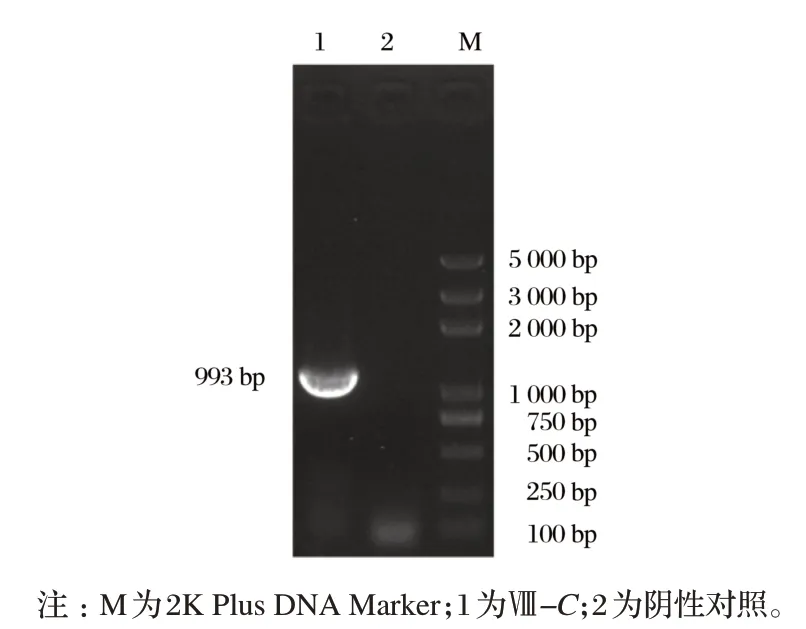
图1 Ⅷ-C基因的PCR产物Fig.1 PCR product of Ⅷ-C gene
2.2 重组蛋白的检测(见图2)
由图2可知,pET-Ⅷ-C(m)/E.coliBL21经IPTG诱导,SDS-PAGE可检测到约为54 kDa的重组蛋白,与预期重组蛋白pET-Ⅷ-C(m)大小一致。
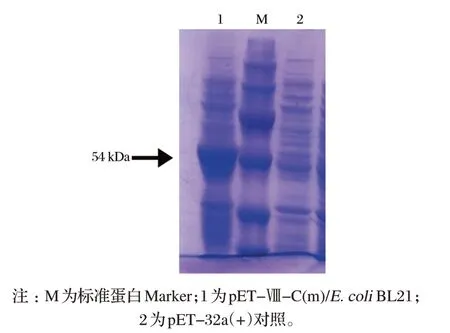
图2 pET-Ⅷ-C(m)/E.coli BL21重组蛋白的SDS-PAGE分析Fig.2 The analysis of recombinant protein of pET-Ⅷ-C(m)/E.coli BL21 by SDS-PAGE
2.3 免疫抗原制备(见图3)

图3 pET-Ⅷ-C(m)/E.coli BL21切胶纯化制备免疫抗原Fig.3 Preparation of immune antigen of pET-Ⅷ-C(m)/E.coli BL21 by gel purification
由图3 可知,切取Ⅷ-C(m)条带,烘干,研磨,使用0.9%生理盐水充分匀浆,制备免疫抗原。
2.4 鼠抗C4BPα(m)多克隆抗体ELISA结果(见表2)
由表2 可知,多克隆抗体在稀释度1∶104S/N 均大于2.1,因此鉴定为阳性,同时效价大于1∶104,但小于 1∶105。
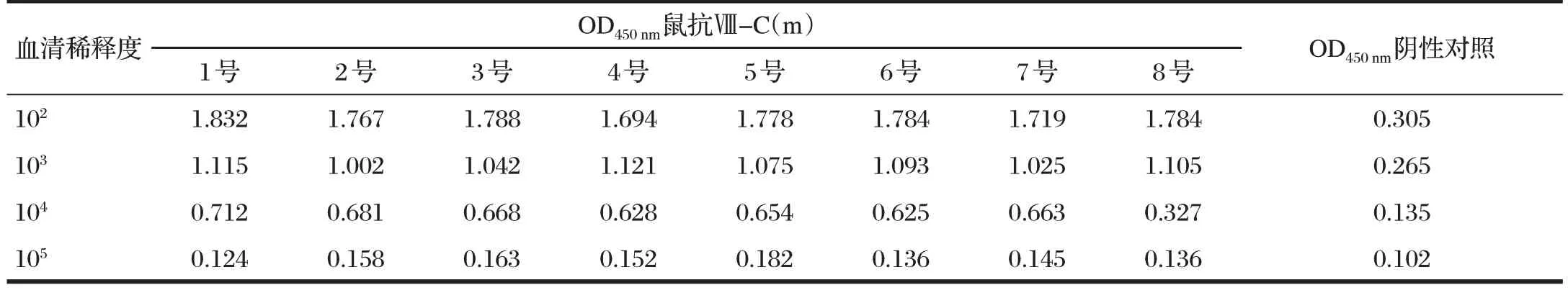
表2 鼠抗C4BPα(m)多克隆抗体ELISA结果Tab.2 Detection of polyclonal antibodies of mouse anti-C4BPα(m)by ELISA
3 讨论
R.anatipestifer 主要危害2~8 周龄雏鸭,给我国养鸭业造成巨大经济损失[1-3]。鸭传染性浆膜炎以纤维素性心包炎、肝周炎和气囊炎为主,在纤维素性渗出物中有多量炎性细胞浸润,主要是异嗜性粒细胞和巨噬细胞[6-9]。目前,R.anatipestifer 已经发现21 个血清型,并且随着研究的深入,新的血清型也不断出现[10-12]。R.anatipestifer 各血清型菌株间交叉免疫保护较差,因此疫苗免疫效果不佳。R.anatipestifer 极易产生耐药性,一旦发病,抗生素治疗作用不明显[13-16]。因此,只有尽快阐明其致病机制,才能找到新的防治措施。R.anatipestifer 感染主要引起广泛性的纤维素性渗出性炎症,而渗出性炎症发生的病理学基础在于血管内皮细胞损伤,致使血管通透性增加。另外,R.anatipestifer 感染主要引起雏鸭严重肝损伤,以纤维素性肝周炎为主,同时伴有肝索结构紊乱、肝细胞变性坏死、肝窦扩张淤血等病理变化。因此,阐明R.anatipestifer感染致肝窦内皮细胞的机制尤为重要。分离肝窦内皮细胞后需要进行鉴定,而Ⅷ因子多抗常被用来鉴定肝窦内皮细胞。但是,目前Ⅷ因子相关试剂和试剂盒主要集中在人或小鼠上,市面上缺乏鸭Ⅷ因子的相关试剂。因此,本研究通过制备鸭Ⅷ因子多抗,为鉴定鸭肝窦内皮细胞提供试验材料。
Ⅷ因子分子量较大,因此直接表达后进行纯化难度较大。本研究根据抗原表位预测软件对鸭Ⅷ因子全基因组序列进行分析,发现其抗原表位主要位于C 端。因此,对鸭ⅧC端(Ⅷ-C)进行密码子优化、原核表达,免疫小鼠制备多抗,并测定其效价。另外,在制备小鼠免疫抗原时,应用切胶纯化,操作方便、成本低,同时获得的多抗效价大于1∶104,说明多克隆抗体制备成功,可以满足后续试验需要。
4 结论
本试验结果表明,成功扩增出Ⅷ-C基因;SDS-PAGE可检测到约为54 kDa的Ⅷ-C(m)重组蛋白;ELISA检测多抗效价>1∶104。本研究为后续鸭肝窦内皮细胞鉴定提供试验材料。

