基于转录组学的芍药内酯苷抗肝癌的作用机制研究
周雅婷,罗志强,张彬彬,王武斌,孙睿,于国华*,史渊源,2*(.北京中医药大学生命科学学院,北京 02488;2.深圳北京中医药大学研究院,深圳 588)
肝癌是全球癌症诊出率排第六的癌症,西医疗法是治疗肝癌的主要策略(如手术切除、肝移植、射频、化疗和靶向分子治疗),但肝癌患者的一般预后仍然不佳[1]。中医学认为,癌症由痰浊、气滞、血瘀等病理产物与乖戾之气相合,郁积化为癌毒,邪盛正虚所致。临床治法强调肝脾同调,疗效肯定[2]。白芍在中医理论中归肝经,具有平肝止痛、养血调经、敛阴止汗等功效,其靶器官很可能在肝脏。实验研究表明白芍有抑制肿瘤生长[3]、逆转肿瘤耐药[4]、影响肝癌预后[5]、抑制细胞迁移和侵袭[6]等作用。但相关研究多集中于中药复方或者单味中药,中药药物成分复杂,有多靶点多通路作用的特点,对独立药物成分抗肿瘤作用的研究可以有助于更好地解释药物作用的分子机制、指导临床应用和新药研发。本研究选取肝癌治疗常用药白芍[7]的主要化学成分——芍药内酯苷[8]进行体外实验及转录组学研究,进一步探索其抗肝癌作用的生物学机制,为临床用药及新药研发提供参考。
1 材料
1.1 试药及细胞
芍药内酯苷(赛谱锐思科技有限公司,货号:B21149-20 mg);CCK8试剂盒(北京兰博利德商贸有限公司,货号:ceb044hu);Gibco澳洲胎牛血清(FBS,英潍捷基贸易有限公司,货号:10099141C);Corning-Cellgro RMPI 1640培养基(货号:10-040-CVR)、Corning-Cellgro 0.25%EDTA胰蛋白酶(货号:25-053-CI)(北京拜尔迪生物技术有限公司);Gibco青链霉素双抗(P/S,北京欧北生物科技有限公司,货号:15140122);PBS干粉(北京百诺威生物科技有限公司,货号:p1010);Qiagen RNA提取试剂盒RNeasy Mini Kit(上海优宁维生物科技股份有限公司,货号:74104);Illumina TruSeqTM RNA sample preparation Kit(货号:RS-122-2001)、Invitrogen SuperScript double-stranded cDNA synthesis Kit(货号:11917020)(上海美吉生物医药科技有限公司)。HepG2细胞系(北京协和医学院)。
1.2 仪器
光学普通倒置显微镜(日本Olympus CKX53);光学正倒置一体显微镜(日本ECHO RVL-100);CO2恒温培养箱160i(美国Thermo Scientific);酶标仪(美国Molecular Devices SpectraMax i3X);紫外分光光度计(美国Thermo NanoDrop One);高通量测序平台(美国Illumina Novaseq 6000);电泳仪(中国六一DYCP-32B);生物芯片分析仪(美国Agilent 2100)。
2 方法
2.1 溶液的配制
2.1.1 不同浓度芍药内酯苷溶液 取芍药内酯苷样品 5 mg,用RPMI 1640细胞培养基(含10%胎牛血清、1%青链霉素双抗)溶解,涡旋5 min,逐步稀释成浓度为50、100、250、500、1000、1500、2000、5000 μmol·L-1的溶液。
2.1.2 0.1%结晶紫溶液 称取适量结晶紫,用无水乙醇溶解配制成浓度为0.5%的结晶紫母液。以1∶4比例用PBS将其稀释成0.1%的结晶紫溶液,用以细胞侵袭实验染色。
2.2 细胞培养
HepG2细胞培养于含有10%胎牛血清、1%青链霉素双抗的DMEM培养基中,37℃、5%CO2条件下培养。每1~2日传代一次,取对数生长期的细胞进行实验。
2.3 CCK8法检测细胞活性
取对数生长期HepG2细胞进行消化计数,将细胞浓度调整为约4×104个·mL-1,以每孔180 μL分别接种于96孔板中,培养24 h后,分别加入20 μL各浓度芍药内酯苷溶液[终浓度为5、10、25、50、100、150、200 μmol·L-1],继续培养48 h后,每孔加入10 μL CCK8,孵育1 h后,用酶标仪测定在450 nm处的吸光度,计算细胞存活率。以不加药的细胞为对照。细胞存活率(%)=OD样品/OD对照×100%。
2.4 细胞侵袭实验
用无血清的预冷细胞培养基稀释matrigel基质胶,至浓度为250 μg·mL-1。将150 μL稀释胶加入到transwell上室中。37℃条件下孵育2~4 h后去除未结合的matrigel基质胶。饥饿细胞12~24 h后消化离心收集细胞沉淀,PBS清洗1~2遍,用适量芍药内酯苷溶液(终浓度为200 μmol·L-1)或培养基(对照)重悬,调整细胞浓度至2×105个·mL-1。取细胞悬液200 μL加入transwell小室,下室加入含血清的培养基500 μL。放入培养箱37℃、5%CO2条件下培养24 h后染色拍照计数。
2.5 总RNA提取
将细胞分成对照组(C组)和500 μmol·L-1芍药内酯苷给药组(ALB组)两个组,每组3个复孔。将细胞悬液铺进12孔板中,7200个/孔,培养24 h后,去除上层培养基,对照组加入培养基200 μL,给药组加入含终浓度为500 μmol·L-1的芍药内酯苷培养基溶液200 μL,37℃、5%CO2条件下培养24 h。加200 μL 0.25% EDTA胰蛋白酶将12孔板中的细胞消化1 min后终止消化,1000 r·min-1离心,弃去上清液,用PBS清洗细胞。按RNeasy Mini Kit说明书提取总RNA,测定RNA浓度和OD260/OD280比值后备用。
2.6 转录组测序
真核mRNA测序使用基于第二代测序技术的Illumina Novaseq 6000测序平台,对真核生物特定组织或细胞在某个时期转录出来的所有mRNA进行测序,测序实验采用Illumina TruSeqTM RNA sample prep Kit试剂盒进行文库构建。
2.7 测序数据处理
运用SeqPrep(https://github.com/jstjohn/SeqPrep)和Sickle(https://github.com/najoshi/sickle)软件对原始测序数据进行过滤分析。将质控后的数据,即clean data(reads)与参考基因组进行比对,使用HISAT2(https://daehwankimlab.github.io/hisat2/)[9]软件进行序列比对分析。获得用于后续分析的mapped data(reads),同时运用测序覆盖度的指标对本次测序的比对结果进行质量评估。使用软件StringTie(http://ccb.jhu.edu/software/stringtie/)[10]将mapped reads进行组装拼接,与已知转录本进行比较,获得没有注释信息的转录本,并对其中潜在的新转录本进行功能注释。总结它们注释到GO、KEGG、EggCOG、NR、Swiss-Prot、Pfam常用的六大数据库中的数量和百分比。使用RSEM[11]软件分别对基因/转录本的表达水平进行定量分析,获得每个样本基因/转录本的Read Counts。然后对其进行FPKM或TPM转换,进而得到标准化的基因/转录本表达水平。获得基因/转录本的Read Counts数后,运用DESeq2[12]多样本(≥ 2)项目进行样本间基因/转录本的表达差异分析,设定阈值差异倍数Fold-change ≥ 2,P-value<0.05筛选差异基因,通过Goatools[13]和R语言编写脚本分析对差异基因集进行聚类分析,GO功能分析,KEGG通路富集分析、基因表达差异分析。
3 结果
3.1 抗肝癌活性
芍药内酯苷抗肝癌活性结果见图1。48 h后,HepG2细胞随着芍药内酯苷浓度升高,存活率显著下降,在200 μmol·L-1时,存活率只有54%,接近其IC50值。说明芍药内酯苷具有抑制肝癌细胞生长的效果。

图1 芍药内酯苷对HepG2细胞的生长抑制作用(n=3)Fig 1 Growth inhibitory effect of albiflorin on HepG2 cells(n=3)
3.2 细胞侵袭实验
如图2所示,当芍药内酯苷浓度为200 μmol·L-1时,具有显著的抑制肝癌细胞侵袭的效果(P<0.05)。说明抑制侵袭可能是芍药内酯苷发挥抗肿瘤作用的途径之一。
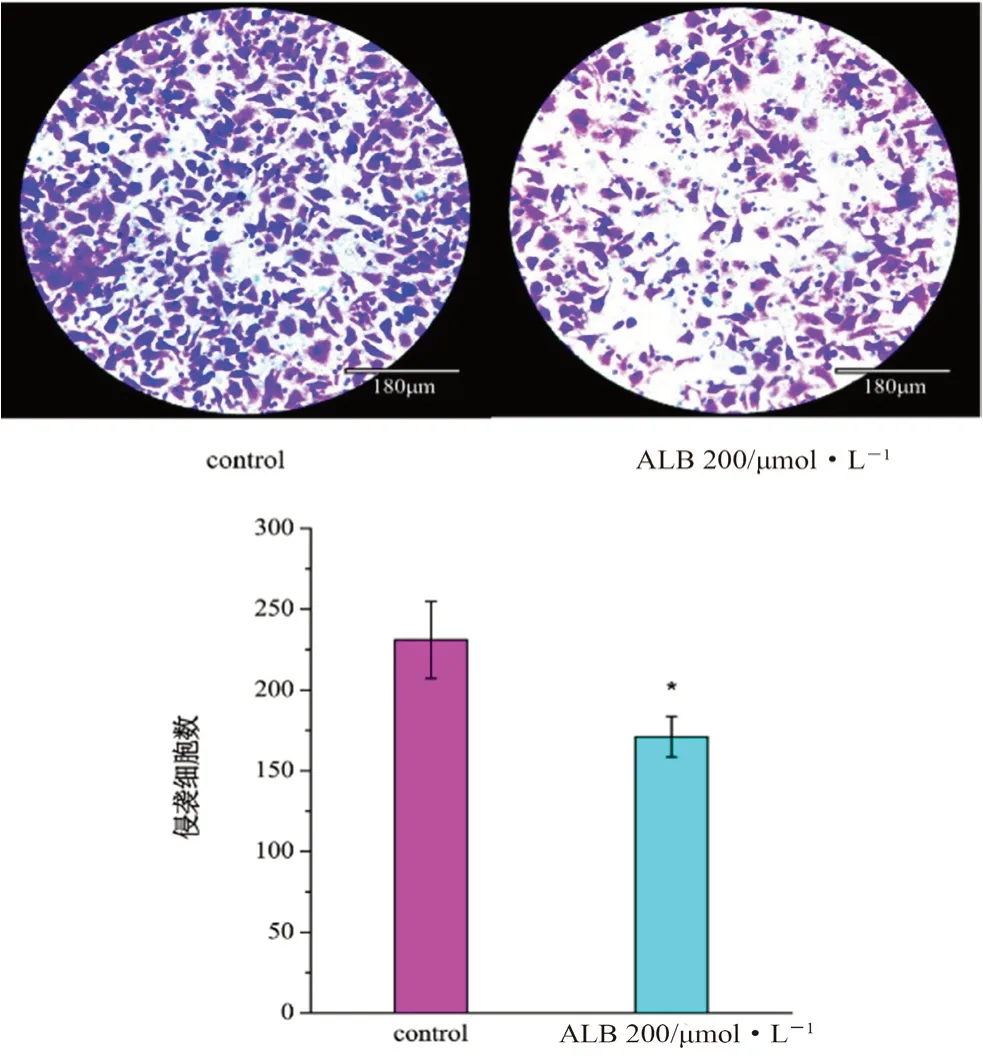
图2 芍药内酯苷对HepG2细胞侵袭抑制作用(n=3)Fig 2 Inhibition of albiflorin on the invasion of HepG2 cells(n=3)
3.3 测序数据质控
对原始测序数据测序接头序列、低质量读段等因素过滤后的质控分析如表1所示。由表1可知,对原始数据低质量的因素进行过滤后,所测样本的Q30仍全部大于90%,说明样本的测序质量很高,可以用于序列比对分析。

表1 测序数据质控结果分析表Tab 1 Analysis table of sequencing data quality control results
3.4 转录组表达分析
一般认为基因表达量(log10[TPM])在1以上具有较好的表达效果。因此,我们设置表达量为1,经筛选得到,ALB组表达14 167个基因,C组表达14 184个基因,经韦恩图分析发现,交叉基因13 815个,单独在ALB组表达的基因数是352个,单独在C组表达的基因数是369个。
3.5 转录组差异分析
经筛选,ALB组与空白C组相比,共得到340个差异表达基因,其中上调基因154个,下调基因186个,见图3(横坐标为基因在两个样本间表达差异的倍数变化值的对数,纵坐标为基因表达量变化差异的统计学检验值,即P值的对数。图中每个点代表一个特定的基因,红色点表示显著上调的基因,绿色点表示显著下调的基因,灰色点为非显著差异基因)。通过对340个差异基因进行GO功能富集和KEGG功能富集,对差异基因的功能进行分类和关联。筛选得到GO条目的前10个条目,包括富集到BP模块的差异基因,主要涉及到半乳糖基神经酰胺生物合成、IL13的细胞应答和钙离子跨膜转运等过程;富集到CC模块的差异基因,主要涉及到核内膜和核膜部分的组成;富集到MF模块的差异基因,主要涉及到胆碱跨膜转运蛋白活性。结果见表2。

图3 差异基因火山图Fig 3 Differences gene volcanic map

表2 GO功能富集结果Tab 2 Results of GO functional enrichment
KEGG功能富集分析筛选得到8条生物学通路,见图4,包括色氨酸代谢通路、磷酸肌醇代谢通路、神经活性配体-受体相互作用通路、癌症胆碱代谢通路、肾素-血管紧张素系统通路、钙信号通路、炎症介质对色氨酸通道的调节通路、缝隙连接通路,主要集中在信号转导、代谢活动、神经活性等方面。

图4 KEGG功能富集的关键生物学通路Fig 4 Key biological pathways of KEGG functional enrichment
肝癌的发展过程一般呈现出四个阶段,从炎症反应到脂肪变性到肝硬化再到肝细胞癌,在这个过程当中,代谢功能出现了紊乱,尤其是脂质代谢和蛋白质代谢的异常变化[14-15]。脂质是细胞膜的主要组成部分,在肿瘤细胞的血管形成、细胞增殖、侵袭及转移中具有不容忽视的作用。蛋白质代谢产生氨基酸,肝癌细胞对氨基酸的代谢是其能量的主要来源,对细胞的生长增殖具有重要意义。因此,癌症胆碱代谢通路、磷酸肌醇代谢通路与色氨酸代谢通路在肝癌细胞的发展过程中发挥重要作用。
肾素-血管紧张素系统常常在肝病患者体内活化增高,血管紧张素Ⅱ可以诱导血管内皮生长因子形成,促进血管生成,推动肿瘤的基本发展过程,引起肝癌的发生和加剧[16]。
瞬时受体电位(transient receptor poential,TRP)通道,是广泛存在的一种阳离子通道,可以与多种炎症因子结合,激活TRP通道通透钙离子(Ca2+)等阳离子,活化钙信号通路等阳离子信号通路,通过对阳离子浓度变化的调节进一步影响细胞内相应信号通路的传递、转导和整合,引起细胞功能特性的改变[17]。Ca2+作为一种重要的信号转导媒介,可以通过TRP通道的传导,激活下游的生物学过程,促进肝癌细胞的增殖。
近年来,神经系统和神经递质在肿瘤微环境中的作用逐渐受到关注,研究表明其通过激活相应的信号通路来刺激细胞生长或增加细胞的迁移活动[18],提示了神经活性配体-受体相互作用通路在肝癌发展过程中的重要性。
研究发现,细胞缝隙连接与肿瘤的生长、增殖和变化关系密切[19]。在癌变初始阶段,癌细胞与周围正常细胞的细胞间隙连接功能被抑制,通信障碍导致细胞丧失接触抑制而无限扩增,由此形成癌变[20]。赵增强等[21]通过实验研究发现,冬凌草甲素能增强 HepG2细胞间缝隙连接功能,重建HepG2细胞间通信,阐释了该药物治疗肝癌的可能的作用机制之一,说明细胞缝隙连接在肝癌发生发展进程中发挥了重要作用。
芍药内酯苷对8条关键通路的调控集中于10个上调基因(GRM1、ADRB1、P2RX7、BDKRB1、REN、ASIC4、SLC22A2、AC002996.1、AC104662.2、AC092143.2),12个下调基因(TUBA8、PHKA2-AS1、CACNA1H、PLCG1-AS1、RHEBP1、SLC44A5、AANAT、AC135048.1、AL513325.1、AC027796.3、AC011603.2、AL355315.1),其中调控两条以上关键通路的基因为BDKRB1(2条)、AC011603.2(2条)、TUBA8(2条)、ADRB1(3条)、GRM1(3条)、PLCG1-AS1(4条)。
4 讨论
中药对肿瘤的杀伤能力普遍弱于化学药物,但中药在提高患者免疫力,减轻放化疗的毒副作用、减轻疼痛、防止癌细胞转移等方面具有独特的优势。因此,采用中药配合放化疗等主流疗法来抗击肿瘤,对于提高患者的生存质量具有重要的意义[22]。本研究选取芍药代表性成分芍药内酯苷来探讨其抑制肝癌的作用效果,芍药内酯苷能有效抑制肿瘤生长和侵袭,在25 μmol·L-1时对HepG2的抑制率即达到30%,且已有动物实验表明芍药内酯苷具有明确镇痛作用[23-24],可联合化学药物作为辅助用药,降低化学药物用药剂量,减轻患者痛苦。
本研究结合转录组测序技术探究了芍药内酯苷抗肝癌细胞的调控机制,获得了芍药内酯苷调控的关键差异基因,并通过大数据通路富集等方法,进一步挖掘了其分子作用机制。GO功能中富集的差异基因,主要涉及到半乳糖基神经酰胺生物合成、IL13的细胞应答和钙离子跨膜转运、核内膜和核膜部分的组成、胆碱跨膜转运蛋白活性。在KEGG功能分析中,主要集中在信号转导、代谢活动、神经活性等方面。许多重要的细胞生命活动如细胞增殖、分化以及死亡均与信号传导密不可分。代谢为细胞增殖迁移活动提供能量保障。KEGG富集通路中受调节的重要编码区上调基因为BDKRB1、ADRB1、GRM1,下调基因为TUBA8。BDKRB1为缓激肽受体,BDKRB1上调可通过下游响应促进PAK表达[25],抑制MLCK降低肌球蛋白收缩,减少肝癌细胞迁移[26];BDKRB1还可以通过调节钙离子信号通路上调PKC同工酶表达,抑制肿瘤细胞侵袭[27]。TUBA8编码α微管蛋白家族的成员,实验表明TUBA8过表达增强HepG2细胞中的细胞迁移[28]。ADRB1、GRM1通过调节cAMP、Ca2+浓度影响PKA、PKC,调控细胞缝隙连接,抑制肝癌细胞迁移和增殖[29-30]。因此,芍药内酯苷很可能是通过对上述相关通路及基因进行调控实现抑制HepG2细胞系的生长增殖与迁移。
综上所述,芍药内酯苷对于减少化学药物的给药剂量以减轻其毒副作用,减轻患者癌性疼痛和减少癌细胞侵袭等具有“增效减毒”的可能。这一方面可为白芍的临床应用及生物学效应机制提供部分理论支持;另一方面可为新药研发提供指导。

