宜昌地区人群CYP2C19和PON1基因型分布与氯吡格雷抵抗风险相关性研究
奚炜,贾亮亮*,金桂兰,邢翔飞,彭官良,徐帮,闫喜明(.宜昌市第一人民医院,湖北 宜昌 443000;2.三峡大学药物制剂研究所,湖北 宜昌 443000)
氯吡格雷作为P2Y12受体拮抗剂,通过选择性地抑制二磷酸腺苷(adenosine diphosphate,ADP)与其血小板P2Y12受体的结合及继发的ADP介导的糖蛋白 GPⅡb/Ⅲa复合物的活化,从而产生抑制血小板聚集的作用[1]。有临床研究报道,部分患者服用标准剂量氯吡格雷(75 mg·d-1)进行抗血小板治疗后并不能取得预期的抑制血小板聚集的效果,临床上将这个现象称之为氯吡格雷抵抗[2-3]。研究表明,细胞色素P4502C19(cytochrome P450 2C19,CYP2C19)和对氧磷酶1(paraoxonase-1,PON1)基因多态性与氯吡格雷在体内吸收代谢存在明确关联性,是导致氯吡格雷疗效减弱甚至治疗失败的重要影响因素[4]。CYP2C19基因代谢表型和基因表型的分布有明显的种族和地域差异。慢代谢型在中国人群中发生率近15%[5],在白种人中发生率仅为3%[6]。不同地区和民族CYP2C19基因型和代谢型有明显的差异[7],宜昌地处鄂西南,是一个土家族聚居、多民族杂居的地区。全市现有少数民族人口47.2万人(据第六次人口普查),占全市总人口的11.63%,其中土家族占全部少数民族人口的87.4%。因此,通过分析宜昌地区CYP2C19和PON1基因型分布与氯吡格雷抵抗风险的流行病学调查对于本地患者氯吡格雷的安全有效服用更具有指导意义。
1 资料与方法
1.1 一般资料
收集2018年1-12月在本院就诊并服用氯吡格雷的266例患者进行CYP2C19和PON1基因多态性检测,共检测952个位点,包含男性175人,女性91人。其中检测3个位点(CYP2C19*2、CYP2C19*3、PON1)的人数为112人,检测4个位点(CYP2C19*2、CYP2C19*3、CYP2C19*17和PON1)的人数为154人。纳入本研究的患者均签署知情同意书。
1.2 仪器与试药
患者每人采集外周静脉血3 mL(EDTA抗凝),采取荧光染色原位杂交分析技术对患者血液标本进行CYP2C19*2(rs4244285,c.681G>A),CY-P2C19*3(rs4986893,c.636G>A),CYP2C19*17(rs12248560,c.-806C>T)和PON1(rs662)基因型检测。L998A型荧光检测仪(西安天隆科技有限公司);BY-400C型医用离心机(北京白洋医疗器械有限公司);核酸纯化试剂、基因检测通用试剂和10×NH4Cl溶液(北京华夏时代基因科技发展有限公司)。
1.3 统计学方法
应用SPSS 17.0统计软件进行数据处理。计量资料以±s表示,计数资料以率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 CYP2C19和PON1基因型分布
纳入本研究的人群中CYP2C19*2基因以GG型为主,为123例(46.24%);AA型为43例(16.17%);等位基因A突变概率为34.96%。CYP2C19*3基因以GG型为主,为232例(87.22%);GA型为34例(12.78%);等位基因A突变概率为6.39%。CYP2C19*17基因以CC型为主,为153例(99.35%);CT型为1例(0.65%);等位基因T突变概率为0.32%。PON1基因以GA型为主,为127例(47.74%);GG型为111例(41.73%);AA型为28例(10.53%);等位基因A突变概率为34.40%。纳入本研究人群中,CYP2C19*2,CYP2C19*3,CYP2C19*17和PON1等位基因分布符合Hardy-Weinberg平衡定律(P>0.05),表明研究对象具有代表性,详见表1。
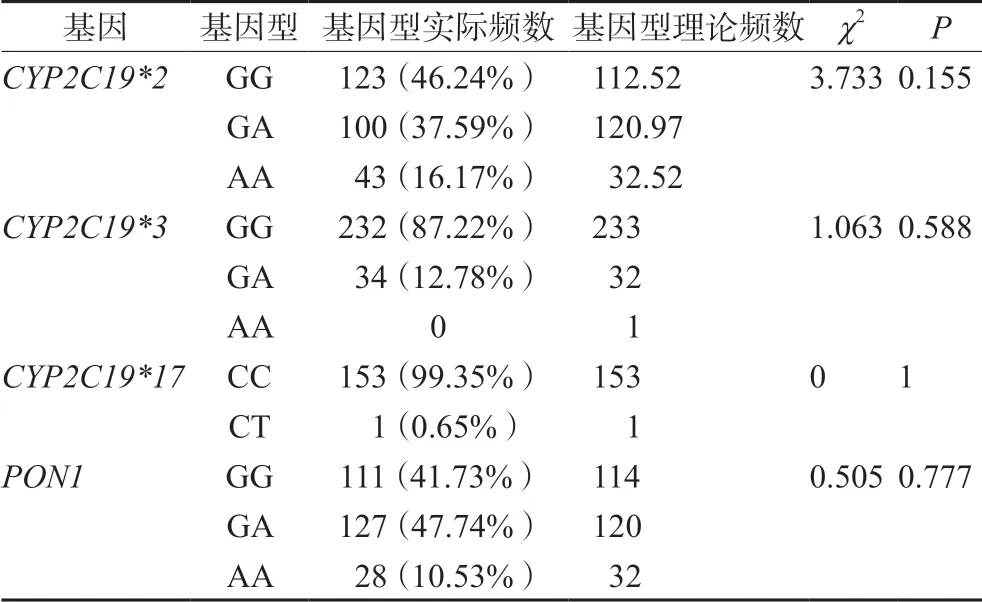
表1 患者CYP2C19和PON1基因型及等位基因的频率分布Tab 1 Frequency of CYP2C19 and PON1 genotypes and alleles in patients
2.2 不同性别 CYP2C19和PON1基因型分布
通过分析患者CYP2C19*2、CYP2C19*3、CYP2C19*17和PON1在男女患者基因型分布发现,CYP2C19*2的3种基因型在男性和女性间分布不同(P<0.05)。CYP2C19*3、CYP2C19*17、PON1不同基因型在男性和女性之间分布差异无统计学意义(P>0.05),详见表2。
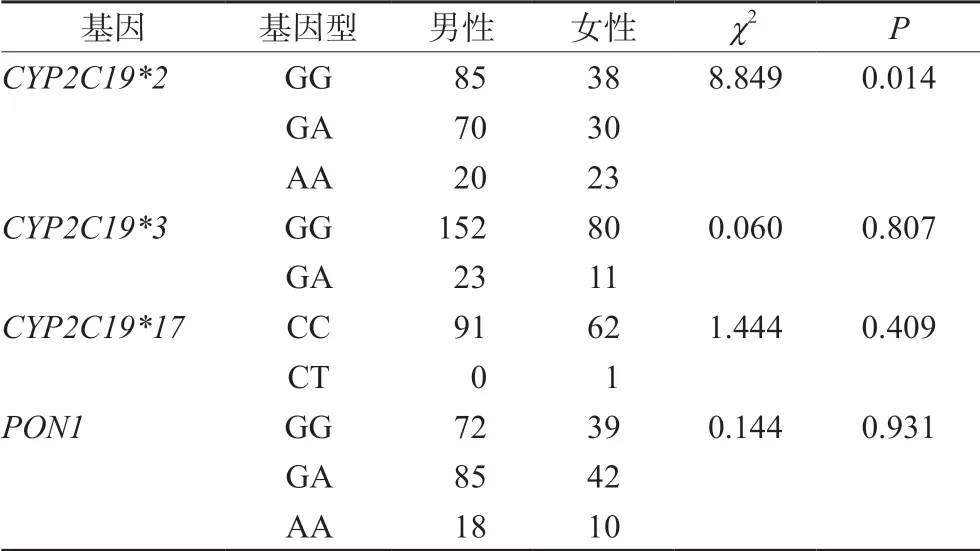
表2 CYP2C19和PON1基因型在不同性别间多态性分布Tab 2 Polymorphism of CYP2C19 and PON1 genotypes between genders
通过进一步研究发现,在266例患者中女性CYP2C19*2基因突变率显著高于男性(41.76%vs31.43%,P=0.018),结果提示女性发生氯吡格雷抵抗的风险可能高于男性,详见表3。
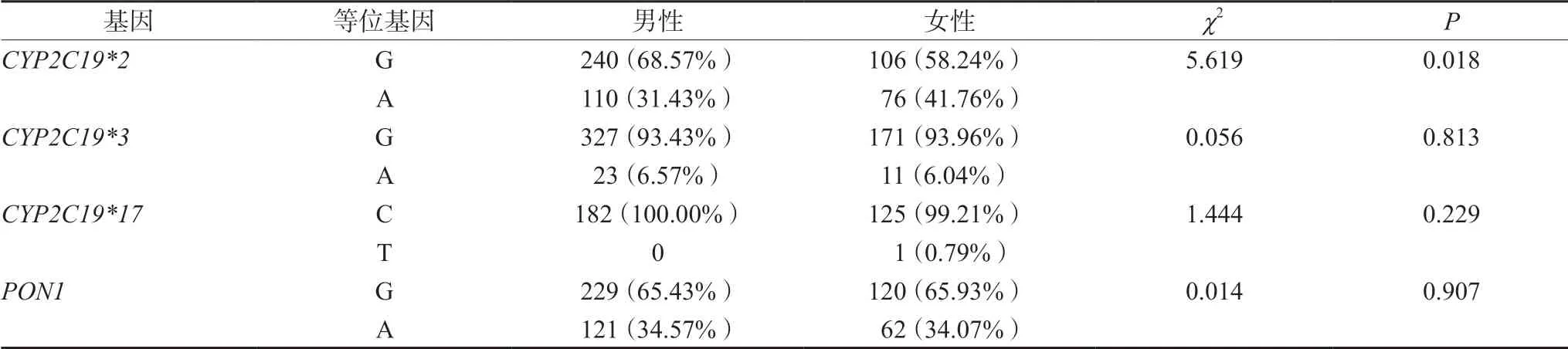
表3 CYP2C19和PON1等位基因在不同性别间多态性分布Tab 3 Polymorphism of CYP2C19 and PON1 alleles between genders
2.3 CYP2C19和PON1代谢型分布及氯吡格雷抵抗风险度分析
CYP2C19*2、CYP2C19*3、CYP2C19*17以及PON1各位点基因的突变会造成代谢酶活性的改变,因此根据各位点突变的情况可将CYP2C19和PON1代谢酶分为4种不同的代谢类型:超快代谢型(UM),快代谢型(RM),中间代谢型(IM)和慢代谢型(PM)。
在纳入的266例患者中,CYP2C19和PON1代谢类型主要为正常代谢型和中间代谢型。其中有1例患者CYP2C19代谢类型为超快代谢型,将本研究结果与国内文献[8-11]发表的不同种族人群CYP2C19代谢型比较发现,宜昌地区人群CYP2C19代谢型的分布与国内其他地区不同种族人群分布有显著差异,详见表4。
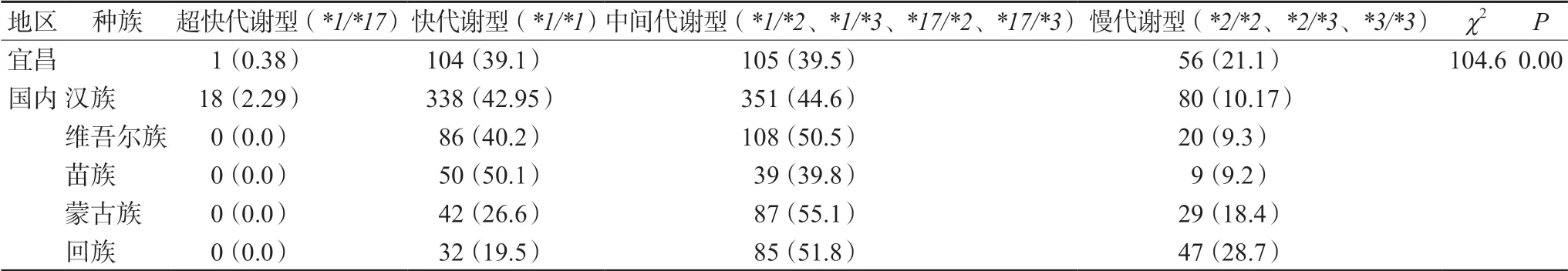
表4 宜昌与国内其他地区民族患者 CYP2C19 代谢表型的比较Tab 4 CYP2C19 metabolic phenotypes in Yichang and other ethnic patient groups in China
PON1酶是氯吡格雷代谢过程中的关键酶,控制着2-O-氯吡格雷生成活性产物,PON1编码基因突变会使PON1酶活性下降[12]。PON1GG纯合,氯吡格雷活性代谢物水平高;AG杂合,氯吡格雷活性代谢物水平中等,有部分氯吡格雷抵抗风险;AA纯合,氯吡格雷活性代谢物水平低,有氯吡格雷抵抗风险。本次纳入研究的266例患者中,111例PON1代谢型为GG纯合,提示无氯吡格雷抵抗风险;127例PON1代谢型为AA纯合型,提示存在部分氯吡格雷抵抗风险;28例PON1代谢型为AA纯合型,提示存在明确的氯吡格雷抵抗风险。
氯吡格雷的代谢受多种酶的调控[13],纳入分析的酶的种类越多,其氯吡格雷抵抗风险评估越准确。本研究通过结合患者CYP2C19和PON1两种酶的代谢类型来计算患者服用氯吡格雷出血或发生血栓风险的风险度值更为准确。通过北京华夏时代基因科技发展有限公司提供的氯吡格雷抵抗风险度分级计算方法(由公司技术人员重点依据CPIC指南,CYP2C19基因型与氯吡格雷治疗及TRITON-TIMI 38研究结果得出),将患者发生氯吡格雷抵抗风险度分为5个等级,见表5。
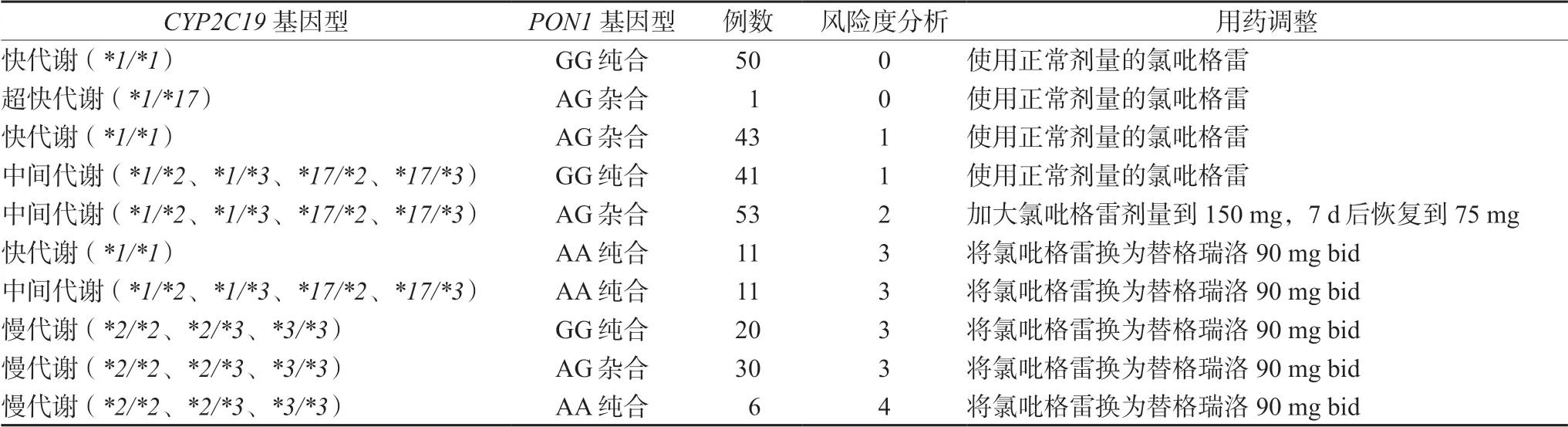
表5 患者氯吡格雷抵抗风险度分析Tab 5 Risk analysis of clopidogrel resistance in patients
在纳入研究的266例患者中,有1例CYP2C19代谢类型为超快代谢型,但其PON1代谢类型为中间代谢型(基因型为GGGGCTGA),综合评价该患者氯吡格雷抵抗风险度为0,该患者按常规氯吡格雷剂量给药,应可获预期疗效。临床药师在患者出院后1个月、3个月和6个月的随访过程中,该发现患者按照每日75 mg剂量服用氯吡格雷,未发现出血等不良反应。266名纳入研究的患者中,氯吡格雷使用风险度≥2的患者有131人,占比49.2%,提示49.2%的患者服用氯吡格雷后存在氯吡格雷抵抗。针对这类患者需要增加氯吡格雷的使用剂量或换药为替格瑞洛。
3 讨论
氯吡格雷是一种前体药物,其在肝脏中经CYP450酶代谢后生成能选择性抑制ADP与其血小板P2Y12受体的结合活性产物而发挥抑制血小板聚集的作用。其中CYP2C19酶在氯吡格雷生物转化中发挥非常重要的作用。CYP2C19是由CYP2C19基因编码,存在高度的种族分布差异和遗传多态性[14]。有研究表明,CYP2C19等位基因中*2、*3、*17基因的突变可明显影响对氯吡格雷代谢,*2、*3等位基因发生突变会导致CYP2C19酶活性降低,*17等位基因发生突变会增强CYP2C19酶活性,增加血风险[15-16]。依据各位点突变的类型,可将CYP2C19酶分为4种类型:快代谢型(RM,*1/*1);超快代谢型(UM,*1/*17,*17/*17);中间代谢型(IM,*1/*2,*1/*3,*17/*2,*17/*3);慢代谢型(PM,*2/*2,*2/*3,*3/*3)[17]。常规剂量的氯吡格雷在慢代谢型患者中产生的活性代谢物减少,抑制血小板聚集作用下降,形成血栓风险增加;在超快代谢型患者中产生活性代谢产物增加,抑制血小板聚集作用增强,出血风险增加。因此,2010年美国FDA修改的氯吡格雷说明书中黑框警示:CYP2C19基因型检测结果应作为医师调整治疗策略的参考。
在临床实践中发现,有些CYP2C19野生型的患者常规剂量服用氯吡格雷后仍存在疗效不佳现象,发现PON1基因多态性对氯吡格雷的吸收和代谢也存在重要影响[18]。PON1酶是氯吡格雷代谢过程中的关键酶,控制着2-O-氯吡格雷生成活性产物,PON1编码基因突变会使PON1酶活性下降[12]。PON1GG纯合,氯吡格雷活性代谢物水平高,血小板活性被抑制程度高,几乎无氯吡格雷抵抗风险。该基因发生突变为AG杂合或AA纯合,氯吡格雷活性代谢物水平下降,血小板活性被抑制,存在氯吡格雷抵抗风险,半年后出现支架血栓的风险比为4.52[19]。韩国一项研究也同样证明,PON1突变会增加心肌梗死、缺血事件、支架血栓等风险[20]。
本次检测的266例患者中,CYP2C19*2、CYP2C19*3和CYP2C19*17主要为野生纯合型,占比分别为46.24%和87.22%以及99.35%,基因突变的频率为34.96%和6.39%以及0.32%。通过进一步分析患者CYP2C19*2、CYP2C19*3、CYP2C19*17和PON1在男女患者基因型分布发现,CYP2C19*2在男性和女性间3种基因型分布不同,女性CYP2C19*2(G>A)基因突变率高于男性(P=0.018),表明女性发生氯吡格雷抵抗的风险可能更高。PON1不同基因型在男性和女性之间分布无统计学差异。
266例患者中PON1基因型以GA杂合型为主,占比47.74%,基因突变的频率34.40%。结合患者CYP2C19及PON1基因型计算患者发生氯吡格雷抵抗的风险度。结果显示有50.8%的患者氯吡格雷抵抗风险较低(风险度为0和1),对于这部分患者给予按正常剂量服用氯吡格雷的用药建议[21]。有20%的患者存在部分氯吡格雷抵抗(风险度为2),对于这类患者,按常规氯吡格雷剂量给药,氯吡格雷转化为活性代谢产物效率下降,因此给予加大氯吡格雷剂量到150 mg的用药建议[22]。有29.4%的患者存在氯吡格雷抵抗(风险度为3和4),因此给予将氯吡格雷换为替格瑞洛90 mg bid的用药建议[21]。
本次调研中,发现宜昌地区CYP2C19快代谢型流行率为39%,IM型中间代谢型流行率为39%,慢代谢型流行率为21%。发现1例超快代谢型患者。通过该研究了解本地区的心脑血管疾病患者CYP2C19基因型分布情况。目前研究发现氯吡格雷的药代动力学和药效学通路上除了与CYP2C19、PON1有关外,还与CYP2C9、CYP3A4、CYP3A5和P2Y12R等基因的变异有关,同时合并药物的药物间相互作用等因素均会影响氯吡格雷在体内的抗血小板作用[23]。下一步,我们将纳入更多监测指标,扩大研究样本量,对本地区心脑血管疾病的发病风险,以及介入治疗后的抗凝、抗血小板治疗提供个体化用药依据,降低患者再次发生血栓风险,提高治疗效果。

