维生素D类药物及其类似物的研发进展
赵洺良 王明刚 刘振玉 孙桂玉 王清亭 杜昌余 陈阳生
正大制药(青岛)有限公司,山东 青岛 266510
人类皮肤中的UV-B(290~315 nm)依赖性非酶反应将胆固醇前体7-脱氢胆固醇转变为维生素原D3,维生素原D3进一步异构化为维生素D3(图1 A)[1]。 同样,经紫外线B辐射的植物和蘑菇也能够使膜固醇麦角固醇生成异构化的维生素D2(图1B)[2]。两种类固醇本身都是生物惰性的,须使其C-25处被活化,然后羟基化生成25(OH)D3(图1C)和25(OH)D2,最后在C-1处羟基化,分别生成1,25(OH)2D3(图1D)[3]和1, 25(OH)2D2。见图1。

图1 维生素D代谢产物和部分已上市维生素D类似物
25(OH)D3是最稳定和最丰富的维生素D代谢产物,其血清水平是测定个体维生素D水平的生物标志物[4]。研究[5]发现,维生素D3的生物活性形式1,25(OH)2D3通过激活转录因子维生素D受体(VDR)作为直接影响基因调控的核激素而起作用。维生素D的生理作用首先是调节钙稳态以维持骨骼钙化[6],同时还可以通过调控先天和适应性免疫来调节机体对微生物感染的应激反应水平[7],比如在人体对结核分枝杆菌的应激反应应答中,维生素D起到至关重要的作用[8]。最后,维生素D还可以预防自身免疫性疾病如多发性硬化等[9]。
随着社会生活水平的不断提高,现代人类的生活方式改变(例如主要呆在室内,并在户外被纺织品衣物覆盖,以及使用各类防晒用品),再加上季节和气候的变化,导致了人体对紫外线中的UV-B暴露不足,维生素D3的内源性生产水平有所降低。目前,人类食谱中仅富含脂肪的鱼类和经过UV-B照射的蘑菇具有较高含量的维生素D3或维生素D2,这导致了日常饮食中维生素D的摄入量普遍较低。因此,在某些国家/地区使用添加了维生素D3或维生素D2的牛奶、人造黄油和果汁作为维生素D补充剂。此外,有文献[10]建议在冬季,尤其是中老年人和儿童,每天至少补充25 μg(1 000 IU)的维生素D3,以防止维生素D缺乏症。维生素D缺乏不仅会导致某些儿童疾病(如佝偻病),而且还会导致成年人罹患骨质疏松症或骨软化症[11],从而增加骨折的风险。此外,维生素D缺乏还会损害免疫系统的功能。近年来,普通人群对于维生素D补充剂的需求量明显增加,维生素D补充产品的销售额在10年内增长了近15倍[12]。
毫无疑问,补充足够的维生素D对于骨骼健康很重要[13],但是过量服用维生素D3、1,25(OH)2D3或其合成类似物可能会导致组织钙化[14],并产生高血钙症。因此,目前开发维生素D类似物的主要目的是通过结构修饰,降低化合物的钙化作用,提高选择性。近几十年来,各大制药公司和科研团队总共开发了3 000多种合成维生素D类似物,以提高原天然化合物的生物学特性,并期望用于治疗皮肤自身免疫性疾病[15]或骨代谢疾病[16]。然而,到目前为止,只有少数维生素D类化合物进入市场(图1)。除了维生素D3被广泛用作营养补充剂之外,商业上比较成功的维生素D类似物有卡泊三醇(图1E)、度骨化醇(图1F)、阿法骨化醇(图1G)、他骨化醇(图1H)、帕立骨化醇(图1I)、奥沙钙醇(图1 J)、氟骨化醇(图1 K)和艾地骨化醇(图1 L)[17-18]。维生素D3类似物如依奈骨化醇(图1 M)或西奥骨化醇(图1 N),虽然在体外表现出了很强的抗肿瘤活性,但是在急性髓样白血病或胰腺癌的II期临床试验中均宣告失败[19]。科研人员在研究[20-21]中发现,一些维生素D靶基因与免疫系统密切相关,例如抗菌肽(cathelicidin,CAMP)和编码Toll样受体4核心受体(CD14),对该类化合物具有较强的应答。该类药物或化合物在抗癌试验中失败,但在骨代谢疾病治疗中成功,以及在免疫细胞中存在显著的基因调节作用。这些结果表明,作为VDR配体的维生素D类化合物及其衍生物在骨代谢相关功能调节以及免疫疾病中比在癌症中更加具有治疗潜力,这也为该类药物的临床应用指明了方向。
1 维生素D药物作用机理
人类基因组中,维生素D受体(VDR)是唯一被表达的且能够在亚纳摩尔浓度下结合1,25(OH)2D3及其类似物的蛋白质[22],因此,维生素D类化合物的所有生理功能都是由VDR及其靶基因介导的[23]。VDR基因不仅在肠、肾和骨骼中表达水平较高,同时在其他多种人类组织和细胞类型中,也发现了VDR的表达[24]。这意味着与钙稳态和骨骼形成有关的组织细胞与具有免疫功能的细胞对环境维生素D的水平都有应答作用[25],从分子水平证实了维生素D类药物对骨代谢以及免疫疾病具有治疗作用。
进一步的研究[26]发现,VDR配体诱导了LBD的构象转变,LBD共抑制蛋白被共激活蛋白替代,这说明,VDR配体结合诱导了受体不同的蛋白质与蛋白质的相互作用模式。VDR激动剂可有效抑制LBD上的共阻遏物,并允许共激活因子与介体复合物特异性结合(图2)。共激活因子还吸引染色质修饰酶,这些酶在组蛋白VDR结合位点附近参与核小体组蛋白的读取以及转录[27]。此外,染色质重塑复合物的表观遗传学变化允许VDR结合增强子向整个人类基因组中数百至数千个基因上可及的转录起始位点(TSSs)循环[28- 29]。这些增强子TSSs组装体由配体激活的VDR触发,最终可导致数百种主要的维生素D靶基因的表达增加或减少(图2)。目前为止,有文献[30]报道了约150种包括人、大鼠和斑马鱼VDR-LBD结构的蛋白质结晶。由于每种维生素D类似物的三个羟基基团占据几乎相同的位置,因此通过将LBD稳定在大致相同的构象中,维生素D类药物的空间表现均类似于1,25(OH)2D3。

图2 维生素D信号通路[26]
对维生素D类似物进行化学修饰的主要目的是将三个锚定的羟基与1,25(OH)2D3保持在相同的位置,可以最有效地填充LBP,以保证足够的氢键或疏水性接触。此外,从头设计的带有修饰的非甾族化合物,例如通过具有芳香性的环交换经典的甾族环结构也被合成出来。研究这些分子的目的,是为了保留LBP内表面衬里的氨基酸残基的疏水相互作用,以及增加与芳族氨基酸残基的堆积相互作用。本文同样探讨了这些不同种类的维生素D类似物的研究进展。
2 侧链修饰
Mourino等[31]报道了一系列具有刚性侧链的维生素D类似物(图3 A-3D),该类化合物是以Inhoffen-Lythgoe二醇为原料,通过Wittig-Horner反应聚合而成的。生物活性实验结果表明,与1,25(OH)2D3相比,这些类似物使得VDR依赖性转录被显著激活。最新的研究结果[32]表明, C-22位独特的二炔类似物结构修饰以及通过乙烯基(pinacolo)硼酸酯方法获得的C-17位甲基取代类似物,前者在激活VDR方面的效力较低,后者比1,25(OH)2D3更有效地结合VDR。
1,25cD3(图3E)是一种新颖的维生素D类似物,其中邻-碳硼烷部分取代了C-25羟基[33]。尽管不含C-25羟基,但是1,25cD3对VDR的亲和力是1,25(OH)2D3的2倍,并且在诱导靶基因活性方面与天然激素维生素D3具有同等活性,同时未显示出不良的降钙作用。此外,与大多数其他维生素D类似物一样,1,2,5cD3与VDR的LBD的复合物的构象与1,25(OH)2D3的构象高度相似,蛋白质三维模型也显示出相同的拓扑结构。对该蛋白结合域分析结果表明,螺旋H6和H7之间的环是受体激活的关键区域,螺旋H11的最后一部分显示了0.6的偏移;碳硼烷侧链比1,25(OH)2D3长2.4Å,但是它是疏水的,因此在VDR-LBP的这一部分中有利于与疏水氨基酸的相互作用。这一定程度上补偿了C-25羟基基团缺失造成的氢键损失(图4 A, 图4B)。这些影响在整体上使得1,25cD3化合物的VDR-LBD具有更高稳定性。这一报道也使得C-25羟基在结构中的重要性有所降低。

图3 侧链与A环分别修饰维生素D类似物

图4 维生素D类似物与VDR的结合[33]
3 侧链以及A环的共修饰
Yamamoto等[34]成功合成了一系列含有或不含有C-22S烷基取代基的维生素D类似物及C-22S烷基衍生物,并进行了生物活性研究(图5)。与仅进行侧链修饰的维生素D类似物相比,该类衍生物的VDR结合亲和力相对25(OH)2D3降低了10倍。构效关系研究结果[35]表明,化合物中C-22取代基体积的增加导致VDR结合亲和力降低。具有正常侧链的化合物在对靶基因检测中显示出很强的活性,而没有C-22取代的化合物 (图5 Aa, Ba, Ca, Da)甚至具有完全的激动剂活性。相反,C-22S丁基取代的分子(图5 Ac, Bc, Cc, Dc)由于体积增加,几乎没有激活能力,而C-22S乙基取代的化合物 (图5 Ab, Bb, Cb, Db)则具有中等活性。此外,类似物Aa, Ba, Ca,和Da以浓度依赖的方式诱导VDR伴侣受体、黄醇X受体(RXR,图2)和共激活肽的富集,而C-22S取代的化合物仅引起中等效应[36]。这一系列实验结果证实了侧链的长度与体积对维生素D类化合物的VDR活性具有至关重要的影响。
与其他C-22S 1,25(OH)2D3衍生物(图5 E-H)[37]络合的VDR-LBD晶体结构初步证实了这些化合物通过将氨基酸L305旋转约305°C,触发LBP的额外腔向外延申约27°,以遮盖侧链丁基(图4C)。当配体不与受体的C末端螺旋H12相互作用时,这些化合物(配体)充当VDR拮抗剂。更深入的研究发现,由于共激活肽的存在,螺旋H12的位置始终保持在激动位置,但是多个残基从22-丁基旁由于挤压移开或旋转。这些变化会削弱与H301(螺旋H6 / 7)、H393(H11)或F418(H12)的相互作用,并使LBD的该结构区域不稳定(图4C)。研究[38]还发现,存在共激活肽的情况下,某些拮抗的22-丁基类似物具有激动性构象。这些结晶的人工蛋白复合物还可能具有一定的生理意义,例如在细胞环境中感测辅因子平衡情况,具有进一步开发的前景。
为了评估C-22上的甲基对化合物生物活性的影响,近年来,DeLuca等[39]采用Wittig-Horner反应制备了化合物E的多种新衍生物(图5)。与原化合物E相比,(20R)-25-羟基化侧链(J)的单甲基化不会改变VDR结合亲和力。但是在(20S)-25-羟基化的基础上增加了22-甲基侧链(K)使得化合物产生了更强的活性,VDR亲和力增强[40]。 22R化合物Ka的VDR结合亲和力是维生素D3的2.5倍,效力是22-epimer的250倍[41]。在“天然”侧链(20R)(Ia)中具有22S-甲基类似物的生物活性比化合物(Ib)高10倍,而在“非天然”情况下(20S),化合物Ja比化合物E的效力高4倍。当在C-22处引入两个甲基时,例如20R-化合物(Ka)和20S化合物(Kb),其VDR结合亲和力与1,25(OH)2D3相比得到增加,但是增幅不大[42]。这说明C-22上的甲基的立体构型对化合物的亲和力有显著影响,这与其在LBD中的相对位置有很大关系。
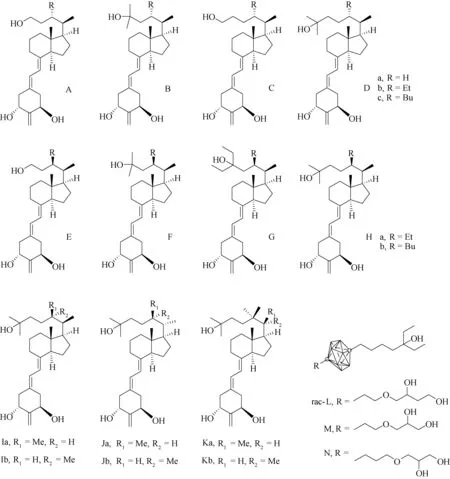
图5 维生素D类似物
4 非甾体VDR配体
通过双分子亲核取代[43]可以合成包含疏水性单元的非甾体VDR激动剂[44](图5)。利用碳硼烷的疏水性,碳硼烷笼取代了天然维生素D的CD环。尽管其结构简单灵活,但与1,25(OH)2D3相比,基于碳硼烷的VDR配体对VDR只表现出中等的结合亲和力。这些类似物是柔性的无环三元醇,缺乏A环和共轭三烯结构,它们的结构在碳硼烷碳上共享一条支链侧链,而在另一碳上,分别与L、M或N三种不同的链结合。二醇的柔韧性有利于提高与VDR结合的亲和力,但仍然比1,25(OH)2D3低100多倍。不过,这些化合物在诱导HL-60细胞分化方面具有较强活性[45-46]。
5 总结
综上所述,化学合成方法和手段的丰富大大增加了药物化学家们合成维生素D类似物的数量和种类。目前对于不含25-羟基的功能分子,例如邻-碳烷化合物的合成和活性研究工作仍在继续。 此外,现在有一些完全缺乏A环或CD环的分子,例如非甾体类维生素D类似物,仍可以与VDR相互作用,但目前报道较少。这些非甾体类维生素D类似物,有些在体外具有高活性,并且在体内具有降低血钙的作用。因此,预计未来非甾体维生素D类似物的报道将进一步增加。
对VDR配体,即维生素D类似物的生物学特征的评估,仍然主要为体外活性实验,例如VDR亲和力实验、靶基因结合测定以及不同癌细胞系中抗增殖和分化程度的测定。测定方法的多样性使得活性数据难以一致,缺乏具体的量化标准,无法直接比较不同类型的维生素D类似物。而且,如果不改变检测方法(例如分离新鲜的人外周血单核细胞中的基因表达谱),就不可能准确的推断化合物的体内活性情况[47]。这对该类化合物的进一步优化和应用产生了不利影响。
近年来,关于维生素D类似物的研究几乎仅在少数科研机构中进行,许多引人关注的VDR配体结构优化方法并未最大限度地被挖掘出来。随着近150个VDR-LBD晶体结构的解析,以及越来越多蛋白质结晶结构解析的出现,显示出科研人员对了解VDR激动剂和拮抗剂的分子相互作用有着非常积极的兴趣,有进一步深入研究的可能。
然而,令人遗憾的是,针对癌症的临床试验失败仍然极大地削弱了制药企业对进一步开发维生素D化合物的兴趣。由于天然激素1,25(OH)2D3主要预防与骨骼和免疫系统有关的疾病,因此该分子及其合成衍生物可能不是治疗癌症的理想药物。然而已有文献[48-49]报道显示人胰腺肿瘤基质中卡泊三醇活化的VDR可以显著减少胰腺炎和人肿瘤基质中炎症和纤维化的标志物表达水平。这表明维生素D化合物可能对肿瘤微环境的免疫细胞造成一定影响,而不是直接抑制肿瘤微环境下的癌细胞的增殖,这说明该类药物的抗肿瘤作用机理还需进一步发掘。实际上,迄今为止,有关VDR及其配体作用的全基因组数据大部分可从造血系统的细胞中获得[50]。这进一步强调了维生素D和VDR对骨代谢以及先天性和适应性免疫的影响,并建议这些领域应进一步展开探索以用于商业应用。

