非洲猪瘟病毒胶体金免疫层析试纸条的研制
邬旭龙 , 刘 波 , 王 印 , 张鹏飞 , 江地科 , 肖 璐
(1. 成都农业科技职业学院 , 四川 成都 611130 ; 2. 四川农业大学动物医学院 动物疫病与人类健康四川省重点实验室 , 四川 成都 611130 ; 3. 四川省畜牧科学研究院 动物遗传育种四川省重点实验室 , 四川 成都 610066)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的急性传染病[1]。ASFV属非洲猪瘟病毒科(Asfarviridae),是虫媒病毒中唯一的DNA病毒,临床表现与猪瘟极其相似[2],以急性高热为特点,伴有全身及内脏器官出血,猪群一旦感染,强毒株可引起100%死亡率[3]。临床症状从急性、亚急性和慢性不等,表现为高热、皮肤发绀、呼吸障碍和神经症状等[4-5],病症最急性型可感染任何年龄和品种的猪群,通常出现在初次感染猪场,猪群感染后3~7 d可出现死亡[6],对养猪业造成巨大经济损失,目前仍无有效的ASF疫苗进行预防,该病被世界动物卫生组织列为实时通报的动物疾病,我国将其列为一类动物疫病。
胶体金技术从20世纪70年代开始,逐渐在各不同学科领域开展研究和应用[7-9]。基本原理[10]是由于胶体金颗粒表面带有负电荷,因而可以通过静电作用吸附带有正电的物质,胶体金标记的抗原或抗体在毛细作用下在硝酸纤维素膜中移动并与相应的抗体或抗原作用反应结合,从而导致大量胶体金颗粒的聚集,进而呈现显色反应。ASFV pK205R蛋白是ASFV的主要抗原之一[11-12],可以诱导机体产生较强的免疫反应,该研究通过原核表达ASFV pK205R蛋白并制备多克隆抗体,初步建立检测ASFV的胶体金免疫层析试纸条检测方法,该方法快速、便捷,且具有较好的特异性,为非洲猪瘟病毒临床检测技术研究提供基础。
1 材料与方法
1.1 主要试剂 大肠杆菌BL21,购自天根生化科技(北京)有限公司。pMD19-T Simple Vector、pET-32a,均购自TaKaRa公司。DNA Marker DL2 000、蛋白质Marker,均购自天根生化科技(北京)有限公司;NotⅠ、BglⅡ限制性内切酶、TaqPlus DNA 聚合酶、T4 DNA 连接酶、非预染蛋白质Marker、高保真酶、Primer Star,10× PyrobestTMBuffer、dNTP Mixture(各2.5 mmol/L)、DNA Marker DL10 000,均购自TaKaRa公司;HisTrap FF 5×1 mL蛋白纯化柱,购自美国GE公司;其余试剂均为分析纯。
1.2 主要仪器 超速低温离心机,Beckman公司产品;冷冻干燥仪,Thermo公司产品;PCR仪、全自动凝胶图像分析系统,Bio-Rad公司产品;分光光度计,上海美光达仪器有限公司产品;电热恒温干燥箱,上海精宏实验设备有限公司产品。
1.3 试验方法
1.3.1 引物合成 根据GenBank登录的ASFVK205R基因序列(FR682468.1),人工合成K205R基因,设计合成引物,引物序列:5′-AGATCTATGGTTGAGCCACGCGAACAGTT-3′(下划线为BglⅡ酶切位点);5′-GCGGCCGCCGCTTACTTCTTCATCATCT CTV-3′(下划线为NotⅠ酶切位点)。PCR扩增产物条带大小约为636 bp,回收目的片段后与pMD-19T载体连接,转化到DH5α细胞,利用BglⅡ和NotⅠ进行双酶切鉴定,对鉴定正确的阳性质粒测序。
1.3.2 ASFV pK205R蛋白原核表达 双酶切的pMD-19T-K205R载体与pET-32a载体进行连接,构建表达质粒pET-32a-K205R并转化至BL21,重组菌株扩大培养后加入IPTG诱导,分别对诱导时间、温度、IPTG浓度优化,同时设立阴性对照,诱导后进行聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定。
1.3.3 重组蛋白纯化 表达重组蛋白利用His标签蛋白纯化柱纯化后经SDS-PAGE电泳鉴定,纯化的目的蛋白浓缩至8 mg/mL左右,与佐剂1∶2比例混合乳化免疫家兔2 mL,每隔7~10 d加强免疫,第3次免疫10 d后心脏采血,分离血清备用。并利用亲合层析纯化柱纯化血清中的IgG,使用半透膜4 ℃ 透析过夜,-20 ℃保存。
1.3.4 多克隆抗体制备 将纯化的目的蛋白浓缩至8 mg/mL左右,与白油佐剂1∶2比例混合乳化免疫家兔2 mL,每隔10 d加强免疫,剂量每次增加0.5 mL,第3次免疫后采用心脏采血,分离血清备用。制备阳性血清,并利用GE Healthcare Protein G SepharoseTM亲合层析纯化柱纯化血清中IgG,使用半透膜4 ℃透析过夜,-20 ℃保存。
1.3.5 金标抗体制备 分别对免疫胶体金最适pH及最适抗体量进行测定。在离心管中分别加入1 mL胶体金溶液,用0.2 mol/L的K2CO3溶液分别调节pH为3~9.5,每管加入BSA混匀,室温放置30 min后离心重悬,观察胶体金颜色变化,确定最适pH条件。同时,对胶体金标记最适抗体进行筛选,系列稀释纯化的多克隆抗体使其浓度为5~55 μg/mL,加入96孔板中,室温静置30 min,观察结果确定最适的金标抗体量。
1.3.6 试纸条组装及检测 样品垫(聚酯纤维素膜)用样品垫预处理液[0.5 mol/L PBS溶液(含0.1%Tween-20),pH 7.4]浸泡1 h,真空抽干备用;金标垫(玻璃纤维素膜)用金标垫处理液(4%蔗糖)浸泡1 h,真空抽干放入金标抗体溶液中浸泡1 h,再次真空抽干;硝酸纤维素膜用硝酸纤维素膜处理液(0.5 mol/L PBS溶液,pH 7.4)浸泡1 h,再用超纯水浸泡3次,真空抽干。将纯化的抗体和SPA分别划线于T线和C线处,室温干燥备用。依次将样品垫、金标垫、硝酸纤维素膜、吸水纸粘在PVC底板上,并依次重叠,使劲压紧,裁成合适大小的试纸条;取一制备的试纸条,在样品垫上滴加100 μL纯化的目的蛋白,10~20 min后观察效果。
1.3.7 试纸条划线浓度的优化 将纯化的抗体进行系列稀释(4~0.1 mg/mL),划线于硝酸纤维素膜的T线处,点样检测,确定最适T线抗体浓度。将SPA进行系列稀释(4~0.025 mg/mL),划线于硝酸纤维素膜的C线处,点样检测,确定最适C线SPA浓度。
1.3.8 试纸条检测性能研究 分别对制备的胶体金试纸条进行检测灵敏度和特异性测试。在确定的优化条件下制作金标试纸条,把纯化的ASFV pK205R表达蛋白稀释成不同浓度后点样,进行灵敏性检测。同时,将BL21大肠杆菌裂解液、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病病毒(PRV)、圆环病毒2型(PCV2)、生理盐水和阳性蛋白样品分别滴在试纸条上,进行特异性检测。
2 结果
2.1 基因扩增及表达载体鉴定 特异性引物进行PCR扩增后,经1%琼脂糖凝胶电泳鉴定,扩增产物条带大小约636 bp,与预期大小一致(图1A)。表达质粒双酶切后电泳鉴定,结果显示出现2条特异性条带,大小约636 bp和5 900 bp,与预期大小一致(图1B),表明成功构建表达质粒pET-32a-K205R。

图1 ASFV K205R基因扩增及重组表达载体酶切鉴定Fig.1 Amplification of ASFV K205R and identification of recombinant expression vectorM1:DL2 000 DNA相对分子质量标准; 1:K205R PCR扩增产物; M2:DL10 000 DNA相对分子质量标准; 2:重组表达质粒pET-32a-K205R; 3:pET-32a空载体质粒; 4:重组表达质粒双酶切产物M1:DNA marker DL2 000; 1:PCR amplification products of K205R; M2:DNA marker DL10 000; 2:Recombinant expression plasmid pET-32a-K205R; 3:pET-32a empty vector plasmid; 4:Double enzyme digestion products of pET-32a-K205R
2.2 重组蛋白表达及纯化 重组表达质粒转入BL21中诱导表达,同时设立空载质粒对照,进行SDS-PAGE电泳鉴定。结果显示,pK205R重组蛋白大小约44 kDa,与预期大小一致(图2A)。利用His标签纯化柱对表达蛋白纯化后电泳,重组蛋白在44 kDa处出现特异性条带(图2B),表明pK205R重组蛋白成功表达及纯化。
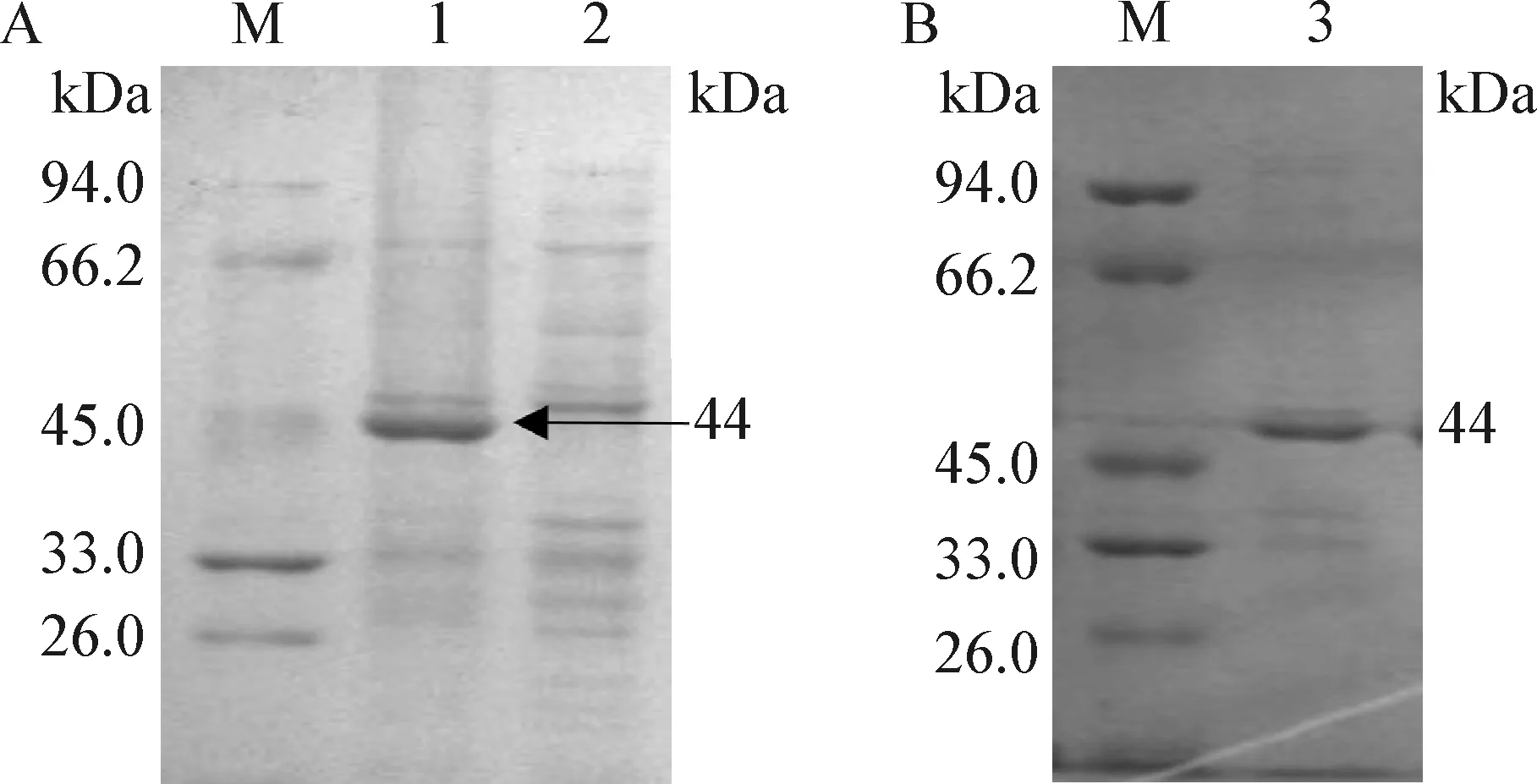
图2 重组蛋白表达及纯化Fig.2 Expression and purification of recombinant proteinM:蛋白分子量标准; 1:pET-32a-K205R重组菌诱导表达; 2:空载菌诱导表达; 3:重组蛋白的纯化M:Protein molecular weight marker; 1:The expression product of pET32a-K205R; 2:The expression product induced by emptyvector control; 3:Purified recombinant protein
2.3 金标抗体的制备 加入适量K2CO3溶液调节胶体金pH为3~9.5,结果显示,当pH为7.5~9时,胶体金稳定,颜色不变,重复试验后选择标记蛋白的最适pH为7.5。加入不同浓度的纯化抗体,结果显示(表1),使胶体金稳定而颜色保持不变的最小抗体浓度为35~40 μg/mL,为保证试纸条检测质量,选择抗体标记量为40 μg/mL。

表1 金标抗体的制备Table 1 Preparation of gold labeled antibody
2.4 试纸条的检测 将试纸条预处理后进行组装,在样品垫上滴加100 μL纯化的表达重组蛋白,10~20 min后观察结果。结果显示,控制线和检测线清晰可见(中插彩版图3),表示免疫胶体金标记成功,试纸条制作成功。

图3 试纸条检测Fig.3 The test of the strip
2.5 胶体金试纸条的优化 纯化的抗体系列稀释后分别划线于T线处,点样检测,结果显示,所有浓度均能显色(中插彩版图4),由于抗体浓度减小可能会导致显色不清晰,将T线抗体浓度确定为1.5 mg/mL。

图4 T线和C线标记浓度的优化Fig.4 Optimization of the antibody concentration in T-line and C-line1~8: T线标记抗体浓度分别为4、2、1.5、1、0.75、0.5、0.25 mg/mL和0.1 mg/mL; 9~19: C线标记SPA浓度分别为4、2、1.5、1、0.75、0.5、0.25、0.1、0.075、0.05 mg/mL和0.025 mg/mL1-8: Concentrations of T-line labeled antibody were 4、2、1.5、1、0.75、0.5、0.25 mg/mL and 0.1 mg/mL, respectively; 9-19: Concentrations of SPA labeled with C-line were 4、2、1.5、1、0.75、0.5、0.25、0.1、0.075、0.05 mg/mL and 0.025 mg/mL, respectively
SPA系列稀释后分别划线于C线处,点样检测,结果显示,当SPA浓度不小于2 mg/mL时,显色最为明显,可确定C线标记SPA最适浓度为2 mg/mL。
2.6 灵敏性检测 将制备的试纸条进行灵敏性检测,纯化的重组蛋白稀释为50~5 ng/mL,结果显示,当蛋白浓度为30 ng/mL时,检测结果为阳性;当浓度低于30 ng/mL时,结果为阴性(表2)。表明该方法对重组蛋白的最小检测量约为30 ng/mL。

表2 试纸条灵敏性试验Table 2 The sensitivity test of strip
2.7 特异性检测 将制备的胶体金试纸条进行特异性检测,分别将大肠杆菌、CSFV、PRRSV、PRV、PCV2、阴性对照和阳性蛋白样品分别滴在试纸条上,结果显示,除阳性样品外,其余结果均为阴性(表3),表明制备的胶体金试纸条具有较好的特异性。

表3 试纸条特异性检测Table 3 The specificity test of strip
3 讨论
ASF目前无有效疫苗进行防控,针对该病预防主要通过生物安全措施和检疫,因此建立一种ASFV快速简便的检测方法尤为重要。K205R基因作为ASFV保守特异的基因,病毒在感染动物初期最先得到大量复制[13],使得K205R基因逐渐受到国内外越来越多的关注,并且pK205R蛋白能够在病毒侵入机体的早期表达这一特性,为建立快速及时检测ASFV提供了技术储备,为ASFV进一步基础研究提供有效的参考依据。
大肠杆菌作为原核表达宿主细胞,是重组蛋白表达应用较为广泛的表达系统,具有廉价、易于操作的优点,而且目前对大肠杆菌的遗传情况比较了解,使其成为外源基因表达的首先体系。本试验将构建成功含ASFVK205R基因的重组质粒导入BL21大肠杆菌,通过条件优化和诱导获得大量表达的重组蛋白,并通过纯化柱纯化蛋白,制备兔抗多克隆抗体,为初步研制ASFV胶体金试纸条检测方法提供了保障。
胶体金免疫层析技术因具有方便、快捷等特点,已在多个领域有广泛的应用,随着胶体金技术不断的创新和改进,使该检测方法日益成为科学研究和临床诊断的有力工具。本试验用金颗粒标记纯化的兔抗pK205R抗体作为金标垫,同时纯化的抗体作为检测T线捕获抗原,用SPA作为质控C线,并对工作条件进行优化。经检测所研制的胶体金试纸条能与模拟阳性样品反应,操作简便、检测快速,反应条带清晰可见,且具有较高的检测特异性。本试验为进一步优化和研究该ASFV胶体金试纸条检测方法,获得更加灵敏、稳定的检测结果,从而开展临床检测的推广和应用提供了科学依据。

