伴fms样酪氨酸激酶3基因内部串联重复突变的急性早幼粒细胞白血病患者初次诱导临床特点研究
唐宇宏 王育丽 司 阳 路 伟 张彦芳
fms样酪氨酸激酶3(fms-like tyrosine kinase 3,FLT3)基因突变是急性髓系白血病(acute myeloid leukemia,AML)中常见的基因突变之一,其发生率约为1/3,包括内部串联重复(internal tandem duplication,ITD)突变(发生率约23%)和酪氨酸激酶结构域(tyrosine kinase domain,TKD)突变(发生率约8.12%)[1]。国内外大多数研究均发现,FLT3-ITD突变是AML预后不良的影响因素之一,主要表现为持续缓解时间短、无事件进展率高和总生存率低[2-3]。在AML各亚型中,急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者的FLT3基因突变发生率尤其高,其中FLT3-ITD突变与M3v亚型、S型早幼粒细胞白血病-维甲酸受体a(PML-RARa)融合基因相关[4-6]。Kelly等[7]将携有FLT3-ITD突变的逆转录病毒和空载体分别转入带有PML-RARa融合基因小鼠的骨髓,再将此骨髓移植给受体鼠;结果显示,接受空载体骨髓的受体鼠经过6个月才发病,而植入FLT3-ITD突变骨髓的受体鼠发病时间明显缩短。进一步研究[8]发现,单独的FLT3-ITD突变仅引起骨髓增殖性疾病样表现,不足以导致白血病的发生。由此推断,FLT3-ITD突变同样在APL的发生、发展和预后等方面起至关重要的作用。本研究比较FLT3-ITD突变与否的两类PML-RARa融合基因阳性APL患者初次诱导缓解过程中的相关指标,旨在探讨FLT3-ITD突变在APL发生和发展中的潜在机制,为该类APL更精准的个体化治疗提供思路。
1 对象与方法
1.1 研究对象 所有病例均为2016年1月—2018年12月上海交通大学医学院附属第九人民医院血液科收治的初发APL患者,其中男13例、女5例,年龄为(44.6±17.5)岁,均为经典型t(15;17)(q22;q21)。根据临床表现、血常规检查、骨髓细胞形态学、白血病免疫分型、融合基因测定和染色体核型分析等确诊为经典型APL。均采用静脉注射三氧化二砷(arsenic trioxide,ATO)0.16 mg/(kg·d)联合全反式维甲酸(all-trans retinoic acid,ATRA)20 mg/(m2·d)诱导方案,直至完全缓解(complete response, CR)。外周血白细胞(white blood cell,WBC)计数>10×109/L者加用去甲氧柔红霉素8~12 mg/(m2·d),共3 d。治疗过程中动态监测所有患者外周血WBC计数。
1.2 研究方法 回顾性分析所有患者的临床资料,根据FLT3-ITD的突变情况分为基因突变组(8例)和非基因突变组(10例)。APL的诊断标准参照《血液病诊断及疗效标准(第4版)》;诱导缓解方案、维甲酸综合征(retinoic acid syndrome,RAS)预防和治疗参照《中国急性早幼粒细胞白血病诊疗指南(2018版)》;弥散性血管内凝血(disseminated intravascular coagulation,DIC)诊断标准参照《弥散性血管内凝血诊断中国专家共识(2017版)》。RAS指在诱导治疗过程中出现WBC计数升高,且伴随下列症状和检查中的2项以上:不明原因发热、体重增加、呼吸困难、辅助检查发现浆膜腔积液等。
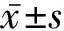
2 结 果
2.1 治疗过程中外周血WBC计数变化 治疗过程中,两组患者WBC计数均进行性上升,基因突变组诱导前WBC计数显著高于非基因突变组(P<0.05),但诱导中两组间WBC计数峰值和达峰时间的差异均无统计学意义(P值均>0.05)。见表1。
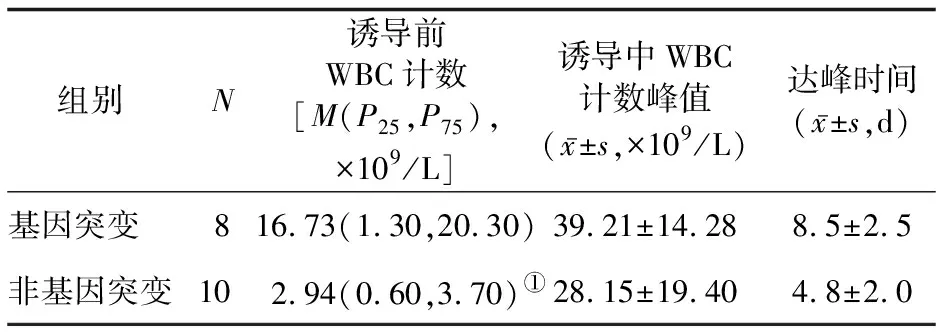
表1 两组诱导前和诱导中相关指标比较
基因突变组中2例APL初发高WBC计数患者(WBC计数分别为65×109/L和23×109/L)在诱导期间死亡。
2.2 DIC发生情况 在诱导过程中,基因突变组8例患者中4例发生DIC,其中2例死亡,均为严重DIC诱发的严重颅内出血;非基因突变组10例患者中2例发生DIC。结果提示,FLT3-ITD突变患者凝血功能障碍更严重。
2.3 RAS发生情况 基因突变组完成诱导的6例患者中4例发生RAS;非基因突变组10例患者中3例发生RAS,给予地塞米松后均有效缓解。结果提示,FLT3-ITD突变患者更易发生RAS。
2.4 诱导缓解时间 18例患者中2例未达缓解即死亡,其余16例患者经初次诱导均达到CR。其中基因突变组达到CR时间为(30.0±1.63) d,非基因突变组为(27.6±6.7) d,两组间差异无统计学意义(P>0.05)。
2.5 诱导后FLT3-ITD突变检测 基因突变组获得CR的6例患者中3例进行了FLT3-ITD突变复测,结果均提示为阴性。
3 讨 论
FLT3-ITD突变可使FLT3受体发生非配体依赖性的二聚化和磷酸化,从而激活下游一系列信号转导途径,如Janus激酶2(Janus kinase 2,JAK2)信号转导和转录激活蛋白5(signal transducer and activator of transcription,STAT5)途径,以及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径等促进细胞的增殖活化,表现出初发AML高WBC计数的特点[9]。同样地,本研究结果也表明,基因突变组患者诱导前WBC计数显著高于非基因突变组,与其他研究[10]结果一致。进一步分析结果却显示,诱导过程中基因突变组患者WBC计数峰值和达峰时间与非基因突变组的差异无统计学意义。APL初发时高WBC计数往往与RAS的发生密切相关。竺晓凡等[11]报道,ATRA诱导治疗时WBC计数峰值≥20×109/L的患者RAS发生率为23.8%,而WBC计数峰值<20×109/L的患者RAS发生率仅为2.6%,两组间差异有统计学意义(P<0.01)。杨俊杰等[12]报道,ATRA诱导治疗时WBC计数峰值≥20×109/L的患者RAS发生率为34.3%,峰值<20×109/L的患者RAS发生率为6.4%,差异有统计学意义(P<0.01),与本研究的结果亦相似。RAS是APL诱导缓解过程中可能出现的最严重并发症,其发病机制尚不清楚。一般认为,APL细胞上的细胞黏附分子、整合素等可与内皮细胞-受体细胞间黏附分子相互作用。诱导过程中ATRA可通过上调编码整合素的基因促进细胞表面整合素的表达,后者则介导白细胞黏附至毛细血管内皮细胞和细胞外基质,促进内皮屏障破坏而导致渗漏发生。受诱导的 APL细胞大量分泌IL-1β、IL-6、IL-8、TNF-α等血管活性细胞因子,如IL-1β可诱导内皮细胞表达细胞间黏附分子-1(ICAM-1)和血管-细胞黏附分子-1(VCAM-1),这两者又有助于APL细胞结合到内皮细胞,加剧损伤,从而形成恶性循环[13]。研究[14]结果表明,FLT3-ITD突变可促进AML细胞分泌E选择素,且血清中TNF-α的表达水平也较高,可加速细胞内皮的损伤。还有研究[15]发现,FLT3-ITD突变的初发AML难治或复发的原因为TNF-α、 IL-6和IL-1β等细胞因子高表达。这些研究提示了FLT3-ITD突变可能会增加治疗过程中RAS的发生风险或加重其程度。
综上所述,FLT3-ITD突变极可能是造成APL诱导缓解过程中诸多不良事件发生的危险因素之一。虽然ATRA联合ATO可极有效诱导经典型APL缓解[16],但仍有一部分患者,由于表达如STAT5b-RARα融合基因,或伴随如NPM1等基因的突变,而影响疗效和预后[17]。有研究[18]发现,ATO联合FLT3酪氨酸激酶抑制剂(FLT3-TKI)可通过减少细胞增殖,减弱细胞集落形成能力,促进细胞凋亡等表现出协同效应,从而有效治疗FLT3-ITD突变的AML,其机制可能是由于ATO下调FLT3 RNA及其上游转录调节因子(HOXA9,MEIS1)的表达,诱导FLT3自身的下游磷酸化靶标(包括STAT5、丝氨酸苏氨酸蛋白激酶和细胞外调节蛋白激酶)的自磷酸化和磷酸化失活来完成。由于一些原因,本研究未对所有获得CR患者进行FLT3-ITD突变的复测,但已检测的3例CR患者FLT3-ITD突变均转阴。因此,ATO联合ATRA作为经典方案,在诱导APL达到CR的同时,具有改善FLT3-ITD突变的可能。

