芦荟多糖对大鼠骨关节炎治疗作用的体内和体外研究
朱必康,舒克钢,徐伟华,瞿洋洋,庞聪,罗世兴△
骨性关节炎(osteoarthritis,OA)是一种慢性的关节退行性疾病,常与年龄或创伤相关[1]。OA常以关节的疼痛、僵硬和活动受限为主要临床表现,其病理特征是关节软骨退化、软骨下骨改变和周围软组织炎症等[2-4]。芦荟多糖(aloe polysaccharide,APS)是从芦荟中提纯的,由甘露糖、葡萄糖和半乳糖等单糖或其衍生物组成的一类具有生物活性的大分子化合物[5-6]。许多研究报道了APS具有促进细胞增殖[7]、护肝[8]、皮肤修复[5-6,9]、抗菌、抗炎[10-12]、免疫调节[13-14]和抗氧化[6,15-17]等作用。另有研究显示APS抗炎作用显著,对皮肤创面的修复和细胞外基质重构所需的糖胺聚糖(GAG)和Ⅱ型胶原(COL2A1)等的分泌有促进作用[6]。因此,APS或可作为关节软骨保护剂用于OA的治疗。本研究旨在通过体外和体内实验,探究APS对OA的抗炎作用和软骨稳态的保护作用。
1 材料与方法
1.1 实验动物 清洁级的3日龄雄性SD乳鼠5只,8周龄180~200 g雄性SD大鼠18只,均购自广西医科大学实验动物中心。
1.2 主要仪器与试剂 超净工作台(上海博迅实业有限公司);二氧化碳恒温培养箱、全波长酶标仪(赛默飞世尔科技有限公司);倒置相差显微镜(Olympus公司);LightCycler®96实时荧光定量PCR(qPCR)仪(Roche公司)。APS(纯度≥99%,上海源叶生物科技有限公司);生理盐水、磷酸盐缓冲液(PBS)购自迈新公司;胎牛血清、0.25%胰蛋白酶、1%(V/V)青-链霉素、10 cm培养皿、12孔和24孔培养板(Corning公司,美国);苏木精-伊红(HE)染色试剂盒、番红O染色试剂盒(北京索莱宝有限公司);DMEM培养基(Gibeo公司);CCK-8(大连美仑生物技术有限公司);Ⅱ型胶原酶(美国Sigma公司);总RNA提取试剂盒(Magen公司)。白细胞介素(IL)-1β(Bioss公司);Hoechst 33258(Molecular Probes,美国);逆转录试剂盒[宝日医生物技术(北京)有限公司(Takara中国)];基质金属蛋白酶(MMP)-13、肿瘤坏死因子(TNF)-α、IL-6、蛋白聚糖(ACAN)、COL2A1、GAPDH引物(武汉金开瑞生物工程有限公司);TNF-α酶联免疫吸附测定(ELISA)试剂盒、IL-6 ELISA试剂盒(江苏酶免实业有限公司);MMP-13一抗(Proteintech公司),通用型SP-9000试剂盒(小鼠/兔链霉卵白素-生物素法检测系统,北京中杉金桥生物有限公司),DAPI染液(ThermoFisher),FITC荧光二抗(武汉Boster生物工程有限公司);1,9-二甲基亚甲蓝(DMMB,北京百灵威科技有限公司)。
1.3 方法
1.3.1 关节软骨细胞的提取与培养 取3日龄SD乳鼠5只,2%戊巴比妥钠过量麻醉处死,于75%乙醇中浸泡消毒10 min,在超净台上使用无菌器械取下两侧膝关节,用眼科剪分离出关节软骨,用含1%青-链霉素的生理盐水洗涤2~3次,充分剪碎并转移至15 mL离心管中,0.25%胰蛋白酶作用30 min,充分去除软骨周围组织,1 000 r/min离心1 min并弃上清液,随后在生理盐水中清洗3次,加入2 g/L的无血清的Ⅱ型胶原酶在37℃下二次消化3~4 h,1 000 r/min离心5 min,弃上清取沉淀收集软骨细胞并重悬,接种于含有1%青-链霉素和10%(V/V)胎牛血清的DMEM培养基的培养皿中,随后置于37℃、5%CO2培养箱中培养。在镜下观察到细胞完全贴壁后,换液去除悬浮细胞,之后每2 d换液1次,细胞融合达到85%~90%后,用1 mL的0.25%胰蛋白酶消化2~3 min,使用5 mL含10%胎牛血清和1%青-链霉素的DMEM培养基终止消化,按照1传3的比例传代。取第2代细胞用于后续实验。
1.3.2 细胞增殖能力测定 使用CCK-8法测量APS对关节软骨细胞增殖的影响,将第2代关节软骨细胞消化、计数后重悬稀释为1×104个/mL,加入200μL/孔的细胞悬液(细胞密度2 000个/孔)接种在96孔板上,12 h后更换含不同剂量(0、5、10、20、40和80 g/L)APS的DMEM完全培养基,继续培养24 h后每孔加入10μL的CCK-8增强型溶液,轻轻摇晃敲击培养板促进混匀后放入培养箱内继续孵育2 h,避光,酶标仪检测各孔450 nm处的光密度(OD)值。
1.3.3 实验分组 实验分为空白组,模型组和低、中、高剂量组。空白组不加任何试剂,模型组和各剂量组加入10μg/L IL-1β,各剂量组根据细胞毒性测定结果分别加入低、中、高剂量的APS。将关节软骨细胞分别接种到有爬片/无爬片的6孔板和24孔板中,待24 h细胞贴壁后换成各组对应的培养基,每组3个复孔,干预24 h后进行相应检测。
1.3.4 软骨细胞DNA含量和GAG分泌量的检测 将细胞按2×105个/孔的密度接种在6孔板上,培养12 h后细胞贴壁,分别给予5组细胞相应的处理24 h后,各组细胞用PBS冲洗、1 000 r/min离心1 min后收集于1.5 mL EP管中。加入1 mL PBS和2.5μL蛋白酶K溶液,56℃水浴8 h。将上述溶液离心后取上清900μL,并加入1μL Hoechst 33258避光孵育20 min,各组按200μL/孔加入96孔板中,使用荧光酶标仪检测激发波长为460 nm处OD值。最后基于小牛胸腺的DNA标准曲线来计算样本中DNA含量。取上述剩余溶液100μL样品,并加入900μL现配的DMMB溶液,充分混合均匀后,按200μL/孔转移至96孔板中,在荧光酶标仪上检测525 nm处的OD值,基于硫酸软骨素的标准曲线得出样本组中GAG分泌量。
1.3.5 qPCR检测OA相关基因的表达水平 使用总RNA提取试剂盒提取各组样本的总RNA,并检测OD260/OD280比值。使用逆转录试剂盒将各组RNA样品逆转录为cDNA,使用SYBE Green荧光染料法,在qPCR仪上进行反应:95℃预变性10 min;95℃变性10 s,60℃退火60 s,72℃延伸5 min,共40个循环。每组样品重复3次,并以GAPDH作为内参,2-ΔΔCt法得出各目的基因相对表达量。引物序列见表1。

Tab.1 Primer sequences of OA related genes表1 OA相关基因引物序列
1.3.6 ELISA法检测IL-6和TNF-α水平 收集各组细胞的上清液,ELISA法检测其中的炎性因子IL-6、TNF-α水平,具体操作按各试剂盒说明书进行。
1.3.7 HE染色和番红O染色 将各组细胞爬片PBS轻洗2~3次,4%多聚甲醛固定30 min,PBS洗涤3次,3 min/次;分别按HE染色试剂盒和番红O染色试剂盒说明书染色后封片,于倒置显微镜下(×100)观察拍照。
1.3.8 细胞免疫荧光染色 将空白组、模型组和20 g/L的APS实验组细胞爬片用PBS轻洗2~3次,3 min/次,4%多聚甲醛固定30 min,PBS洗涤3次,3 min/次;按免疫荧光染色说明书染色封片,于倒置荧光显微镜下(×100)观察存图,并根据Image J软件进行细胞MMP-13表达情况的定量分析。
1.3.9 动物实验 18只雄性SD大鼠采用完全随机分组法分为3组,每组6只,分别为假手术组、OA组和实验组。OA组和实验组行内侧半月板失稳(DMM)手术,用2.5%异氟醚麻醉大鼠,切断内侧半月板胫骨副韧带诱导OA模型[18]。假手术组只暴露内侧半月板胫骨副韧带,不切除。DMM术后第1天,实验组以25 mg/kg的剂量向关节腔内注射APS,每周注射1次,共8周,OA组和假手术组分别注射等量生理盐水。最后一次给药后处死所有大鼠,取膝关节标本,脱钙完成后脱水、包埋和切片。按试剂盒说明书的操作流程进行HE染色和番红O固绿染色,使用国际骨关节炎研究学会(OARSI)的骨关节炎评分标准对番红O固绿染色结果进行评分,评估关节软骨损伤程度。
1.4 统计学方法 采用Graph pad prism 6.0数据统计分析软件,计量资料以±s表示,多组数据比较采用单因素方差分析,组间多重比较采用Tukey's法,以P<0.05为差异有统计学意义。
2 结果
2.1 APS对IL-1β诱导的炎性软骨细胞增殖的影响 CCK-8结果显示,APS的剂量大于40 g/L时对SD大鼠关节软骨细胞有明显的毒性(F=24.310,P<0.05),见图1。因而后续实验选择5、10和20 g/L的APS作为低、中、高剂量组。
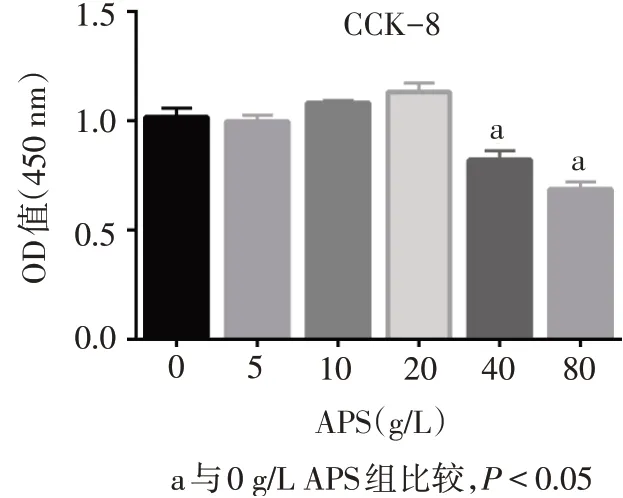
Fig.1 The effects of ASP on normal chondrocytes of SD rats detected by CCK-8图1 CCK-8检测APS对SD大鼠正常软骨细胞活性的影响
2.2 APS对软骨细胞DNA含量和GAG分泌的影响 模型组DNA含量较空白组降低,低、中、高剂量组均较模型组升高(P<0.05)。模型组GAG分泌量较空白组降低,高剂量组GAG分泌量高于模型组(P<0.05),见图2。
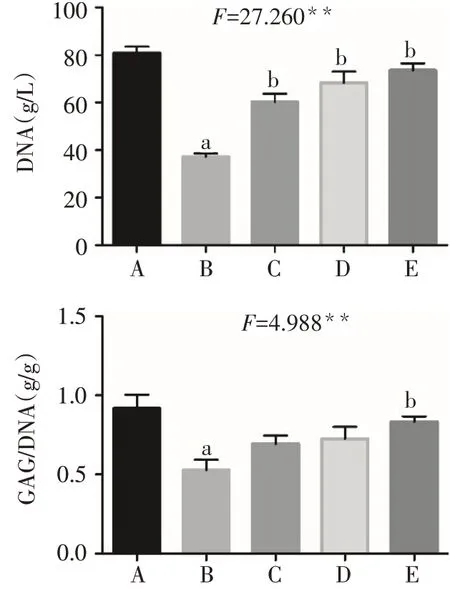
Fig.2 Comparison of DNA content and GAG secretion of chondrocytes between the five groups图2 各组软骨细胞DNA含量和GAG分泌量比较
2.3 qPCR检测APS对炎性软骨细胞中OA相关基因表达的影响 模型组与空白组相比,软骨特异性基因(ACAN和COL2A1)、炎症基因(TNF-α和IL-6)和MMP基因(MMP-3和MMP-13)的相对表达量差异均有统计学意义,表明体外炎症模型造模成功。高剂量组的ACAN和COL2A1的相对表达量均高于模型组,而TNF-α、IL-6、MMP-3和MMP-13的相对表达量低于模型组,差异有统计学意义(P<0.05),见表2。
Tab.2 Comparison of the expression levels of OA related genes in chondrocytes between the five groups表2 各组软骨细胞中OA相关基因的表达水平比较(n=3,±s)
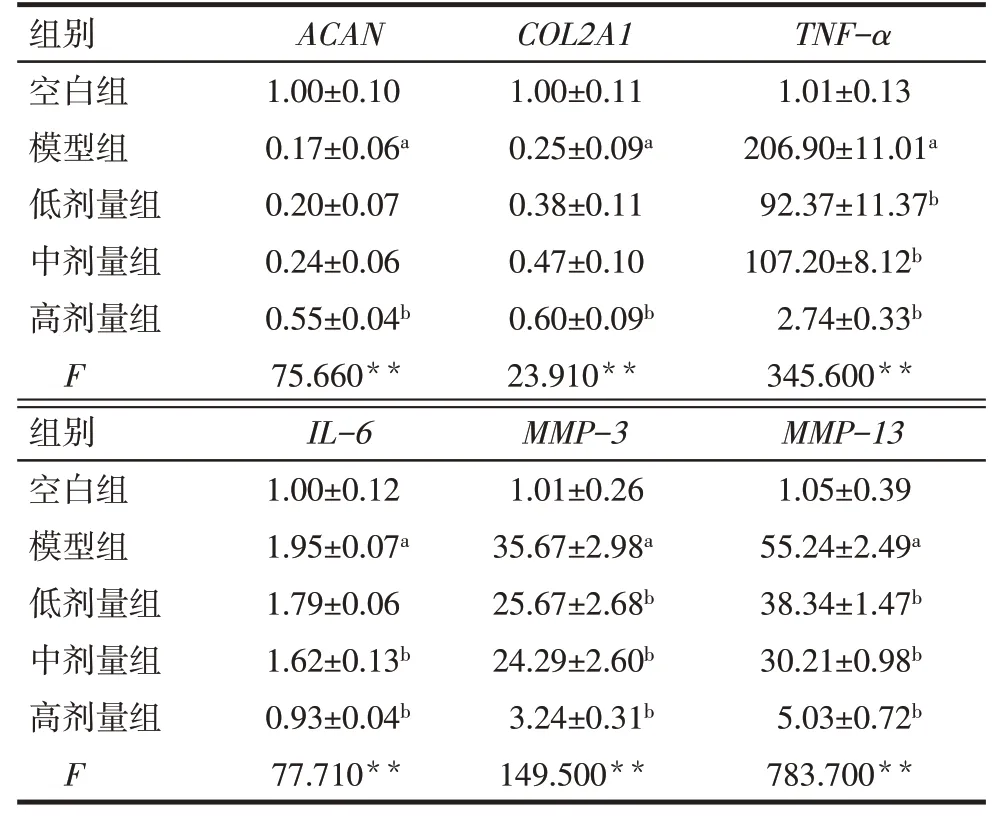
Tab.2 Comparison of the expression levels of OA related genes in chondrocytes between the five groups表2 各组软骨细胞中OA相关基因的表达水平比较(n=3,±s)
**P<0.01;a与空白组比较,b与模型组比较,P<0.05
?
2.4 ELISA检测APS对软骨细胞分泌炎性因子的影响 模型组TNF-α和IL-6的分泌量高于空白组,低、中、高剂量组低于模型组(P<0.05),见图3。

Fig.3 Levels of inflammatory cytokines secreted by chondrocytes in each group detected by ELISA图3 ELISA检测各组软骨细胞分泌炎性因子的水平
2.5 细胞染色观察APS对软骨细胞的影响 HE染色结果显示,各剂量组与空白组中软骨细胞呈现舒展状态,细胞形态良好;而模型组中部分软骨细胞已凋亡裂解,数量较少,且可见因炎症损伤造成的软骨细胞形态不规则,出现扁平瘦弱的触角表现。番红O染色结果显示,空白组中呈现强着色,经IL-1β处理的模型组的软骨细胞分泌软骨基质减少,导致着色弱;而各剂量APS干预组均显示出较强的阳性染色,且高剂量组阳性程度较为接近空白组,见图4。
2.6 细胞免疫荧光染色 与空白组(0.33±0.08)比较,模型组软骨细胞MMP-13蛋白表达(18.85±2.27)增多,高剂量组(10.65±1.88)较模型组明显降低(F=89.300,P<0.01),见图5。
2.7 膝关节组织HE染色 与假手术组相比,OA组软骨层显示出典型的骨关节炎形态变化,呈现出裂隙和纤维样磨损以及软骨基质的损失,软骨细胞形态呈现成纤维样和细胞排列不规整。与OA组相比,实验组软骨细胞形态和软骨基质损失改善,见图6。
2.8 各组膝关节组织番红O固绿染色以及软骨损伤评分的比较 OA组软骨层中的GAG呈现弱染(红色),软骨基质降解严重,而在APS治疗后呈现出较强的阳性染色,见图6。OARSI评分结果显示,假手术组(1.33±0.58)与实验组(3.67±1.53)均低于OA组(9.33±1.53),差 异有 统 计学 意 义(F=30.470,P<0.05)。
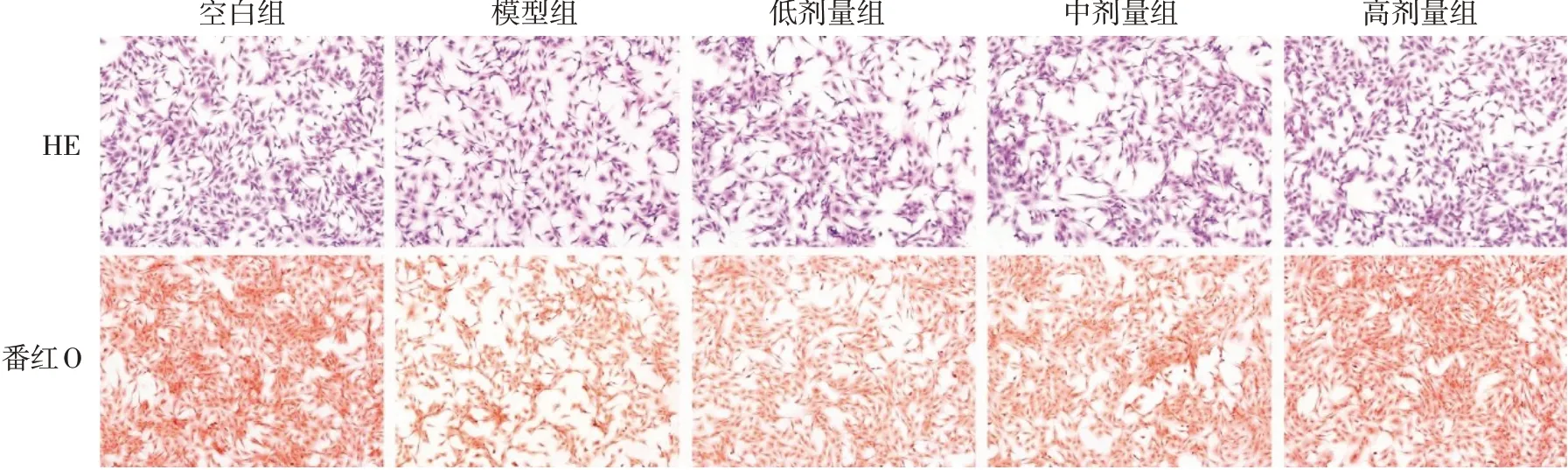
Fig.4 Chondrocytes in each group observed by cell staining(×100)图4 细胞染色光镜观察各组软骨细胞(×100)

Fig.5 Immunofluorescence analysis of APS regulating MMP-13 expression in chondrocytes(amplification factor,×100)图5 免疫荧光分析APS对软骨细胞MMP-13表达的调控(免疫荧光,×100)
3 讨论
传统的OA治疗方法包括改变生活方式、口服或注射药物、物理疗法和外科手术。临床上药物治疗常用关节腔内注射类固醇、透明质酸,同时口服非甾体抗炎药和对乙酰氨基酚通常也是OA的一线疗法[4,19]。但是,上述药物的作用旨在润滑关节腔、缓解疼痛和抗炎,长期治疗对软骨退行性病变效果并不明显。软骨基质的合成与降解的平衡是维持关节软骨稳态的关键[2]。理想的药物治疗应是能够抑制软骨基质降解、促进软骨细胞外基质的分泌和保护软骨细胞免受炎症损伤,即通过减少炎症损伤和增加软骨修复从而逆转OA的进程[19]。因此,研发具有保护和激活软骨细胞的抗炎特性的OA治疗药物具有重要的临床意义。本研究是基于从天然生物芦荟中提取的、具有生物活性的APS,通过体内外实验证明其对SD大鼠骨关节炎有积极的治疗作用。
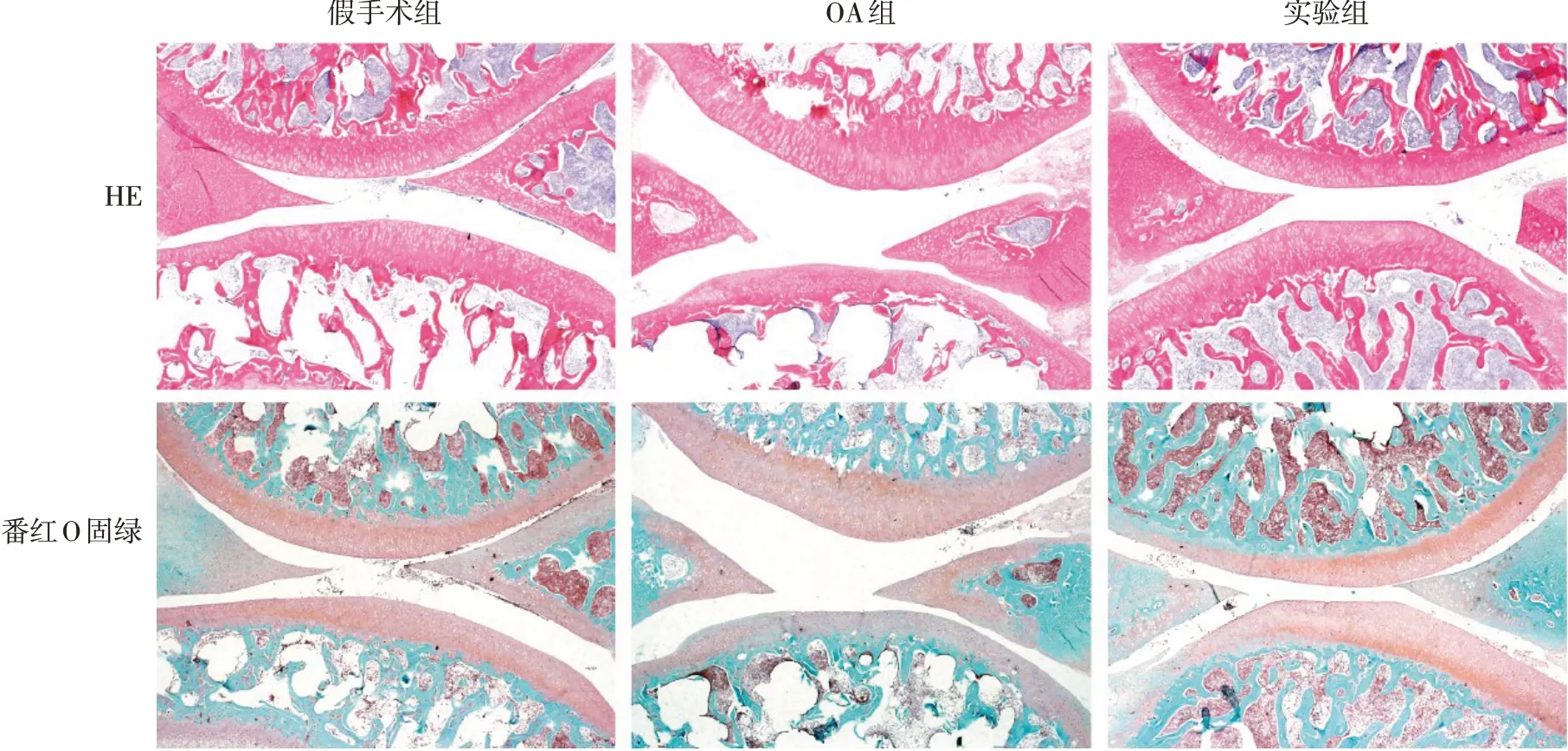
Fig.6 HE staining and Saffron O fast green staining and OARSI score of knee tissues(×40)图6 膝关节组织染色及其OARSI评分(×40)
本研究通过CCK-8法筛选出有利于细胞增殖的低、中和高APS剂量后,建立体外IL-1β诱导软骨细胞炎症模型,通过检测GAG分泌量、炎性因子和基质降解酶的表达水平来探索APS潜在的抗炎和软骨保护作用。DNA含量检测结果说明APS具有一定的抵抗凋亡和促进软骨细胞增殖的作用,综合GAG分泌量检测结果分析可知20 g/L APS实验组的软骨细胞增殖和软骨保护效果最佳。有研究报道TNF-α和IL-6等细胞炎性因子可通过促进炎症反应来参与OA的进展,从qPCR结果可知,APS对IL-1β诱导的体外OA软骨细胞具有促进软骨细胞外基质的分泌和对抗炎症的作用;且ELISA实验结果也充分展示高剂量APS实验组显著下调TNF-α和IL-6基因的表达;通过HE染色观察各组细胞形态可知APS能对抗IL-1β诱导的软骨细胞的炎性损伤,维持软骨细胞的正常形态;番红O染色结果表明APS干预处理后会促进OA的软骨细胞分泌软骨基质GAG;免疫荧光结果也显示高剂量APS实验组显著降低了MMP-13的表达水平[20-21]。上述研究均证明APS可通过抑制促炎因子的产生而减轻炎症反应,而核因子(NF)-κB通路在IL-1β诱导的炎症反应中起重要作用。也有研究表明,芦荟素可剂量依赖性地抑制NF-κB的激活,减轻骨溶解,是一种有效的破骨形成和骨吸收抑制剂[22-23]。研究显示,蛋白激酶C(PKC)抑制剂能够通过抑制破骨形成和炎症反应来治疗早期骨关节炎[24]。因此,APS作为PKCδ抑制剂,可通过NF-κB信号通路发挥抗炎的同时抑制破骨作用,有效调节早期骨关节炎软骨稳态,但相关作用机制有待后续研究。在成熟的DMM骨关节炎的动物模型中,染色结果显示APS可维持DMM术后SD大鼠的膝关节软骨细胞表型和调节软骨基质稳态,表明APS治疗SD大鼠骨关节炎有效。
综上所述,APS对SD大鼠骨关节炎有治疗作用,其机制可能是通过抑制促炎因子和基质金属蛋白酶的表达,同时促进软骨特异性基因的表达和细胞外基质的分泌来维持软骨基质稳态。因此,APS可作为一个治疗OA的潜在候选药物。若要作为临床药物,还需进一步探究药物具体作用机制并展开相关临床研究。

