牛Bcl-2基因生物信息学功能预测分析
丁嘉怡,郭慧玲,罗一鸣,康文林,李 康,李谷月
(江西农业大学动物科学技术学院,南昌 330045)
Bcl-2蛋白是到现今为止研究最为深入的抗凋亡蛋白之一,可以与促凋亡蛋白结合,抑制促凋亡蛋白的寡聚及之后的MOMP(mitochondrial outer membrane permeabilization)发生,进而阻断线粒体途径的凋亡[1]。近些年的研究表明,通过线粒体途径介导的细胞凋亡主要由Bcl-2蛋白家族成员之间复杂的相互作用进行调控[2]。除此之外,Bcl-2可能参与了Bax诱导凋亡的下调途径且与细胞色素C的释放无关[3-4],Bax蛋白与Bcl-2蛋白以不同比例形成异二聚体可能决定了细胞凋亡的敏感性[5],Bcl-2/Bax比值增大,会激发线粒体膜电位下降或丢失,从而促进细胞凋亡的发生[6]。
有研究发现Bcl-2基因不仅能调控凋亡,还可通过结合细胞自噬的关键调控因子Beclin1对细胞自噬起到调控作用[7]。刘会娟等[8]指出,Bcl-2蛋白影响Ca2+在细胞内的分布,Ca2+能够激活核酸内切酶,而Beclin1及Ca2+信号通路参与自噬调节[9-10],Beclin1的表达明显上调和胞内Ca2+浓度升高会导致自噬增强[11]。此外也有报道,Bcl-2家族蛋白的抑制可引起细胞过多死亡,细胞死亡依赖于自噬机制,这可能是平衡自噬活动的重要机制之一[12-13]。这说明Bcl-2在细胞凋亡与自噬过程中发挥交叉性作用。
对Bcl-2蛋白的抑制表达以及影响细胞死亡的作用研究是最近几年的研究热点。在哺乳动物中,一些Caspase蛋白酶形成了蛋白水解级联反应,Bcl-2蛋白通过阻止导致Caspase蛋白酶激活的步骤阻止细胞死亡,排除了Bcl-2蛋白和Bcl-XL(B-Cell Leukemia/Lymphoma 2 XL)通过在Caspase蛋白酶的下游起作用来防止细胞死亡的可能性[14-15],其可能通过组织结构损伤途径将细胞凋亡信号下传。
本试验通过应用生物信息分析预测及算法配合,预测牛的Bcl-2基因及其编码蛋白的性质、结构和功能,现报道如下。
1 材料与方法
1.1 基因序列
牛源Bcl-2基因序列(编号NC_037351.1)及编码蛋白的氨基酸序列(编号NP_001159958.1),自NCBI网站上获得。
1.2 测定项目与方法
采用BioEdit软件进行牛Bcl-2基因序列预测分析,分析目标基因序列组成。采用NCBI在线网站Bcl-2基因进行核酸基本分析,对Bcl-2基因所在基因组数据进行预测。采用NCBI上的BLAST工具包进行核苷酸的初步同源性分析。
采用NCBI在线程序预测牛Bcl-2基因所编码的氨基酸序列,采用BioEdit软件分析目标氨基酸组成。使用NCBI-BLAST进行牛Bcl-2蛋白同源性比对。运用在线工具ExPASy-ProtParam tool预测氨基酸与水结合的性质。将TMHMM Server v.2.0与SPLIT 4.0工具联合使用进行蛋白质跨膜区预测。根据SignalP 4.1 Server对蛋白质的信号肽区域进行预测。运用在线工具PSORTⅡ进行Bcl-2蛋白分子亚细胞位点的预测。利用NCBI的CD-Search对Bcl-2蛋白的结构域预测分析。利用在线工具PSIpred-MEMSAT 3预测Bcl-2蛋白二级结构。运用SWISS-MODEL工具依据同源建模法构建出Bcl-2蛋白三级结构模型。
2 结果与分析
2.1 牛Bcl-2基因的基因分析
2.1.1 牛Bcl-2基因序列预测分析运用BioEdit软件分析目标基因序列的组成。预测到Bcl-2基因长792 bp,单链分子质量为241 755.00 Da,双链分子质量为483 515.00 Da。4种碱基含量分别为A,17.17%;C,32.70%;G,32.32%;T,17.80%;G+C,65.03%;A+T,34.97%。该核苷酸序列中C含量最高,A含量最少,见表1。牛Bcl-2基因核苷酸预测见图1。

图1 牛Bcl-2基因核苷酸预测
2.1.2 牛Bcl-2基因的核酸基本分析使用NCBI在线网站进行Bcl-2核酸基本分析,对Bcl-2基因所在基因组数据进行预测,结果见图2。结果表明,预测Bcl-2基因在24号染色体上,外显子计数为7。
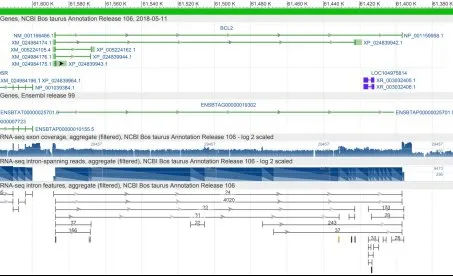
图2 牛Bcl-2基因的核酸基本分析
2.1.3 牛Bcl-2基因的同源性比对使用NCBIBLAST工具包进行核苷酸的初步同源性分析。将牛与已公布的抹香鲸(登录号XM_007105114.3)、小鰛鲸(登录号XM_007192009.1)、虎鲸(登录号XM_004268067.2)、太平洋短吻海豚(登录号XM_027118704.1)、长肢领航鲸(登录号XM_030868121.1)、非洲野驴(登录号XM_014843802.1)、山羊(登录号KJ782301.1)、牦牛(登录号MK050976.1)、北美野牛(登录号XM_010854740.1)、印度牛(登录号XM_019986619.1)、马铁菊头蝠(登录号XM_033087566.1)Bcl-2基因序列同源性比对,结果见图3。结果表明,该核苷酸序列高度保守,与牦牛(登录号MK050976.1)同源性相似度在99.86%。
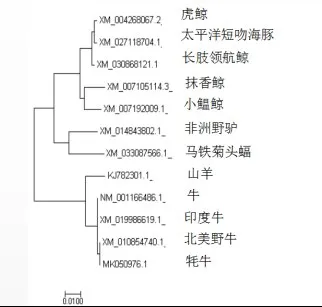
图3 Bcl-2基因序列同源性比较
2.2 牛Bcl-2蛋白结构与功能分析
2.2.1 牛Bcl-2氨基酸序列的组成分析使用NCBI在线程序预测牛Bcl-2氨基酸序列,测得牛Bcl-2蛋白包含229个氨基酸,结果见图4。

图4 牛Bcl-2氨基酸序列
采用BioEdit软件分析目标氨基酸的组成,并运用在线工具ExPASy-ProtParam tool分析Bcl-2蛋白基本理化性质,结果见表2。该蛋白质的公式为C1132H1717N311O316S9,原子总数为3 485,理论pI为6.65,蛋白质半衰期为30 h,不稳定性指数为58.20,将蛋白质分类为不稳定。脂肪指数为76.77,亲水性平均值(GRAVY)为-0.133。氨基酸残基数为229个,分子质量为25 026.10 Da。其中丙氨酸(Ala)占26个,是占比最大的,为11.35%;其他依次是甘氨酸(Gly)、亮氨酸(Leu)、脯氨酸(Pro),这三种氨基酸含量分别占比9.61%、9.17%、9.17%;最少的是胱氨酸(Cys),仅占0.87%。带负电荷的残基总数(Asp+Glu)为21,正电荷残基总数(Arg+Lys+His)为27。消光系数以L/(g·cm)为单位,在280 nm的水中测量。假设所有对Cys残基形成胱氨酸,外系数45 045 Abs 0.1%(=1 g/L)1.800,假设所有Cys残基均减少,外系数44 920 Abs 0.1%(=1 g/L)1.795。理论等电点为6.65,脂肪指数为76.77,GRAVY为-0.133,不稳定指数为58.20,半衰期为30 h,说明Bcl-2为酸性不稳定亲水蛋白。
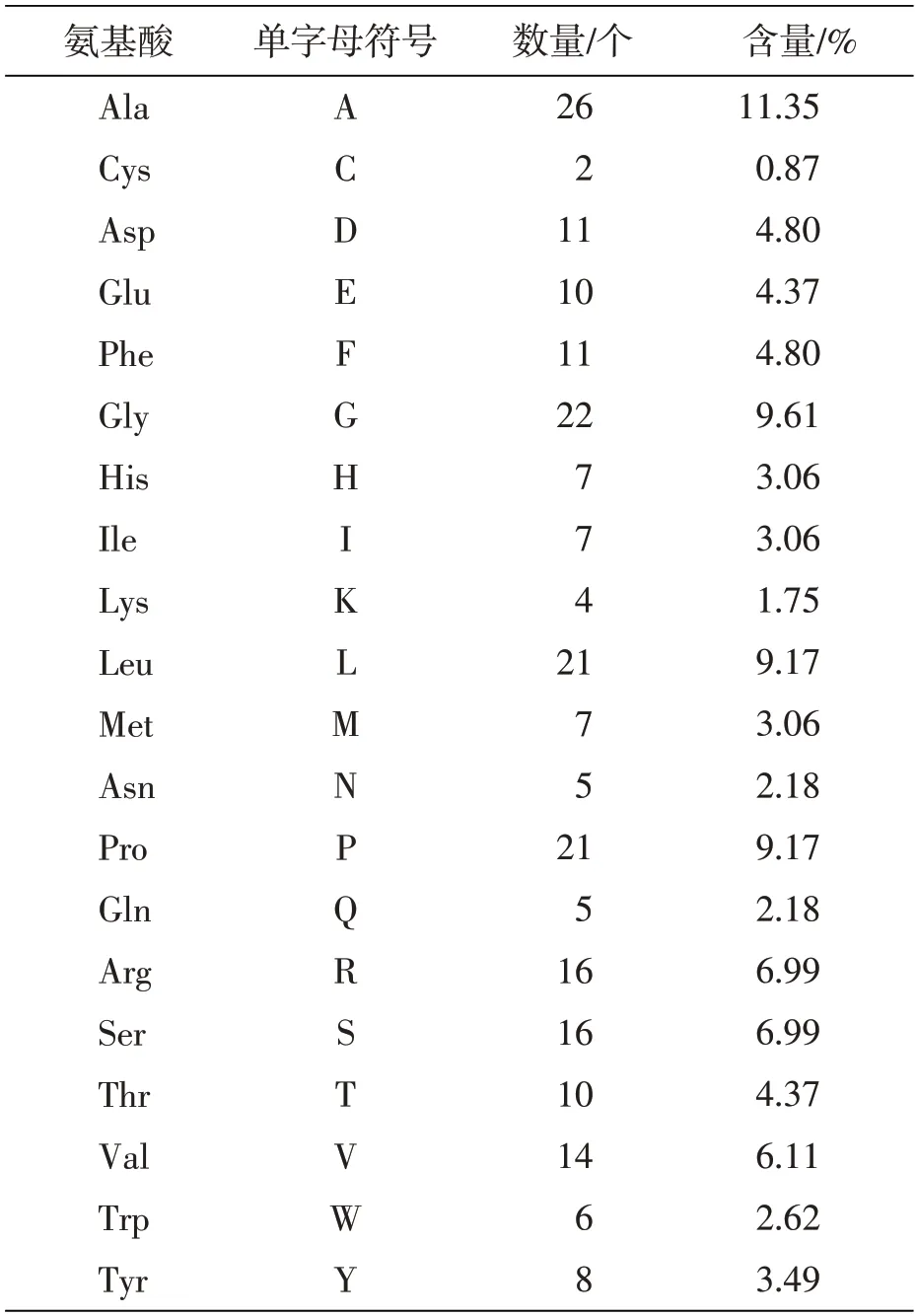
表2 牛Bcl-2氨基酸的组成
2.2.2 牛Bcl-2蛋白氨基酸序列同源性分析使用NCBI-BLAST进行牛Bcl-2蛋白同源性比对。将牛Bcl-2蛋白与亚洲水牛(登录号XP_020761266.1)、山羊(登录号NP_001301142.1)、绵羊(登录号XP_011959221.3)、白尾鹿(登录号VFV45177.1)、西班牙猞猁(登录号XP_032167375.1)、家猫(登录号XP_023096959.1)、金钱豹(登录号XP_019319377.1)、港海豹(登录号XP_032278690.1)、白鼬(登录号XP_025742125.1)、北海狗(登录号XP_006064629.1)的Bcl-2蛋白进行同源性比对,结果见图5。结果表明,与亚洲水牛的蛋白序列同源性最高,达到99.56%。
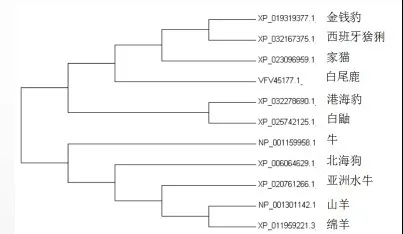
图5 Bcl-2氨基酸序列同源性预测
2.2.3 牛Bcl-2氨基酸分子的亲水性、疏水性分析运用在线工具ExPASy-ProtParam tool分析预测氨基酸与水结合的性质,结果见图6。结果表明,牛Bcl-2蛋白在第96,97位氨基酸处有最小值,GRAVY值为-2.700,在第213,214位氨基酸处有最大值,GRAVY值为2.422,疏水性氨基酸明显少于亲水性氨基酸,说明牛Bcl-2蛋白为亲水性蛋白。
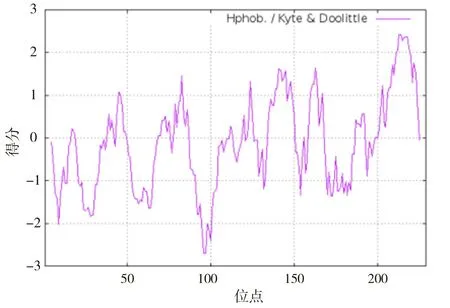
图6 牛Bcl-2蛋白质疏水性分析
2.2.4 牛Bcl-2蛋白质跨膜区分析运用TMHMMServer v.2.0与SPLIT 4.0两个工具对Bcl-2蛋白质跨膜区进行联合预测,结果见图7。预测结果表明,预测的跨膜螺旋数量为1;跨膜螺旋氨基酸残基数量的期望值为21.922 9(n≥18),可能含跨膜螺旋或者含有信号肽,因此Bcl-2蛋白有跨膜区;Bcl-2蛋白的前60个氨基酸中跨膜螺旋的氨基酸量的期望值为0.000 79;Bcl-2蛋白的1~203位氨基酸位于细胞膜内,204~225位氨基酸形成一个典型的跨膜螺旋区,227~229位氨基酸位于细胞膜表面,证明Bcl-2蛋白为跨膜蛋白。
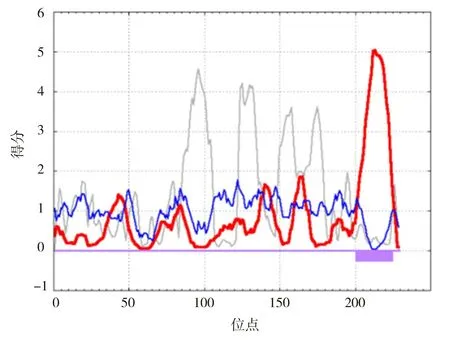
图7 牛Bcl-2蛋白质跨膜区SPLIT 4.0预测分析
2.2.5 牛Bcl-2蛋白信号肽预测根据SignalP 4.1 Server对蛋白质的信号肽区域进行预测,结果见图8。结果表明:该条氨基酸序列没有信号肽;牛Bcl-2蛋白C得分峰值位于第47,66,67位氨基酸,均为0.111;S得分峰值位于第55位氨基酸,为0.115;Y得分峰值位于第68位氨基酸,为0.107。根据上述预测结果判断,Bcl-2蛋白不存在信号肽,为非分泌蛋白。
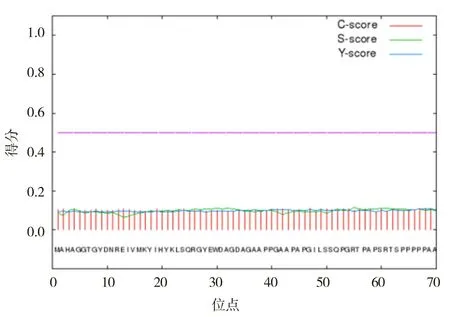
图8 牛Bcl-2蛋白信号肽预测图
2.2.6 牛Bcl-2蛋白分子亚细胞位点预测运用在线工具PSORTⅡ进行Bcl-2蛋白分子亚细胞位点预测,结果见表3。结果表明,Bcl-2蛋白有26.15%分布于细胞质,21.7%分布于分泌系统的囊泡、13.0%分布于核,13.0%分布于线粒体,8.7%分布于质膜,4.3%分布于细胞骨架,4.3%分布于液泡,4.3%分布于内质网、4.3%分布于高尔基体。
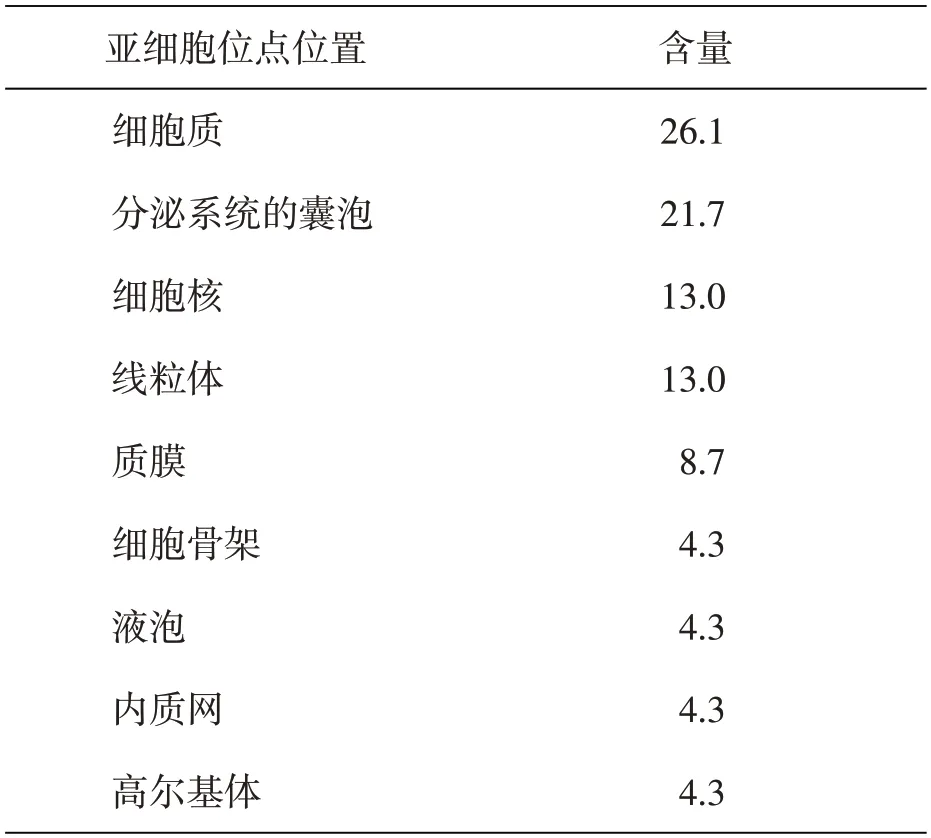
表3 牛Bcl-2蛋白分子亚细胞位点预测结果 %
2.2.7 牛Bcl-2蛋白结构域分析利用NCBI的CD-Search对Bcl-2蛋白的结构域进行预测分析,结果见图9。结果表明,Bcl-2蛋白有Bcl-2家族蛋白典型结构域和BH1-BH3结合位点。

图9 牛Bcl-2蛋白保守结构域分析
2.2.8 牛Bcl-2蛋白二级结构预测分析运用在线工具PSIpred-MEMSAT 3对Bcl-2蛋白二级结构进行预测,结果见图10。结果表明,预测Bcl-2蛋白由51.53%的α-螺旋、6.99%的β-转角、6.55%的延伸链与34.93%的无规卷曲组成,有7个α-螺旋,6个β-转角。
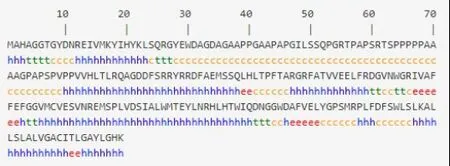
图10 牛Bcl-2蛋白二级结构预测
2.2.9 牛Bcl-2蛋白三级结构预测分析运用SWISS-MODEL工具按同源建模法构建出Bcl-2蛋白三级结构模型。对Bcl-2蛋白进行同源建模和三维结构预测,预测有3个模型,有2个模型描述为Bcl-2颉颃剂,1个模型为Bcl-2,见图11。Bcl-2蛋白和模板1gjh.1.A进行比较,GMQE为0.56,QMEAN为0.11,寡聚状态为单体,无配体,生物单位低聚状态为异二聚体,四级结构质量估计(QSQE)为0.00,有92.39%的氨基酸序列一致,并且预测的三级结构结果与二级结构预测结果基本一致。
图11 牛Bcl-2蛋白三级结构预测结果
3 结论与讨论
1)本试验中,分析目标基因组成,得出该核苷酸序列中C含量最高,A含量最少,DNA序列较稳定。经同源性分析该基因同系物,牛的直系同源是人类与小鼠,同属于哺乳动物,具有高度保守性。与已公布的几种动物Bcl-2基因序列进行同源性比对,得出牛与牦牛Bcl-2基因序列同源性最高,与其他品种牛也有较高的同源性;不同动物Bcl-2蛋白进行同源性比对,测得与亚洲水牛的蛋白序列同源性最高。牦牛与牛同属哺乳纲偶蹄目牛科,但对属于牛属还是牦牛属未有定论,不过长期以来中国用牦牛与普通牛进行杂交,现存牦牛的起源和形成在一定程度上吸收了普通牛的基因,其他品种的牛也与普通牛有较近的亲缘关系,所以Bcl-2基因具有高度保守性。
2)Bcl-2基因含有3个外显子,经剪切产生出2个开放阅读框,分别编码Bcl-2a和Bcl-2β蛋白。本试验结果表明,牛Bcl-2基因可编码229个氨基酸残基构成的可溶酸性蛋白质,分子质量为25 026.10 Da,含1个跨膜区,不含信号肽,非分泌蛋白,有3种三级结构模型,预测为跨膜性结构蛋白。不稳定性指数为58.20,将蛋白质分类为不稳定,预测Bcl-2蛋白通过共价键的形成与断裂产生不同的构型,或是通过聚集、表面吸附等方式在双向调节细胞凋亡上有重要作用。贾浩等[16]通过蛋白稳定常数(PSI)评价人类胞内蛋白寿命,结果表明,短半衰期的蛋白质绝大多数定位于细胞膜或膜性囊泡结构上,与预测Bcl-2蛋白亚位点位置相同,但其半衰期偏长,为30 h。Bcl-2基因可延长细胞存活时间且具备抗细胞凋亡的作用,在多种肿瘤中作为重要的凋亡抑制基因得到研究[17],Bcl-2蛋白的半衰期可向减少方向研究以应用于肿瘤治疗方面。
3)根据程金娜等[18]的研究,Bcl-2家族的三维结构主要为6~7个长度不一的疏水性α-螺旋,有利于Bcl-2成员之间的疏水性接触,促进异源二聚化作用,这与本试验预测的Bcl-2蛋白二级结构与三级结构类似。牛Bcl-2蛋白的1~203位氨基酸位于细胞膜内,此部分大多为亲水性氨基酸;204~225位氨基酸之间形成一个典型的跨膜螺旋区,227~229位氨基酸位于细胞膜表面,此部分主要由疏水性氨基酸构成,预测胞外疏水区结构是反应的主要区域,可能与接收胞外信号,使得跨膜区疏水区域发生改变来控制膜的通透性有关。研究表明,Bcl-2基因蛋白家族的结构主要由位于羧基端的跨膜结构域(transmembrane region,TM)和数量不等(1~4个)的Bcl-2同源结构域(Bcl-2 homology,BH)两大结构域组成。BH-4作为抗凋亡蛋白特有的结构域,缺失可导致抗凋亡蛋白功能的丧失,而被认为是死亡结构域的BH-3与促进凋亡有关[19-21]。该结构在家族成员的相互作用中起重要作用,Bcl-2蛋白可能通过疏水结构域与促凋亡蛋白的BH-3结合起颉颃作用,且Bcl-2蛋白的BH-3结构域与beclin1结合后形成复合物,降低脂质激酶Vps34活性,抑制beclin 1介导自噬的功能[22]。
4)细胞凋亡主要通过半胱氨酸天冬氨酸蛋白酶Caspase途径和组织结构损伤两种途径将死亡信号下传(downstream),后者以线粒体功能障碍为主要特征。根据Bcl-2蛋白分子亚细胞位点预测结果,除分布在细胞质中,还主要分布于分泌系统的囊泡、线粒体、内质网这些含有膜的细胞器上,以酸性亲水的跨膜蛋白形式存在。预测其可能通过控制膜的通透性、维护线粒体的完整性以抑制细胞凋亡,或是在凋亡信号作用下改变构型、异位并插入线粒体外膜发挥促凋亡活性[23-26]。吴开年等[27]的研究表明,Bcl-2蛋白对线粒体外膜和内膜的通透性进行控制,抑制了细胞线粒体膜电位的降低、细胞色素C和凋亡起始因子的释放以及Caspase蛋白酶的激活,从而抑制凋亡。
以上研究结果为开展牛Bcl-2基因和蛋白功能及其作用机制奠定了基础。
4 致谢
江西农业大学动物科学技术学院黄璐佳硕士对研究给予了帮助,谨致谢意!

