锂-二氧化碳电池关键材料的研究进展
顾 洋,王 朕,吴宏坤,肖 杰,曾晓苑
(昆明理工大学材料科学与工程学院,锂离子电池及材料制备技术国家地方联合工程实验室,云南省先进电池材料重点实验室,昆明 650093)
0 引 言
随着社会的快速进步和科技的不断革新,人类对能源的需求也越来越大,传统能源已经供不应求[1]。而且化石燃料在使用过程释放的温室气体(主要是CO2)所引起的日益严重的全球变暖已成为威胁人类生存的棘手问题[2-3]。因此,开发和利用高效的电能储存和转换系统引起了科学工作者们的极大关注。自20世纪90年代锂离子电池首次投入市场以来,锂离子电池以其电压高、体积小、质量轻、无污染、比能量高和循环寿命长等特点而受到人们的青睐[4]。它被应用于手机、笔记本电脑、电动汽车等各种产品中,使无化石燃料社会成为可能,也奠定了无线通信发展的基础。但传统锂离子电池的能量密度低,不能满足未来电动汽车和电网储能等领域的需求[4]。因此,积极开发新型高效清洁的电化学储能装置是大势所趋,这也被视为可能解决能源需求和环境危机的方法之一。


图1 锂-二氧化碳电池结构示意图Fig.1 Schematic diagram of the lithium-carbon dioxide battery structure
自锂-二氧化碳电池实现可逆循环以来,取得了一系列的成就。但在电池的充放电和循环过程中仍存在着许多难题。例如:放电比容量低、充电电位高、循环稳定性差等。本文对锂-二氧化碳电池的几种关键的充放电机理进行了总结。在阴极催化剂方面进行了系统介绍,并提出其发展状况和面临的挑战。最后,总结了安全高效的准固态电解质的最新研究进展和阳极锂保护为提高电池性能所做出的贡献。这些阐述和总结为开发可逆和高效的锂-二氧化碳电池提供了有效的指导。
1 锂-二氧化碳电池充放电机理
1.1 锂-二氧化碳电池放电机理
2013年,Archer团队首次在高温条件下设计出了大容量的锂-二氧化碳原电池,但电池的放电容量和放电电压均随环境温度升高而升高。这主要是因为,随着环境温度的升高,电解液中放电产物的溶解度增加,从而限制了放电产物在电极上的沉积厚度。其次,温度升高也使阴极和电解液界面处的传输势垒减小。经热力学计算和差示电化学质谱(DEMS)的测试,首次推测出反应式(1)为最有可能的放电路径[8]。
4Li+3CO2→2Li2CO3+C
(1)
随后,这一假设的放电机理得到了Li课题组的验证[9]。他们采用科琴黑(KB)和四甘醇二甲醚(TEGDME)为阴极材料和电解质,构建了一个锂-二氧化碳电池。该锂-二氧化碳电池在室温下表现出了1 032 mAh·g-1的高放电容量,从而揭示了锂-二氧化碳电池的可实现性。除了证明Li2CO3存在以外,他们还采用以多孔金为阴极的锂-二氧化碳电池作对比实验,通过表面增强拉曼谱(SERS)和电子能量损失谱(EELS)证明了无定形碳的存在。Li2CO3和C的形成得到了许多研究小组的肯定,人们也普遍认为,锂-二氧化碳电池的放电过程遵循式(1)。
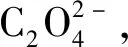
(2)
(3)
(4)
(5)
4Li++4e-+3CO2→2Li2CO3+C
(6)
由于正极催化剂具有电催化选择性,因此,正极催化剂在改变电化学反应过程和确定CO2的最终还原产物等方面起着关键性的作用。例如,Wang课题组发现,除了形成Li2CO3外,在三维多孔(不规则孔)Zn阴极上还产生了CO气体,而不是无定形碳,相应电化学还原机理可以用反应式(7)描述[12]。

(7)
目前,关于锂-二氧化碳电池的放电机理仍然存在着很大的争议,还需要研究者们付出更多努力去揭示其内在的反应机理。
1.2 锂-二氧化碳电池充电机理
在锂-二氧化碳电池的放电过程中,Li2CO3和C在阴极表面形成。因此在锂-二氧化碳电池充电过程中,也很可能发生Li2CO3的自分解或者Li2CO3和C之间的可逆反应过程。过去几年,人们一直在努力研究Li2CO3的电化学分解机理。根据目前的研究结果,Li2CO3的电化学分解过程有三个可能的方式。
第一条反应路径可以理解为Li2CO3的自分解,如反应式(8)所示。在此反应过程中会释放出CO2和O2,相应的电子转移数为每个CO2对应转移两个电子[13-14]。然而,将预填充Li2CO3的锂-二氧化碳电池进行充电时,在其醚基电解质中并未发现O2的产生。此外,在对以锰基有机骨架为正极材料的锂-二氧化碳电池放电后再充电过程研究发现,进行充电时,在其醚基电解质中并未检测到O2[13]。
2Li2CO3→2CO2+O2+4Li++4e-
(8)
(9)
(10)
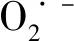
第三个反应途径是涉及Li2CO3和C之间的可逆反应(见反应式(11))。根据吉布斯自由能进行的热力学计算表明,该反应具有较低的可逆电势(2.8 V)[15]。因此,该路径对于设计真正可逆的锂-二氧化碳电池至关重要。一些研究人员也已经证实,在特殊催化剂(例如金属钌和锰基有机骨架)的辅助下,相应的锂-二氧化碳电池已经成功地形成反应式(11)的可逆反应[15-16]。
2Li2CO3+C→3CO2+4Li++4e-
(11)
2 锂-二氧化碳电池阴极催化剂
由上述的机理分析可知,锂-二氧化碳电池的主要放电产物为Li2CO3[2,17]。众所周知,Li2CO3是一种电导率低的绝缘体[1,7,18]。即使充电电压超过4.0 V,也很难使Li2CO3完全分解。因此,随着锂-二氧化碳电池循环时间的增加,不完全分解的Li2CO3容易产生积聚,将反应位点覆盖,并阻止反应气体的扩散,最终导致电池死亡。锂-二氧化碳电池实现实际应用的关键,主要取决于高效、低成本的阴极催化剂使绝缘的Li2CO3在阴极区高效的可逆形成和分解[3]。针对Li2CO3的生成和分解问题,对锂-二氧化碳电池阴极催化剂的设计总结出几条基本准则。阴极材料需具有:(1)良好的导电性和电化学稳定性;(2)优异的结构[19],例如,合适的孔隙度、大的孔隙率、大的比表面积等;(3)对Li2CO3具有高效的催化活性;(4)价格低廉。良好的导电性和化学稳定性可以保证电子的快速运输,并且在电池运行过程中不会被腐蚀和分解。结构的优异性可为放电产物的沉积提供足够的空间[20],也便于锂离子和反应气体等的传输。对Li2CO3的高效催化活性可以促进放电产物的生成与分解,有效地提高电池的性能(例如,提高放电容量、倍率性能、循环寿命和降低过电位等)。价格低廉的阴极材料是锂-二氧化碳电池走向实际应用的关键所在。在目前的报道中,所设计出的阴极材料很少能满足上述全部要求,这也是研究者们努力深入研究锂-二氧化碳电池阴极催化剂的原因。
2.1 碳基催化剂
碳材料具有高的电导率、大的比表面积[18]、可控的孔结构以及由缺陷工程和杂原子掺杂引起的可调整的表面电子状态等特点。因此,碳材料已经被广泛应用于各种电化学储能装置中。
在锂-二氧化碳电池发展的初期,最先引入了商业活性炭直接作为阴极催化剂(包括XC-72炭黑、Super P和科琴黑等)[8]。但由于商用活性炭的催化活性差,结构体系有限,因此商业活性炭并不是理想的催化材料。除上述商业活性炭材料外,一些功能碳纳米材料(碳纳米管、石墨烯等),由于其独特的量子尺寸效应和表面化学状态,使其具有优异的物理和电化学性能[21],因此被认为是用于CO2还原和析出反应的理想电催化材料,也是目前锂-二氧化碳电池领域应用较为广泛的一类碳材料。
碳纳米管具有优异的自身结构: 一维结构的碳纳米管具有出色的电导率,有利于电子的传输。其次,堆叠交错的碳纳米管可以形成相互交联的三维网络,如图2(a),这种结构为放电产物的沉积提供了足够的空间,也可有效改善电解质和CO2等物质的传质过程。2013年,周震教授课题组首次将碳纳米管作为锂-二氧化碳电池的阴极材料[2]。显著提高了电池的性能,特别是在初始放电容量和循环稳定性方面。在电流密度分别为50 mA·g-1和100 mA·g-1条件下,分别具有8 379 mAh·g-1和5 786 mAh·g-1的高放电容量。在电流密度为100 mA·g-1条件下,此电池可循环20圈。与碳纳米管类似,石墨烯还具有大的比表面积和高的电化学稳定性。在锂-氧气电池领域,以石墨烯作为锂-氧气电池的阴极材料,电池性能得到了显著的提高。受此启发, 2015年,周震教授课题组又将石墨烯作为锂-二氧化碳电池的阴极催化剂[17]。交联的石墨烯纳米片之间形成了具有多孔、褶皱结构的石墨烯纳米薄片,如图2(b)所示。这种独特的结构提高了孔隙率,促进电解质润湿和CO2的扩散。石墨烯本身也具有较高的催化活性。在上述两个优势的共同作用下,有效提高了锂-二氧化碳电池的性能。其中,首圈放电容量为14 774 mAh·g-1,在电流密度为50 mA·g-1和100 mA·g-1条件下,可分别运行20圈和10圈。
由于纯碳材料的催化活性有限,上述电池仍表现出库伦效率低、倍率性能和循环稳定性差等缺点。为提高碳材料的催化性能,研究者们提出了用杂原子修饰碳阴极催化剂来提高其催化性能的方法。杂原子掺杂可以调节碳材料的电子结构并改变碳材料的费米能级位置,这对气体分子的吸附方式和吸附能有很大影响[22]。因此,杂原子掺杂可以显著改善气体还原动力,同时提高电池阴极表面上的固态放电产物的分解动力。
王斌教授团队采用浮动催化剂化学气相沉积法(FCCVD)制备了竹节状氮掺杂碳纳米管纤维阴极(B-NCNTs)[1]。在碳纳米管原位生长过程中,大量的N整合在其中,形成了吡咯氮(N-5)和吡啶氮(N-6)。五边形的吡咯氮和六边形的吡啶氮的形成,导致纳米管易于闭合,并将典型的直柱状碳纳米管转变为具有显著周期性节点的竹节状形态,如图2(c)所示。B-NCNTs竹状结构不仅具有大的比表面积,而且结构稳定,可以耐受充电过程中超氧自由基离子等引起的结构破坏,进一步增强能量的储存和循环的稳定性。通过拉曼光谱法得到证实,除了形态发生变化外,在B-NCNTs表面上也产生了足够的缺陷和活性位点,其中吡咯氮可以提供高的电导率,吡啶氮和竹节上的缺陷促进二氧化碳还原(CO2RR)和二氧化碳释放(CO2ER)过程,即有利于催化CO2还原和Li2CO3分解。

图2 (a)碳纳米管阴极的SEM照片[2];(b)石墨烯阴极的SEM照片[17];(c)B-NCNTs阴极的SEM照片[1]Fig.2 (a) SEM image of carbon nanotube cathode[2]; (b) SEM image of graphene cathode[17];(c) SEM image of B-NCNTs cathode[1]
综上所述,在功能碳纳米材料良好的导电性和结构可调等一系列优点的支持下,电池的性能得到了有效的提高。但碳纳米材料对促进Li2CO3分解的能力有限,导致电池的充电过电位较高,循环性能不出色。这就促使研究者们探寻其他类型的优异催化剂来提高电池的整体性能。
2.2 贵金属基催化剂
众所周知,贵金属、贵金属氧化物及其复合材料等具有独特的电子结构和良好的化学、电化学稳定性,在电催化领域被认为是优异的电催化剂[23]。其固有的半填充反键状态可以在催化剂和反应物之间赋予适当的吸附强度,从而改善反应动力学[24]。
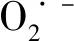
在Li-O2电池的正极材料中,RuO2因其优异的催化性能,而被广泛地应用。受此启发,Zou团队设计出了CNT和RuO2复合的阴极材料(CNT@RuO2)[25]。该锂-二氧化碳电池在电流密度为50 mA·g-1和恒定容量为500 mAh·g-1条件下,可以循环55圈。并且前30圈的充电电压可以完全控制在4.0 V以下。特别是CNT@RuO2阴极可以实现预填充的大部Li2CO3分解,并在3.9 V左右显示出平台。证明了RuO2对Li2CO3分解的高催化活性。贵金属Ir与贵金属Ru 同样具有高效的催化活性。郭少军教授团队在N掺杂碳纳米纤维上负载超薄褶皱Ir纳米片(IrNSs-CNFs)[26]。通过原位SEM、XRD、XPS、红外光谱和拉曼光谱测试结果分析表明,IrNSs-CNFs在放电过程中可以稳定非晶态中间产物(Li2C2O4),并延迟其向片状Li2CO3的转变。这可以使放电产物在更小的充电电压下分解,进而提高电池的循环性能。
2.3 过渡金属基催化剂
贵金属的巨大成本和稀缺性限制了其在锂-二氧化碳电池体系中的进一步应用[3]。因此,发展高效非贵金属基催化剂是解决这些问题的一种更为实际的策略。过渡金属由于其多价性,在电催化领域表现出良好的活性,加之成本低,有望取代贵金属[3]。近些年,过渡金属基材料在锂-二氧化碳电池中的应用也已经得到了深入的研究。
其中,金属铜能够在饱和的CO2水溶液中对CO2进行高效的定向催化,并且具有稳定性高、价格低等特点[27]。受此启发,周震教授课题组制备出了将铜纳米粒子高度分散在氮掺杂的石墨烯上的铜/石墨烯(Cu/NG)复合材料[28]。Cu纳米颗粒在充电过程中有利于Li2CO3和非晶碳发生反应,释放Li+和CO2。更重要的是,通过TEM图像的精确分析,直接证明了当电池循环一定圈数时,纳米铜颗粒表面覆盖着一层CuO薄膜。作者认为,铜纳米颗粒表面的CuO薄膜是由充电过程中Li2CO3自分解产生的超氧自由基攻击所致。因此,作者提出了一种涉及锂-二氧化碳电池的铜纳米粒子的反应机理,即Li2CO3分解产生的超氧自由基会进一步氧化分散的Cu纳米颗粒,使得Cu纳米颗粒表面形成稳定的保护层。因此,阴极的稳定性在随后的循环中得到了提高。这种通过在阴极表面形成保护层的方法,为设计高效锂-二氧化碳电池阴极材料提供了新思路。
过渡金属碳化物的电子导电性比较高,可以提高阴极催化剂与放电产物界面的电子运输,进而降低电池过电压、提高电池倍率性能。目前,有研究者对其在锂-二氧化碳电池中的作用进行研究,并有所发现。以碳化钼(Mo2C)为例,因其与第八族金属相似的优异催化性能而被广泛研究,并且在析氢反应和CO2还原反应中也引起了广泛关注。与Mo相比,Mo2C的高活性归因于C的引入所引起的电子性质的改变,这影响了Mo-C结合能和吸附质的反应活性。陈军教授团队以三氧化钼(MoO3)和碳纳米管为原料,采用碳热还原法制备了Mo2C/CNT[11]。通过Raman光谱和XPS分析表明,当Mo2C/CNT作为锂-二氧化碳电池的阴极时,放电产物为Li2C2O4-Mo2C。此非晶态放电产物Li2C2O4-Mo2C在3.5 V以下可以彻底分解,进而有效降低电池的充电电压。
在过渡金属的研究过程中,人们发现对于催化剂和阴极独特空间结构的设计有利于提高电池的整体性能。金属有机骨架(MOF)是一种具有周期性网络结构的晶体多孔有机-无机杂化材料,由无机金属中心(通常是金属离子或金属团簇)和桥联有机配体自组装而成,并具有高孔隙率、低密度、大比表面积、孔道规则、孔径可调等一系列优点。无机材料的刚性和有机材料的柔性结合使MOF家族在现代材料研究领域有着巨大的发展前景[29]。
王博教授课题组首次将MOF应用在锂-二氧化碳电池系统中。通过研究了8种多孔MOF(Mn2(dobdc)、Co2(dobdc)、Ni2(dobdc)、Mn(bdc)、Fe(bdc)、Cu(bdc)、Mn(C2H2N3)、Mn(HCOO)2) 以及两种非多孔材料(MnCO3和MnO)[30]。采用X射线衍射、扫描电镜、电化学阻抗谱、拉曼光谱和原位差示电化学质谱等表征技术,研究了MOF电极上的电化学反应。结果表明:(1)选择二价锰(Mn(Ⅱ))为中心金属是降低充电电压的必要条件;(2)随着MOF孔隙率和CO2吸收量的增加,放电容量的上限呈上升趋势;(3) MOF吸附CO2的等排热对电荷的极化产生影响;(4)放电时,MOF对Li2CO3的沉积影响很大,MOF使Li2CO3在整个电极中形成均匀分散的纳米结构。最后, MOF减缓了电极电荷转移电阻的增长,并保证了Li2CO3在充电过程中容易完全地转化为CO2。MOFs在CO2吸附富集、Li2CO3沉积分解等方面的独特优势,证明了其作为高性能锂-二氧化碳电池多功能催化剂的巨大潜力。
2.4 可溶性催化剂
为了促进放电产物的分解,研究者们已经对具有CO2ER催化活性的固体催化剂进行了深入研究。然而,固体催化剂与固态放电产物接触并不紧密。在充电过程中,催化阴极表面的放电产物会快速分解,而催化阴极对未在电极表面区域的放电产物的催化活性降低,随着循环周期的增加,放电产物积累,过电位逐渐增大。更重要的是,这些固态催化剂一旦被反应产物覆盖,其有效性就会降低。因此,固体催化剂并不是分解锂-二氧化碳电池中Li2CO3最理想的方法。近年来,可溶性氧化还原介质(RM)作为电子空穴转移剂被广泛应用于改善锂电池的性能。与固-固反应产生的较大过电位相比,固液界面反应更容易发生。作为移动电荷载体,RM能氧化不溶性放电产物,促进放电产物在液固界面上分解,可有效降低过电位。目前,通过设计可溶性催化剂来提升锂-二氧化碳电池性能也成为人们研究的热点。
在充电过程中,当充电电压达RM分子的氧化电位时,RM将电子转移到阴极并且电化学氧化到所需的氧化状态(见反应式(12))。随后,RMn+将绝缘的Li2CO3化学氧化为Li+和CO2。同时,RMn+还原为初始状态(见反应式(13))。因此,充电过程中显示的电压并不是使Li2CO3分解的电压,而是使RM发生氧化的电压(RM的氧化电压低于Li2CO3分解电压)。最终结果表明,锂-二氧化碳电池的充电电压显著降低。
RM→RMn++ne-
(12)
RMn++mLi2CO3→RM+pLi++qCO2
(13)
周震教授课题组首次将LiBr作为可溶性催化剂引入锂-二氧化碳电池中[31]。在放电过程中有利于放电产物形成易于分解的形态,未加LiBr所形成的是块状放电产物,加入LiBr所形成的是松球状放电产物,此松球状形态有利于放电产物的分解,对于提高电池的循环性能和倍率性能有很大帮助。在充电过程中,电化学反应产生的Br2可以化学氧化Li2CO3和C。在首圈循环测试中,与没有添加LiBr的锂-二氧化碳电池相比,添加LiBr的锂-二氧化碳电池在电流密度为100 mA·g-1条件下,充电电压约降低0.3 V。在循环测试中,在恒定容量为500 mAh·g-1、电流密度为100 mA·g-1条件下,电池能稳定循环38圈。而不含LiBr的电池在电流密度为100 mA·g-1条件下仅能循环4圈。此项研究为氧化还原介质有效改善锂-二氧化碳电池的电化学性能提供了新的视角。
李彦光课题组通过一种简便的微波加热法合成出了共轭酞箐钴(CoPPc)聚合物[32]。与钴酞菁单体(CoPc)相比,CoPPc具有优异的化学、物理和机械稳定性。最重要的是共轭酞箐钴对Li2CO3的可逆形成和分解表现出更高的催化活性,将其组装在柔性锂-二氧化碳电池中,表现出极小过电压和出色的循环稳定性。此外,这种聚合物催化剂的弹性和可再加工性使柔性电池的制备成为可能。
RM虽是一个很具发展潜力的催化剂。但以RM为催化剂的锂-二氧化碳电池也存在发展障碍,氧化还原介质在扩散的RMn+和锂阳极之间的穿梭,会导致RM降解和锂阳极的持续恶化,这不可避免地会导致锂-二氧化碳电池能效降低和循环稳定性变差。
3 固态电解质与锂保护
3.1 准固态电解质
含有醚或砜溶剂的非质子液态电解质(LEs)由于具有比碳酸盐更宽的电化学窗口和更高的稳定性而被广泛应用于锂-二氧化碳电池中。但这些电解质在实际的电池系统中仍然存在一些严重的缺陷。例如,CO2在非质子液体电解质中具有较高的溶解度[33]。这通常导致放电产物在阴极表面倾向于形成一种厚而连续的聚合物状形态,没有任何多孔结构,不利于放电产物的分解[2,17]。其次,在半开放式的锂-二氧化碳电池系统中,传统液态电解质的使用会带来泄漏、挥发和易燃性等相关的安全隐患[34]。此外,锂-二氧化碳电池中使用液态电解质存在另一个固有缺点:在电池循环过程中,锂离子在锂金属表面的不均匀沉积会不可避免地形成锂枝晶,随着循环时间的增加,锂枝晶不断生长,最终会造成电池短路。同时,液态电解质中的CO2也会与金属锂发生反应,导致副产物的生成,使电池的性能下降。为克服上述缺点和实现高安全性,研究者们提出了一种用(准)固态电解质代替有机液态电解质的策略。
2017年,陈军课题组报道了一种基于添加二氧化硅的聚甲基丙烯酸甲酯/聚乙二醇-高氯酸锂-3%二氧化硅复合聚合物电解质(CPE)的无液固态锂-二氧化碳电池[35],如图3(a)所示。这种CPE不仅具有理想的机械性能,还具有良好的离子导电性(7.14×10-2mS·cm-1,55 ℃)。此外,使用这种CPE不但保护了锂阳极不受CO2侵蚀,而且凝胶态、无液体的CPE直接涂覆在碳材料集流体上,形成集成的CPE@C阴极结构,避免了黏合剂的使用,也降低了界面电阻。将其引入到锂-二氧化碳电池中,同时获得了良好的柔韧性和较长的循环寿命和优异的倍率性能。
受陈军教授论文的启发,夏永耀教授团队采用传统的紫外固化技术,在碳纳米管气相催化电极上制备了一种结构紧凑、热稳定性好、离子导电率高的凝胶聚合物电解质(GPE)[36]。该电解质填充了传统的LiTFSI/TEGDME液体电解质,解决了因无液电解质的低离子电导率而限制其在室温下的循环性能和倍率性能的问题。通过SEM形态观察、电化学阻抗谱(EIS)、线性扫描伏安(LSV)和热重分析(TG)等研究发现,这种GPE的结构致密,离子电导率(0.5 mS·cm-1)接近液体电解质的电导率,电化学稳定性高(~4.5 V),热稳定性高(低于100 ℃)。将其作为锂-二氧化碳电池的电解质,Li2CO3呈颗粒状并且结晶度降低,如图3(b)所示。这使得Li2CO3在锂-二氧化碳电池中表现出高的放电容量、较好的倍率性能、低的过电位和更长的循环寿命。
目前,锂二氧化碳电池固态电解质性能的主要突破点还是在提高离子导电性、降低界面电阻和提高结构性能。固态电解质也是柔性锂二氧化碳实际应用的重要突破点。
3.2 锂保护
金属锂作为电池的阳极具有两大优势,第一是金属锂的理论比容量最大,为3 860 mA·g-1。第二是锂作为对电极电位很低,可以输出2.5 V以上的电压[37]。金属锂作为阳极优点很明显,缺点也很突出。在循环过程中,由于锂非均相沉积和剥离,锂金属表面形成的锂枝晶会导致严重的安全问题,即热失控和短路[38]。其次,金属锂与电解液/溶解气体反应生成的钝化膜不仅增加了电位极化,而且限制了相应电池的循环寿命[39]。虽然使用固态电解质可以进行锂保护,但并不能高效消除锂枝晶的影响。
在锂-二氧化碳电池中,专门针对锂保护方面鲜有报道。最近,来自中国台湾的Liu等发现,钌(Ru)纳米粒子锚定在碳纳米管上(Ru/CNT),Ru/CNT作为锂-二氧化碳电池的催化剂阴极[40],在低恒定容量(100 mAh·g-1)的循环试验下,电池性能降低的根源是催化阴极表面上积聚的放电产物无法彻底分解,与先前研究中的观察结果相同。
然而,当锂-二氧化碳电池在高恒定容量(500 mAh·g-1)条件下循环几圈,电池会突然死亡,并且在阴极上没有发现残留的Li2CO3。经过测试研究得出结论,在500 mAh·g-1的恒定容量下循环时,TEGDME电解液发生分解,锂阳极上产生的锂枝晶和钝化物质(LiOH和Li2CO3)是造成电池性能下降的主要原因(见图3(c))。当采用锂箔置换法,在500 mAh·g-1的恒定容量下,Ru/CNT阴极可累计循环100次。这些结果表明,不仅在阴极的活性部位Li2CO3形成了堵塞,而且在阳极上形成了锂枝晶和钝化材料,导致了锂-二氧化碳电池性能的降低。根据上述结果,作者利用射频磁控溅射系统在锂金属上沉积了碳薄膜(C/Li),以抑制电池在循环过程中锂枝晶的形成,并提高了对电解质分解所产生的水的防御能力。采用Ru/CNT催化剂和C/Li阳极制备的锂-二氧化碳电池在500 mAh·g-1的恒定容量下,循环性能明显提高。由此可知,锂阳极保护对提高电池性能的重要性。

图3 (a)具有CPE电解质的锂-二氧化碳电池构造图[35];(b)具有GPE电解质的锂-二氧化碳电池放电产物的SEM照片[36];(c)锂-二氧化碳电池循环过程锂阳极产生的锂枝晶的SEM照片[37]Fig.3 (a) Structure of a lithium-carbon dioxide battery with a CPE electrolyte[35]; (b) SEM image of the discharge product of a lithium-carbon dioxide battery with a GPE electrolyte[36]; (c) SEM image of the lithium dendrites produced by the lithium anode during the cycle of the lithium-carbon dioxide battery[37]
4 结语与展望
虽然锂-二氧化碳电池发展历史较短,在最近几年,科研人员在其机理方面的研究取得了巨大突破,但是对于锂-二氧化碳的充放电机理仍然存在争议。随着研究的不断深入,其内在反应机理一定会被揭示。阴极催化剂对于电池性能的提高起到了显著的作用,但至今仍没有一种催化剂能全部满足导电性良好、结构优异、催化活性高、价格低廉的要求。目前,锂-二氧化碳电池研究者也为这个目标而努力。为了进一步提高电池的性能和安全性,锂-二氧化碳电池中的固态电解质也取得了很大的进步,这为柔性电池的发展奠定了坚实的基础。阳极锂保护对提升电池循环性能发挥了显著的作用,这也将是以后发展的方向。尽管锂-二氧化碳电池领域仍存在许多科学和技术挑战,但我们坚信锂-二氧化碳电池将在不久的将来成为下一代电化学储能的主流。在越来越多的研究人员不断努力下,这蕴含巨大潜力的电化学技术将获得广阔的应用前景。

