铜铟硫三元量子点的合成及在生物领域的应用 *
刘美娜,马小芳,李程豪,童金辉,周桂江,关晓琳
(1. 西北师范大学 生态环境相关高分子材料教育部重点实验室甘肃省高分子材料重点实验室 化学化工学院,兰州 730070;2. 甘肃中医药大学 基础医学院,兰州 730000; 3. 西安交通大学 理学院应用化学系,西安 710049)
0 引 言
作为在“2016新材料资本技术春季峰会”上发布的20大未来最具潜力新材料之一的量子点(quantum dots, QDs),是一种极小的半导体纳米晶体,呈现出特殊的光、电、磁学性质,在医学、太阳能电池、显示照明等领域前景巨大[1-4]。特别是自2014年底,TCL在北京推出新品H9700 QDs电视,并在中国市场取得不俗的销售业绩,更使QDs的开发研究进入空前白热化。
QDs是一类球形或准球形纳米粒子,它具有1~10 nm的稳定直径,且由半导体材料制成(通常由Ⅱ-Ⅵ,Ⅲ-Ⅳ或Ⅰ-Ⅲ-Ⅵ元素组成)[5-6]。QDs由于其独特的光学性质,如高亮度、发射光波长可调、激发光谱宽、发射光谱窄、荧光寿命长和抗光漂白性高等优势,在近几十年内一直引起广泛关注。
80年代初期,贝尔实验室的Louis Brus博士,前苏联Yoff 研究所的Alexander Efros和Victor.I. Klimov 博士[7]在研究 QDs尺寸时均发现:不同粒径尺寸的硫化镉(CdS)QDs发射的荧光颜色是不一样的,如图1所示。这种有趣的实验现象可用“量子限域效应”解释,且QDs尺寸与发光颜色之间存在特定的变化规律。该研究结果加速了QDs的发展,各种结构性能的QDs材料被相继开发和应用。
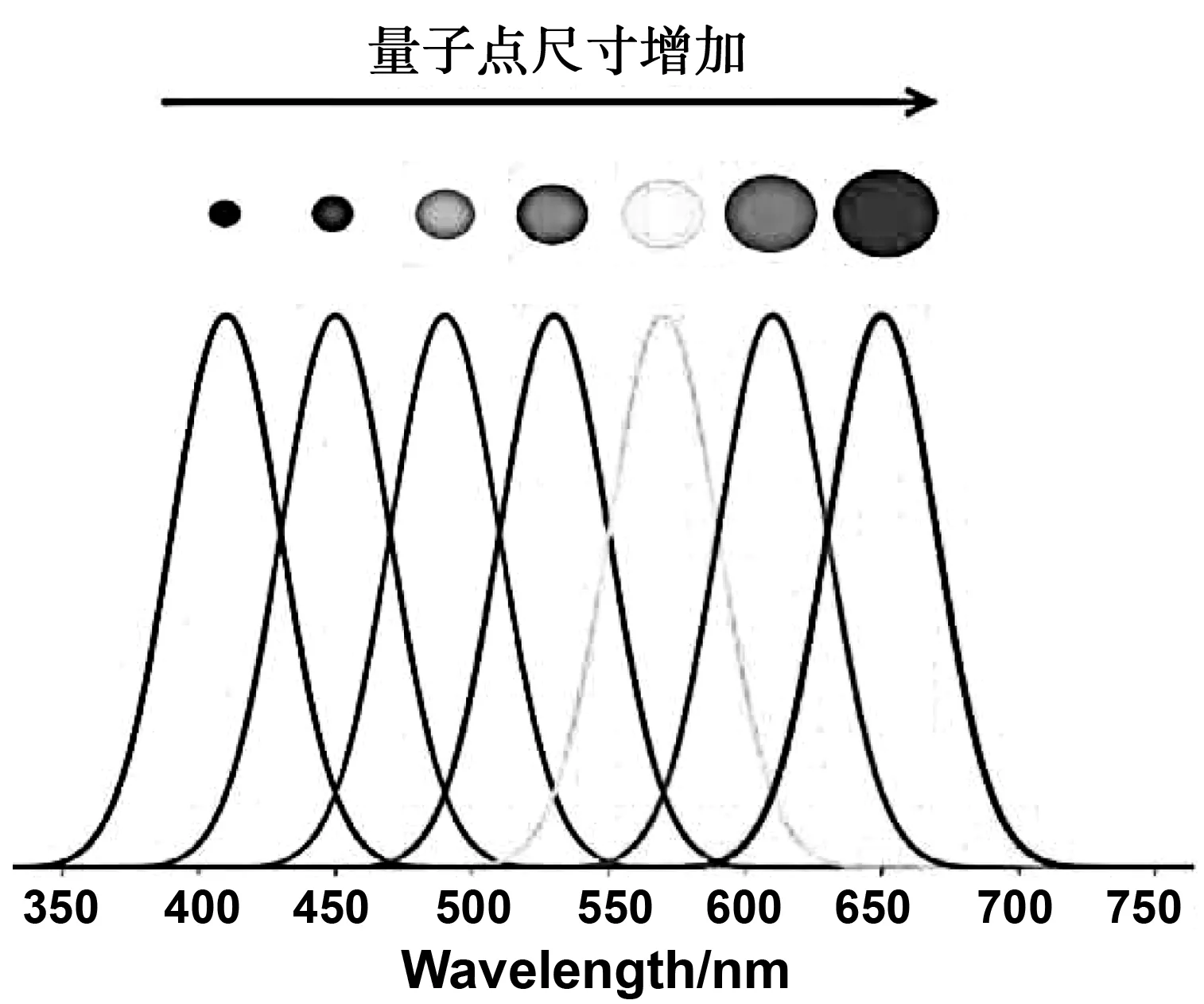
图1 QDs的荧光随尺寸增大发生红移现象Fig 1 Red shift in the fluorescence emission peak with respect to the increase in quantum dot size
研究早期,QDs主要是在有机相中合成,制备过程中需要复杂的前驱体及较高的温度[8-9],导致合成条件苛刻,步骤繁琐,操作难度高,且制备所得QDs材料水溶性较差,限制了其在生物医学领域的广泛应用[10-11]。研究者为了提高QDs的水溶性和生物相容性,最初采用通过在QDs表面进行配体交换和接枝修饰的方法将有机相转化为水相[12-16]。其中最常用的方式是将一些具有生物相容性的功能分子接枝修饰于QDs表面,达到增强原有QDs的水溶性和生物相容性的目标。例如,1988年Paul Alivisatos和Warren Chan两位教授课题组[17-18]分别通过改良CdSe/ZnS QDs的合成方法,将水溶性的二氧化硅壳接枝在表面,并与生物大分子生物素(C10H16N2O3S)结合,将其应用于3T3 cells(小鼠成纤维细胞)中获得良好的荧光显影效果,成功实现QDs在活细胞体系中的荧光成像,如图2所示。这一成果发表在了Science上,引起广泛关注。

图2 CdSe/ZnS QDs在小鼠成纤维细胞中的成像图Fig 2 CdSe/ZnS QDs imageing in 3T3 cells
但是,QDs在上述由油相向水相的转化过程中,荧光量子产率(PLQY)和稳定性均会发生明显的降低,影响QDs的实际应用效果[19-22]。而与有机相合成方法相比,QDs的水相合成方法具有操作简单、过程环保、成本低廉以及生物相容性良好等优势,是合成QDs的最佳方法。例如,佛罗里达州立大学Hedi Mattoussi教授课题组[23-24]利用亲水性聚合物在水相中通过一步法制备出高量子产率和光稳定好,并具有多个反应位点的QDs复合材料。南京邮电大学材料科学与工程学院的汪联辉教授发展了基于聚合物/QDs纳米复合物光电材料的新型生物传感器及其检测技术,并成功用于生物分子的高灵敏、高特异性检测[25- 26]。本课题组在环境友好水溶性聚合物/QDs纳米复合材料及多类型聚合物高效修饰QDs方面也开展了一些研究,并已研制出检测环境水样中痕量重金属离子及溶解性有机质的QDs荧光探针[27-28]。
目前,研究较多的主要是Ⅱ-Ⅵ二元族QDs,例如CdS、CdTe、CdSe、CdS /ZnS、CdSe/ZnS QDs等。但是由于其中重金属离子Cd2+的释放会产生很高毒性,对环境和人类的身体健康造成不同程度的影响,如Cd2+或Pb2+等重金属元素在细胞中聚集最终将导致细胞死亡[29]。因此,开发不含有毒重金属元素的QDs来替代基于Cd2+或者Pb2+的二元QDs具有重要的研究和应用价值。
Ⅰ-Ⅲ-Ⅵ型QDs,是近些年出现的一种新型QDs,克服了传统QDs包含对环境和生物体系毒性较大的重金属元素(镉或铅)的问题,可以有效地降低QDs的生物毒性和对环境污染,扩大了QDs的应用范围[30-31]。其中,CuInS2由于无毒,太阳光吸收系数高,光化学性能稳定且荧光波长涵盖从可见光区到近红外区,是一种非常理想的太阳能电池和生物光学成像材料[32]。
CuInS2QDs具有QDs特有的带隙结构,其结晶结构有两种,分别是斜方晶型结构和四方黄铜矿结构,对应的带宽分别1.98和1.87 eV[33]。基于CuInS2QDs特殊的发光机理,其荧光光谱可以覆盖整个可见光和部分近红外区域,发射出的光子可以通过渗透生物体组织并减小生物体的自荧光所带来的干扰[34-35]。同时,CuInS2QDs具有大的斯托克斯位移,长的荧光寿命,较长的发射波能减少外界激发波带来的干扰,有利于生物成像应用。此外,与传统的二元QDs相比,CuInS2QDs没有明显的第一激子峰,在可见光和近红外区域吸光系数很大,且平均荧光寿命普遍比二元QDs高[36]。并且,CuInS2QDs可以在较为温和的条件下合成[37]。因而,近年来越来越多的研究者选用CuInS2量子点作为研究及应用对象,以达到降低毒性、环保的效果,从而满足当前对环境友好型材料的战略要求[38-41]。尤其在生物应用领域被视为最具潜力的新型QDs材料。
1 CuInS2 QDs的合成
目前,CuInS2三元QDs的合成方法主要包括有机相和水相两种方式。有机相合成是目前研究的主导,而水相合成也越来越得到研究者的青睐,两种方法具有各自的优点,并被不断发展和完善。
1.1 油溶性CuInS2 QDs的合成
1993年时,Hirpo等[42]首先制备出含有Cu, In, S三种元素的前驱体(PPh3)2CuIn(SEt)4,随后通过热解重量分析法得到了一种新型CuInS2三元QDs。然而该方法中前驱体的转变过程较为复杂。 2003年,Castr课题组[43]首次通过在200~300 ℃下热分解前驱体(PPh3)2CuIn(SEt)4的方法,制备出尺寸较小、具有黄铜矿结构的CuInS2QDs。2008年时,Gardner课题组[44]改用微波照射前驱体(PPh3)2CuIn(SEt)4成功合成了CuInS2QDs。上述方法都是在一定条件下以金属有机分子(PPh3)2CuIn(SEt)4为前驱体,采用一定的方式将三种元素分解出来从而制备CuInS2QDs。但是,由于前驱体(PPh3)2CuIn(SEt)4制备过程繁琐,反应成本过高,并具有一定的毒性,不利于大规模合成CuInS2QDs类材料。
此后,研究者又陆续开发出一些新的方法制备CuInS2QDs,包括微波协助法[45]、热注法[46]以及热溶剂法等[47]。2008年时,北京理工大学的钟海政教授课题组[48]以乙酸铟和乙酸亚铜为原料,烷基硫醇为硫源在高温240 ℃下制备出CuInS2QDs,并通过改变反应温度和时间有效控制CuInS2QDs的尺寸和光学特性。这种方法避免了复杂结构前驱体(PPh3)2CuIn(SEt)4的制备。2016年,Prashant教授课题组[49]通过改变金属离子Cu/In的比例,实现了对CuInS2QDs发光颜色的有效调控。
此外,研究者常通过在QDs表面进行壳层包覆或制备合金的方式进一步提高CuInS2QDs的PLQY和发光稳定性[50-51]。例如,2011年,Heesun Yang等[52]在230 ℃下,将阳离子前驱体碘化亚铜(CuI)和乙酸铟,以及配体正十二硫醇加入溶剂1-十八烯中反应5 min,先形成CuInS2量子点核,然后注入Zn前驱体硬脂酸锌溶液,在240 ℃下反应1 h后在CuInS2量子点核表面形成ZnS壳层,即得到核壳结构的CuInS2/ZnS量子点,其量子效率高达78 %。
目前,大多数CuInS2QDs的合成是在有机溶剂及高温条件下进行的[53-54]。这种“有机相合成法”需要高温仪器设备,实验操作难度较高,且制备出的CuInS2QDs具有很强的亲油性,水溶性很差,难于在含水的生物环境中应用。而增强上述CuInS2QDs亲水能力的常用方法是通过配体交换或者在QDs表面接枝亲水性的聚合物来实现。但在此转化过程中显著延长了材料合成周期,提高了制备成本。因此,通过直接在水溶液中合成CuInS2QDs是获得此类水溶性材料的最佳选择。
1.2 水溶性CuInS2 QDs的合成
1.2.1 一步水相合成法
与前述有机相合成方法不同的是,水相合成法步骤少,操作简单,有效避免后期的纯化和修饰过程,所得QDs具有优异的水溶性,可被直接应用于生物领域[55-58]。迄今为止,水相合成CuInS2QDs的配体及稳定剂大多为两亲性分子,如巯基丙酸(MPA)、巯基乙酸(TGA)等小分子。例如,2014年,吉林大学的苏星光课题组[59]以氯化铜(CuCl2)、氯化铟(InCl3)和硫脲(CS(NH2)2) 为原料,MPA为配体,在150 ℃及pH=11的条件下,通过在反应釜中反应21 h,成功制备出发红光的水溶性CuInS2QDs。同年,Zhou等[60]以CuCl2、InCl3和硫化钠(Na2S)为原料,巯基乙酸(TGA)为配体在130 ℃下反应7h,得到了结构为纤维锌矿晶型的水溶性的CuInS2QDs。
然而,由于含有巯基的小分子具有强烈的刺激性气味,在实验和后期处理过程中会释放出毒性气体,危害科研人员的身体健康。因此,开发低毒或无毒的高效配体是水相合成法制备CuInS2QDs急需解决的问题。目前,已有一些有效的低毒性配体被报道,例如,Gao课题组[61]以CuCl2、InCl3和CS(NH2)2为原料,L-谷氨酸(PGA)为配体在150 ℃、pH=11.3的条件下在反应釜中反应21 h,制备得到水溶性的CuInS2QDs,然后将其与抗癌药物阿霉素(DOX)结合制备得到功能化的量子点CuInS2-PGA-DOX。由于DOX可通过电子转移淬灭CuInS2QDs的荧光,从而导致CuInS2QDs处于荧光“关闭”状态。而当CuInS2-PGA-DOX纳米颗粒被癌细胞吞噬后,由于水解释作用释放出DOX,激活CuInS2QDs进入荧光“开启”状态。因此,CuInS2-PGA-DOX纳米颗粒不仅可以将抗癌药物DOX有效传递至目标癌细胞中,并且通过CuInS2QDs的荧光“开启”信号强弱变化,实时监控抗癌药物DOX的释放情况,有望实现诊疗一体化,在癌症治疗的临床应用方面发挥作用,如图3所示。
虽然,通过水相合成法制备CuInS2QDs,有效的克服了有机相中实验条件苛刻、制备过程繁琐和产品水溶性差等难题,但在应用中却存在PLQY低、稳定性差等缺陷。因此,研究者们仍然在不断尝试开发新的水相配体,以及改进合成方法,期望获得发光性能更加优异的水溶性CuInS2QDs,满足生物医学领域的应用需求。
1.2.2 油溶性CuInS2QDs的表面亲水修饰
由于有机相合成法制备的CuInS2三元QDs荧光性能优异,因此,目前大部分的高质量QDs仍采用此方法来合成,然后通过三种方法解决因其表面大量疏水基团存在而导致的亲水性差,无法有效在生物医学领域应用的难题[62]。第一种方法是配体交换法,顾名思义就是将QDs表面的疏水基团交换为亲水基团。Zhao等[63]用CuI、醋酸
铟(In(Ac)3)和Zn(Ac)2为原料,在230 ℃下合成了表面含有疏水性油酰胺(OLA)结构的高效发光CuInS2/ZnS核壳QDs,PLQY高达70%。随后,基于MPA对量子点表面具有更高的表面亲和能力,从而通过配体交换取代CuInS2/ZnS QDs表面的OLA。紧接着,又通过GSH与MPA之间的配体交换,成功获得表面含有GSH的亲水性CuInS2/ZnS QDs,最终实现其从有机相向水相的转移,转化过程如图4所示。但是,遗憾的是,经过两次配体转化,CuInS2/ZnS QDs的PLQY从最初的70%降至34%。由此可见,虽然可以通过上述配体交换法,制备水溶性CuInS2QDs,但是在配体转化过程中,原有QDs PLQY会被大大降低,进而影响其发光效率,降低材料的应用价值。因此,如何在实现高性能油溶性CuInS2QDs向水溶性转变的同时,还能保留其原有的高发光特性是研究者们继续努力的目标。

图4 水溶性CuInS2/ZnS QDs表面配体交换过程(a、b、c)乳腺肿瘤细胞成像Fig 4 Ligand exchange process on the surface of water-soluble CuInS2/ZnS QDs, (a, b,c) imaging in MCF10CA1a breast tumor cells
第二种方法是胶束法。例如,Deng等[64]在230 ℃下用油胺为稳定剂合成了油溶性的CuInS2/ZnS QDs,随后将合成的N-琥珀酰N'-辛基壳聚糖胶束(FA-SOC)接枝在CuInS2/ZnS QDs表面,合成了表面含有大量亲水基团的水溶性CuInS2QDs,修饰后的QDs保留了初始CuInS2/ZnS QDs的形貌、晶体结构和发光特性。最后,Deng又在其表面键合大量叶酸分子,制备出具有靶向功能的量子点CuInS2/ZnS-FA-SOC,以其作为高效荧光显影剂,有效应用于体内和体外荧光成像。
第三种方法是聚合物表面修饰。聚合物具有机械性能良好、质量轻、物理化学性质稳定、易于加工成型等优点,是对QDs表面进行修饰的优良材料。 被聚合物修饰后的QDs,一方面可以通过聚合物分子链之间的排斥作用有效防止QDs之间的团聚,另一方面通过聚合物优异的加工性能,制备成各种尺寸器件,在太阳能电池、生物探针等领域有着良好的应用前景[65-66]。在已报道的文献中,CuInS2QDs表面的聚合物修饰方式主要有两种,一种是通过疏水或者静电等弱作用力,将QDs材料分散在聚合物的基体之中,这种方法叫做共混法;另一种方法是通过化学反应用强的共价键将QDs与聚合物紧密结合在一起,这种方法叫做键合法。最初因共混法操作简便而备受青睐,但制备出的材料尺寸分布不均一,且表面易团聚的问题使材料在实际应用中完全或部分丧失其特有的价值。与之相比,键合法制备的材料尺寸均一且表面粘合度较高,是目前聚合物接枝修饰QDs的主要方法[67]。其中,当QDs被用于生物成像或生物诊断等生命学科时,选取的基体材料是具备生物相容性及水溶性的聚合物,如聚乳酸(PLA)[68]、聚丙烯酸(PAA)[69]、聚乙二醇(PEG)[70]等。例如, 2017年,Yang等[71]在合成的CuInS2/ZnS QDs表面通过键合法将二乙烯三胺五乙酸(DTDTPA)沉积到CuInS2/ZnS QDs表面,然后再将Gd3+螯合,制备出CuInS2/ZnS共轭钆复合物(CuInS2/ZnS QDs@DTDTPA-Gd),用于近红外荧光和t1加权MR双峰成像(图5)。

图5 CuInS2/ZnS QDs @DTDTPA-Gd的制备 Fig 5 Preparation of CuInS2/ZnS QDs @DTDTPA-Gd
上述三种方法相比,第一种配体交换法能够有效保证QDs的小尺寸和良好的分散性,更有利于生物荧光成像。但是,配体交换过程仍需在有机相中进行,反应温度较高,操作难度大,同时交换后PLQY有一定程度的损失。而后两种方法会增大QDs的尺寸影响其生物应用效果。
2 CuInS2三元QDs在生物领域的应用
近年来,由于CuInS2QDs优良的发光特性、强的光稳定性和良好的抗光漂白性能,更因为其表现出的低毒环保特性,其已被视为理想的绿色光学材料而被广泛应用于生物领域,尤其是在生物分子检测和细胞成像方面展现了巨大的应用潜力。
2.1 生物体系中对离子及分子检测应用
CuInS2QDs的荧光性质具有随着某种外界环境或外界物质含量改变而变化的特性,因此,可通过对某种生物分子的敏感响应性能进行定量分析和检测。而与其它传统的生物荧光分子探针相比,CuInS2QDs具有连续激光光谱宽、对称发射光谱窄、光化学稳定性高和发光颜色可控等优势。更重要的是,其低的生物毒性和生物相容性使CuInS2QDs更有利于在生物体中应用。
例如,苏星光课题组[72]采用MPA为稳定剂使用一步水热法合成发射波长在670 nm的CuInS2QDs,并通过一系列表面功能化修饰,实现对溶菌酶、多巴胺分子、磷酸酶、2,4,6-三硝基苯酚等多分子的检测。在检测溶菌酶时,因为聚二甲基二烯丙基氯化铵(PDAD)可以使CuInS2QDs的荧光猝灭,而溶菌酶分子易于通过静电作用与PDAD结合而使荧光恢复,从而起到有效检测溶菌酶的作用,其检出限可达到6 nmol/L。其次,还可利用CuInS2QDs表面的3-氨基苯硼酸与多巴胺分子反应生成硼酯键,引起QDs荧光淬灭,从而实现对生物分子多巴胺的有效检测,该方法的检出限可低至0.02 μmol/L。同时,由于双氰胺可以与2,3-丁二酮反应生成具有邻位二羟基结构的环化产物,该物质可以与3-氨基苯硼酸反应生成硼酯键,引起QDs荧光淬灭,可以对牛奶中的双氰胺进行定量检测,检出限为0.6 μmol/L。此外,表面经色氨酸修饰后的CuInS2QDs,可与碱性磷酸酶发生去磷酸化作用,从而实现对癌症肿瘤标志物碱性磷酸酶的检测,其检出限可达到3.6 nU/mL。最后,表面经牛血清蛋白修饰后的CuInS2QDs可与2,4,6-三硝基苯酚(TNP)发生相互作用,从而建立了一种检测2,4,6-三硝基苯酚的有效方法,其检出限可达到 28 nmol/L。
Liu等[73]采用一锅水热法将氨基酸L-半胱氨酸(cys)接枝修饰于CuInS2QDs表面,合成了平均粒径为3.3 nm,尺寸均一,
荧光稳定,发射波长在656 nm的Cys-CuInS2QDs。当在其水溶液中加入Cu2+后,由于Cys-CuInS2QDs表面半胱氨酸的胺基与Cu2+之间的发生电子转移,导致Cys-CuInS2QDs表面无辐射e-/h+发生了重组,从而造成Cys-CuInS2QDs的荧光发生猝灭,如图6所示。此外,Liu利用β-葡萄糖苷酶(β-Glu)降解生氰苷Amy,使其转化为游离CN-,再基于CN-与Cu2+的结合作用,干扰Cys-CuInS2QDs与Cu2+之间的电子转移过程,从而使荧光得以恢复,以此建立一种简便且可逆的检测β-Glu的荧光方法。另一方面,在β-Glu抑制剂的存在下,β-Glu活性被抑制,系统荧光将再次保持“熄灭”状态。因此,Cys-CuInS2QDs也可被用于对β-Glu抑制剂的筛选。图6为“开关型”荧光纳米颗粒探针用于β-Glu测定及其抑制剂筛选的示意图。

图6 “开关型”荧光纳米颗粒用于β-Glu测定和制剂筛选的示意图Fig 6 Schematic diagram of fluorescent “on-off” nanoprobe for β-Glu determination and inhibitor screening
此外,Liu等[74]研究对比了18种氨基酸对CuInS2/ZnS QDs的修饰效果,发现半胱氨酸(Cys)与苏氨酸(Thr)协同修饰后所得CuInS2/ZnS QDs的PLQY最佳。该QDs平均粒径为4.8 nm, 发射波长为710 nm,位于近红外区。随后他们系统研究该CuInS2/ZnS QDs对Cd2+的荧光响应效果和机理。研究结果表明,随着CuInS2/ZnS QDs溶液中Cd2+浓度的不断增大,体系荧光出现明显的增强现象,且Cd2+的浓度于荧光强度呈现出良好的线性关系。机理研究进一步表明,由Cys和Thr修饰的CuInS2/ZnS QDs外层的Zn2+可与Cd2+发生阳离子交换而被取代,而表面形成的CdS由于减少了电子-空穴相互作用,导致荧光强度显著增强,从而实现对Cd2+的灵敏检测,其检出限可达到7.8 nmol/L。此外,Liu等进一步研究了CuInS2/ZnS QDs在A549肺癌细胞中对Cd2的检测情况及多色成像的效果,如图7所示。CuInS2/ZnS QDs在710 nm处发射红色荧光,随着体系中Cd2+的浓度增加荧光增强,从而到达了在细胞中有效检测Cd2+的效果。

图7 半胱氨酸和苏氨酸协同修饰CuInS2/ZnS QDs的合成及其在Cd2 +定量和多色成像中的应用Fig 7 Synthesis of Cys- and Thr- Capped CuInS2/ZnS QDs and their applications in Cd2+ quantification and multicolor imaging
2019年,Li等[75]首先合成一种发射峰位于638 nm附近(红色荧光),PLQY高达28.6 %的CuInS2/ZnS QDs,然后用配体谷胱甘肽(GSH)对其进行修饰,以增强其水溶性,修饰后的QDs发射峰蓝移至520 nm附近 (绿色荧光)。接着将Ce3+偶联于该QDs表面,产生荧光猝灭效应。再通过ATP与金属离子Ce3+较强的结合能力,将QDs表面的Ce3+解离出来,恢复QD原有荧光强度。因此,可通过这种简便的阳离子交换策略,实现对生物分子ATP的灵敏检测,示意图如图8所示。最后,他们将Ce3+偶联的CuInS2/ZnS QDs与人胚胎成纤维细胞(HELF)和肿瘤Hela细胞共孵育,通过在共聚焦显微镜观察荧光强弱变化情况。研究结果表明,由于正常细胞HELF中ATP含量较低,QDs与HELF共孵育后,在细胞成像过程中没有获得强荧光信号。但是,由于在肿瘤细胞中ATP含量较高,通过与QDs表面Ce3+的偶联作用,使荧光增强,从而在Hela细胞中观察到较强的荧光信号。此外,Ca2+可以激活线粒体中脱氢酶以促进ATP的产生。在用Ca2+处理过的Hela细胞中,由于ATP含量增高,在细胞成像中获得最强的荧光信号, 因此,该研究为监测癌细中ATP水平提供了一种有效方法和荧光探针材料。

图8 (a) 探针CuInS2/ZnS QDs的制备、(c、d、e)不同浓度的Ce3+、ATP的荧光图以及校准曲线、(b)正常细胞和癌细胞中的成像对比Fig 8 (a) Preparation of CuInS2/ZnS QDs Probe, (c, d,e) fluorescence graphs and calibration curves of Ce3+ and ATP at different concentrations, (b) imaging contrast of HELF cells and Hela cells
综上所述,各种各样表面功能化的CuInS2QDs在生物检测领域已取得了一定的效果,但是目前仍然面临一些问题,例如:与其它荧光生物探针相比,水溶性CuInS2QDs具有发光效率较低,检出限较高等缺陷。研究者们还需要通过各种方法来解决这个长期的问题,从而提高CuInS2QDs作为荧光探针在生物检测中的应用价值。
2.2 生物成像应用
迄今为止,大量研究表明,QDs可以通过与生物大分子偶联而融入到细胞体内,实现对活细胞、蛋白质和DNA等生命物质进行长时间的荧光标记,使得QDs在临床诊断和药物筛选等领域表现出巨大的应用前景。但是,传统含重金属Cd2+的QDs由于具有高的生物毒性,限制了其在生物医学邻域的广泛应用。相比之下,CuInS2QDs的生物毒性较低,荧光寿命长,且发光颜色可覆盖部分近红外区,有利于穿透组织层进行深组织成像,同时可大大降低生物组织由于自发荧光而产生的干扰。因此,相比于其它类型的荧光探针材料,CuInS2QDs在生物成像(体内和体外)应用方面具有独特的优势和巨大的潜力。
2.2.1 体外成像应用
近年来,由于具有近红外(NIR)发光性能的CuInS2QDs表现出优异的光稳定性、高的荧光效率、深的组织穿透能力和低的生物毒性等优势,已被广泛应用于近红外荧光成像领域。例如,Su等[76]首先以CuCl2和InCl3为金属前体,CS(NH2)2为硫源,MPA为配体,在150 ℃、pH=11的条件下反应21 h制备水溶性的CuInS2QDs,然后将即具有载药能力又具有靶向能力的跨膜分子MUC1-(CGA)7适体键合于CuInS2QDs表面,最后将抗癌药物DNR(柔红霉素)修饰到CuInS2QDs表面,实现了对PC3M cells(人前列腺癌细胞)和HepG2 cells(肝癌细胞)的诊疗一体(图9)。
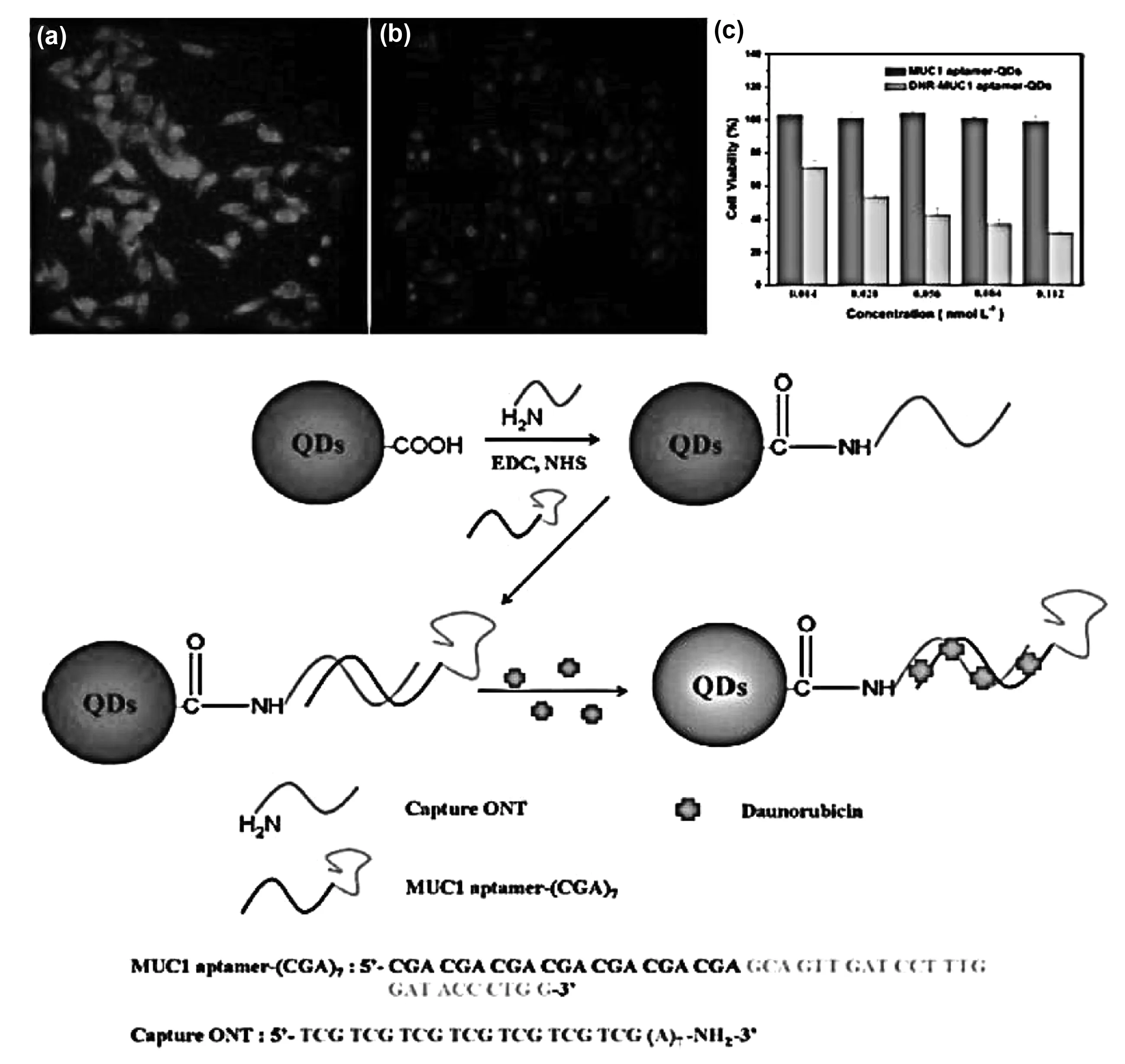
图9 DNR-MUC1-CuInS2 QDs的制备、(A)前列腺细胞成像、(B)肝癌细胞成像、(C)细胞存活率Fig 9 Preparation of DNR-MUC1-CuInS2 QDs, (A) imaging in PC3M cells, (B) imaging in HepG2 cells, (C) Cell viability
Hu等[77]首先以CuCl2、InCl3·4H2O和Zn(Ac)2为金属前体,Na2S为硫源,MPA为配体合成CuInS2/ZnS QDs,然后采用“微流控芯片法”将变性的牛血清蛋白(dBSA)修饰在CuInS2/ZnS QDs表面,合成了生物相容性良好的dBSA-CuInS2/ZnS QDs,其发射波长位于近红外范围内,且可通过调整反应条件使其波长从650 nm红移至750 nm。此外,dBSA-CuInS2/ZnS QDs呈现较长的荧光寿命(153.66 ns)。为了进一步的探究dBSA-CuInS2/ZnS QDs在生物成像中的适用性,该课题组将具有靶向功能的叶酸分子和透明质酸修饰在dBSA-CuInS2/ZnS QDs表面,研究其对巨噬细胞(RAW264.7 cells)、肝癌细胞(HepG2 cells)和胰腺癌细胞(Panc-1 cells)的细胞毒性和成像效果。结果表明,dBSA-CuInS2/ZnS QDs具有较低的细胞毒性和对肿瘤细胞良好的靶向成像功能。这种基于“一步式”的合成方法提供了一种快速、简便且廉价的三元QDs纳米晶体合成方式(图10)。

图10 (a) dBSA-CuInS2/ZnS QDs的制备、(b)巨噬细胞成像、(c)肝癌细胞成像、(d)胰腺癌细胞成像Fig 10 (a) Preparation of dBSA-CuInS2/ZnS QDs, (b) imaging of RAW264.7 cells, (c) imaging of HepG2 cells, (d) imaging of Panc-1 cells
最近,Chen等[78]基于水溶性聚合物PEG合成一种具有良好生物相容性的新型PEG-CuInS2/ZnS QDs,并系统研究该三元QDs的毒理学特征,尤其是免疫毒性。他们使用DC2.4细胞系(小鼠骨髓树突状细胞)对PEG-CuInS2/ZnS QDs进行了体外细胞毒性研究,同时进行了BALB/c小鼠(常见实验小鼠)的体内免疫毒性测试。体外细胞实验表明,PEG-CuInS2/ZnS QDs被DC2.4细胞吸收后可促进细胞活力,并增强肿瘤坏死因子-α的释放,从而刺激脂多糖降低白介素6(IL-6)的水平(白介素6是炎症早期的敏感性物质)。小鼠体内研究表明,PEG-CuInS2/ZnS QDs进入小鼠体内一天后即增加了白介素4(IL-4)(白介素4是过敏性和自身免疫性疾病的发病中起重要的作用)的水平,并在第28 d增强了白介素10(IL-10) (白介素10是炎症与免疫抑制因子)和白介素13(IL-13) (白介素13是炎症与免疫抑制因子)的水平。治疗1与28 d相比,脾脏淋巴细胞的数量、器官指标、血液学和免疫器官组织无明显差异,表明PEG-CuInS2/ZnS QDs在生物体内和体外都具有较低的毒性和很高的生物相容性,具有较高的生物应用潜力。PEG-CuInS2/ZnS QDs 对DC2.4细胞活力和细胞因子产生的体外影响如图11所示。

图11 PEG-CuInS2/ZnS QDs 对DC2.4细胞活力和细胞因子产生的体外影响Fig 11 In vitro effects of CuInS2/ZnS QDs on viability and cytokine production of DC2.4 cells
综上所述,由于各种功能化的CuInS2QDs所发射的近红外荧光具有优异的组织穿透能力和较低的背景荧光,且在细胞成像中表现出优异的荧光性质和较好的生物相容性,已被用于生物医学诊断和治疗中,具有相对比较成熟的发展。
2.2.2 体内成像
相比于生物体外荧光成像,活体荧光成像能够实现将分子成像技术从体外转移到动物体内,能够更准确观测活体动物内的基因表达和细胞活动,由此提供有关治疗或疾病进展的生物学效应的最完整信息,对医学及生物学研究意义重大。
实现体内生物荧光成像的关键是高性能荧光探针的使用。为了满足生物体内应用要求,荧光探针材料必须具备以下几点特性:(1) 强的亲水性;(2) 低的生物毒性;(3)优异的生物相容性;(4)在生理pH条件下和在水中保持结构和荧光稳定性;(5)具有靶向功能,易于与生物标记物结合。因而,体外应用所报道的部分荧光探针,例如镉基QDs材料,是无法满足体内成像要求的。相比之下,亲水性CuInS2QDs是一种高效发光的无毒半导体纳米材料,具有在可见光和近红外可调、光稳定性好、荧光效率高、组织穿透深、毒性低等优点,已被广泛应用于生物体内近红外荧光成像中。例如,Zhu等[79]用碘化亚铜、乙酸铟和生物分子核糖核酸酶A(RNAse-A)制备了水溶性的A-CuInS2QDs。该A-CuInS2QDs在小鼠成骨细胞(MC3T3-E1 cells)有良好的成像效果。为了进一步证实该A-CuInS2QDs在体内的成像应用效果,该课题组进一步将A-CuInS2QDs注射到小鼠体内,通过体内示踪和体外成像技术在小鼠胃部监测到强的荧光信号,组片分析结果表明,该A-CuInS2QDs未使小鼠组织产生毒性效应,且具有良好的体内成像性能、强的组织穿透性和优异的光稳定性。
最近,Rama S. Verma等[80]首先用CuI、In(Ac)3和硬酯酸锌(Zn(St)2)为金属前体,1-十二烷硫醇(1-DDT)为配体在230 ℃下采用微波辅助法合成了油溶性的CuInS2/ZnS QDs,其PLQY高达76%。然后通过表面配体交换的方式将11-巯基十二酸(MUA)接枝修饰在CuInS2/ZnS QDs表面,大大增加了CuInS2/ZnS QDs的水溶性。最后,他们又在该QDs表面键合大量叶酸分子,制备出具有靶向功能的量子点FA-MUA-CuInS2/ZnS QDs。细胞实验结果表明FA-MUA-CuInS2/ZnS QDs对人卵巢畸胎瘤细胞(PA1 cells)表现出显著的生物相容性,与商用荧光染料Hoechst相比具有更高的标记稳定性和更强的光稳定性。为了进一步证FA-MUA-CuInS2/ZnS QDs在体内的成像效果,他们将B16F10(小鼠黑色素瘤细胞)选为小鼠体内的肿瘤细胞系,进行小鼠体内荧光成像实验。测试结果表明,FA-MUA-CuInS2/ZnS QDs在2 h内具有较高的叶酸受体阳性肿瘤靶向能力。此外,FA-MUA-CuInS2/ZnS QDs可以深层穿透小鼠皮下黑色素瘤中且均匀分布。通过组织切片和血液学分析证明FA-MUA-CuInS2/ZnS QDs在小鼠主要的器官和血液中未产生毒性效应,如图12所示。该工作为CuInS2QDs在生物体内靶向成像和示踪提供了新思路和方法。

图12 第一步:MUA-CuInS2/ZnS QDs的制备、第二步:FA-MUA-CuInS2/ZnS QDs的制备、第三步:生物体内和体外的靶向成像Fig 12 Step 1: preparation of MUA-CuInS2/ZnS, Step2: preparation of FA-MUA-CuInS2/ZnS QDs, Step3: targeted imaging in vivo and in vitro
目前,基于干细胞的修复和再生疗法是当今生物技术与医学行业最热门的领域之一,而全面了解活体模型被移植干细胞的迁移,植入和再生能力对该领域的发展尤为重要。最近,Chetty等[81]利用所合成的NIR MSCs-CuInS2/ZnS QDs来标记脐带间充质干细胞(MSCs),标记效率达98%。他们首先采用微波辅助法在6 min内制备了以1-十二烷硫醇(1-DDT)为配体的 DDT-CuInS2/ZnS QDs,通过表面配体交换的方式将MUA接枝修饰在CuInS2/ZnS QDs表面,以增强CuInS2/ZnS QDs的水溶性。然后再在QDs表面标记MSCs,提高QDs的生物相容性。体内荧光跟踪实验表明,在患有肝损伤的小鼠尾静脉注射MSCs-CuInS2/ZnS QDs后,经2 h QDs逐渐聚集在受伤的肝脏中。同时,MSCs-CuInS2/ZnS QDs的再生潜力是通过肝细胞周围的门静脉,胆管和肝动脉组成的门道来确认的。经过激光扫描共聚焦显微镜以及组织病理学和血液学分析证实,MSCs-CuInS2/ZnS QDs移植后3天未观察到明显的炎症、坏死或者凋亡。MUA-CuInS2/ZnS QDs的制备及其在生物体内和体外的成像潜能如图13所示。该研究提出了一种可在急性肝损伤动物模型中无创跟踪移植脐带间充质干细胞(MSCs)的方法,为未来的图像引导细胞疗法提高了新思路。
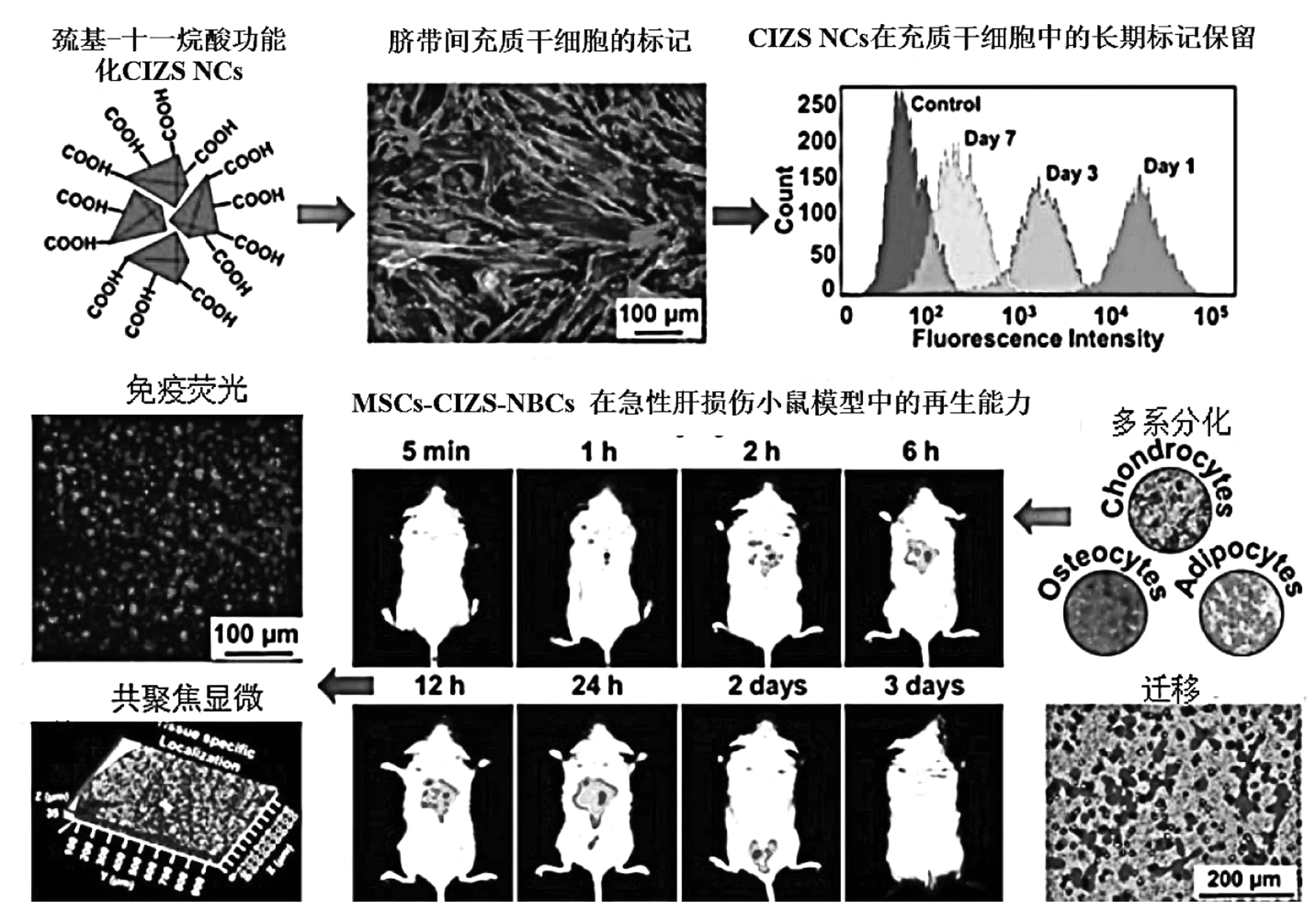
图13 MUA-CuInS2/ZnS QDs的制备及其生物体内和体外的靶向成像Fig 13 Preparation of MUA-CuInS2/ZnS QDs and targeted imaging in vivo and in vitro
CuInS2QDs因其优异的荧光性质而被越来越多的应用于生物体内成像,但CuInS2QDs在基于荧光/光声成像技术的多合一治疗肿瘤方面的应用报道较少。Liang等[82]首先合成一种核壳结构CuInS2/ZnS QDs,然后将一种亲水性大分子药物胶束mPEG2000-DSPE接枝于量子点表面,形成富含药物的大尺寸纳米粒子CuInS2/ZnS NMs-80和小尺寸纳米粒子CuInS2/ZnS NMs-25。最后将两种 QDs与小鼠乳腺癌细胞4T1 cells共孵育,探究其体外光疗功效和细胞毒性,证实该QDs材料低的细胞毒性和良好的光疗功效。接着,Liang等探究了CuInS2/ZnS NMs QDs在小鼠体内MOST成像(显微光学切片断层成像)以及PTT / PDT协同治疗效果。他们先将乳腺癌细胞注入小鼠尾静脉使其在小鼠体内形成肿瘤,随后再注入CuInS2/ZnS NMs QDs,使其同时充当“间谍卫星”和“精密武器”的作用,在精确诊断的同时有效消除肿瘤。MOST成像结果表明,CuInS2/ZnS NMs QDs能够清晰的显示小鼠体内肿瘤大小,且CuInS2/ZnS NMs-25比CuInS2/ZnS NMs-80具有更长的肿瘤保留时间、更高的肿瘤吸收率和更深的肿瘤穿透力。此外,该课题组还深入研究了CuInS2/ZnS NMs QDs光诱导肿瘤消融的能力,证实在660 nm的单激光照射下,CuInS2/ZnS NMs QDs可以同时提供光热和光动力效应,从而产生了有效的协同光疗功效。因此,CuInS2/ZnS NMs QDs作为多功能纳米药物不仅具有很高的治疗功效,且可通过成像技术无创检测肿瘤部位的分布情况,具有作为一种精确治疗癌症纳米药物的巨大潜力。图14是CuInS2/ZnS NMs在荧光/光声成像技术的“多合一”治疗肿瘤方面的应用示意图。

图14 CuInS2/ZnS NMs用作治疗肿瘤纳米药物Fig 14 CuInS2/ZnS NMs are used as nanomedicine for the treatment of tumors Phototherapy
综上所述,CuInS2QDs因其优异的发光性能和近红外荧光强大的组织穿透力优势,在生物体内示踪、诊断和治疗等方面发挥越来越重要的作用,渐渐成为生物成像及医学诊疗的明星材料。
3 结 语
综上所述,QDs因其特殊的光、电、磁学性质而受到了广泛的关注和应用。其中CuInS2三元QDs因其不含毒重金属元素且荧光性质稳定,被视为一种绿色无毒的环保型纳米光学材料,在生物医学领域被广泛应用。一方面,基于CuInS2QDs荧光对某种特定生物分子的高灵敏响应性,而被广泛应用于生物分子的定量分析检测中。另一方面,基于CuInS2QDs荧光大的斯托克斯位移,长的荧光寿命以及近红外发射带来强的组织穿透能力,在生物成像(体内和体外)领域备受关注,并发挥越来越重要的作用。
迄今为止,虽然研究者们已在CuInS2QDs的生物功能化修饰和应用方面做出了很大的努力,也取得了较为理想的成果,但是要满足生物医学应用要求,还有很长的路要走。例如,目前在提高水溶性CuInS2QDs的PLQY以及更深层次的医学应用研究远远不够,尤其是在生物分子定量检测和生物成像时,如何在实现优异水溶性的同时保留材料原有高的发光效率等。因此, 如何通过水相合成法或在油溶性CuInS2QDs表面有效进行功能化修饰以提高水溶性和生物相容性,最终制备出高荧光效率及发光覆盖近红外区域水溶性CuInS2QDs仍面临着巨大的挑战。

