南瓜果胶脱蛋白工艺及抗氧化活性研究
李晓娟,唐彦武,李柱刚,王珣*,赵曦,冷春旭,陆杰
(1.黑龙江省农业科学院生物技术研究所,哈尔滨 150028;2.黑龙江大学 生命科学学院,哈尔滨 150080;3.黑龙江省农业科学院耕作栽培研究所,哈尔滨 150028;4.黑龙江省农业科学院齐齐哈尔分院,黑龙江 齐齐哈尔 161006;5.黑龙江省南瓜育种与深加工工程技术研究中心,哈尔滨 150028)
果胶是一类存在于多种植物中的多聚糖类化合物,D-半乳糖醛酸为其主要组成部分[1-2]。果胶绿色天然、无毒环保的特点使其在食品领域中的应用日趋普遍[3-4]。果胶是一种常见的食品添加剂,主要功能是作为乳化剂、稳定剂、凝胶剂和增稠剂等改善食品和调味制品的外观、组织、口感以及生物利用度等[5-7]。果胶在日常饮食中随处可见,在调味制品(果酱、酱料等)、烘焙产品(面包、糕点等)、饮品(酸奶、乳酸饮料等)和休闲食品(果冻、软糖等)中都有广泛的应用[8]。有学者从甜菜、柠檬、山竹、柑橘、木瓜等植物残渣中提取果胶,但随着果胶在食品领域的需求增加,尚需要从国外进口[9-13]。籽用南瓜果肉资源,在取食南瓜籽后常作为饲料或被废弃,可作为开发新型果胶的原料[14-17]。研究证实,南瓜果胶具有明显的抗氧化,吸附重金属保护细胞等功效[18]。
目前果胶的提取方法很多,但果胶提取中往往伴随蛋白质等杂质,蛋白质的存在不仅影响果胶的纯度和结构,甚至可能影响果胶的生物活性,因而蛋白质的脱除是果胶纯化的关键步骤[19-22]。目前常用的脱蛋白工艺有Sevag法、TCA法、酶法和盐析法等,与单一方法相比,联合工艺效果更好[23],课题组前期通过比较Sevag法和TCA法,确定TCA法更适合南瓜果胶脱蛋白。综上所述,本文以籽用南瓜果肉为原料,分离南瓜粗果胶,将酶法与TCA法相结合的ETCA法应用于粗果胶脱蛋白工艺的研究,并对脱蛋白前后果胶样品的抗氧化活性进行检测,考察南瓜果胶作为食品添加剂的可行性,为南瓜果胶功能食品的研发提供了基础数据。
1 材料与方法
1.1 材料与试剂
南瓜品种为“金龙瓜1号”:2018年10月采自黑龙江省农业科学院畜牧所园区,采收后运回实验室当天处理;所用试剂均为分析纯。
1.2 方法
1.2.1 南瓜粗果胶的分离
南瓜去籽、洗净、切块,灭酶,烘干破碎,得到南瓜粉(60目)。精确称取适量南瓜粉,按1∶30(m/V)加入蒸馏水,放入超声仪中,80 ℃提取1 h。将提取液真空浓缩至原来的1∶4(V/V),温度降至常温后,放入4倍体积95%乙醇,过滤所得固形物冷冻干燥待测。
1.2.2 果胶脱蛋白率测定[24]
以考马斯亮蓝G-250为染料液,预制浓度为0.1 mg/mL的牛血清白蛋白(BSA)母液,分别取0.1,0.2,0.4,0.6,0.8,1.0 mL母液放入具塞试管中,加水定容1 mL,分别放入定容后5倍体积染料液,摇匀后,反应5 min。以蒸馏水作为空白对照,测定595 nm处各样品的吸光度。y=0.006821x+0.03308,R2=0.9972(y为吸光值,x为BSA含量)。
取一定浓度样品溶液1 mL,替代BSA,后续按上述方法进行,计算蛋白质含量。
果胶脱蛋白率按公式(1)计算:
脱蛋白率/%=(C前-C后)/C前×100。
公式(1)
式中:C前为脱蛋白前蛋白含量(μg/mL);C后为脱蛋白后蛋白含量(μg/mL)。
1.2.3 果胶留存率测定[25]
将0.1 mg/mL半乳糖醛酸标准液配制成浓度为10,20,30,40,50,60,70,80 μg/mL的梯度标准液,加入6 mL浓硫酸,缓慢振荡,静置电热恒温水槽中90 ℃,15 min,反应结束后冷却至室温。加入1.5 mg/mL咔唑无水乙醇0.2 mL,混合均匀,避光反应2 h。以1 mL蒸馏水替代标准液作为空白,按相同步骤操作,检测530 nm波长下各样品的吸光值。y=0.006963x+0.003286,R2=0.9983(y为吸光值,x为半乳糖醛酸含量)。
取一定浓度样品1 mL,替代半乳糖醛酸,后续按上述方法进行,计算半乳糖醛酸含量。
果胶留存率按公式(2)计算:
果胶留存率/%=M后/M前×100。
公式(2)
式中:M前为脱蛋白前果胶含量(μg/mL);M后为脱蛋白后果胶含量(μg/mL)。
1.2.4 单因素试验
1.2.4.1 酶用量
精确量取40 mg/mL南瓜果胶样液40 mL,分别加入0.1%、0.3%、0.5%、0.7%、0.9%(W/V)的木瓜蛋白酶,将样品置于50 ℃电热恒温水槽2 h,再于100 ℃ 10 min使酶失活,待样品温度下降至常温,加4% TCA 20 mL,混匀,剧烈振荡30 min后静置,20 min后离心(4000 r/min,10 min),取出上层溶液稀释至一定浓度后,检测果胶和蛋白质含量,计算果胶脱蛋白率和留存率,试验重复3次。
1.2.4.2 酶解温度
精确量取40 mg/mL南瓜果胶样液40 mL,加入0.5%(W/V)的酶,分别置于35,40,45,50,55 ℃电热水槽2 h,此后沸水灭酶10 min,待反应液温度下降至常温,加入4% TCA 20 mL,强力振荡30 min,放置20 min离心(4000 r/min,10 min),取出上层溶液稀释至一定浓度后,以硫酸咔唑法检测果胶含量,Bradford法检测蛋白质含量,计算果胶脱蛋白率和留存率,试验重复3次。
1.2.4.3 酶解时间
精确量取40 mg/mL南瓜果胶样液40 mL,加入0.5%(W/V)的酶,置于50 ℃电热恒温水槽0.5,1,1.5,2,2.5 h,此后沸水灭酶10 min,待样品温度下降至常温,加入4% TCA溶液 20 mL,强力振荡30 min,放置20 min离心(4000 r/min,10 min),取出上层溶液稀释至一定浓度后,检测果胶和蛋白质含量,计算果胶脱蛋白率和留存率,试验重复3次。
1.2.5 正交试验设计
选取酶用量、酶解温度和酶解时间3个变量,结合1.2.4的试验结果,设计L9(34)试验优化ETCA法,采用综合加权平均法进行评分,其因素水平设计见表1。

表1 正交试验因素水平表Table 1 The factors and levels of orthogonal test
1.2.6 透析
将脱蛋白后样品装入预先处理好的透析袋内,先后采用流水和蒸馏水透析48 h和24 h,期间换3次蒸馏水。取出透析果胶溶液,浓缩至1/4体积,待温度降至常温,放入4倍量无水乙醇并不断搅拌,放置1 h,过滤,45 ℃烘干,获得脱蛋白南瓜果胶样品。
1.2.7 羟基自由基(·OH)清除能力测定[26]
不同浓度0.625,1.25,2.5,5,10,20 mg/mL脱蛋白前后南瓜果胶液各取1 mL,依次分别加入9 mmol/L水杨酸-乙醇溶液1 mL、9 mmol/L FeSO4溶液1 mL、8.8 mmol/L H2O2溶液1 mL,混匀。放入37 ℃电热恒温水槽中水浴15 min,取出,冷却至室温。以VC作为阳性对照,检测510 nm波长处各溶液的吸光度,试验重复3次。清除率计算公式如下:
羟自由基清除率/%=[A空白-(A样品-A对照)]/A空白×100。
公式(3)
式中:A空白为空白对照吸光值,A样品为样品吸光值,A对照为不加显色剂H2O2。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶用量对脱蛋白作用的影响
采用ETCA法对南瓜果胶脱蛋白,探讨酶用量(0.1%、0.3%、0.5%、0.7%、0.9%,W/V)对果胶脱蛋白作用的影响。

图1 酶用量对脱蛋白作用的影响Fig.1 The effect of additive amount of enzyme on deproteinization
由图1可知,伴随酶用量的增多,脱蛋白率快速上升而后趋于平稳。原因可能是当酶用量在0.1%~0.5%时,底物与木瓜蛋白酶接触面积会随酶用量的增多而增长,表现为果胶脱蛋白率快速上升;当酶用量超过0.5%时,蛋白脱除率变化不显著,可能是由于有限的底物限制了木瓜蛋白酶进一步反应。随着酶的增多,果胶留存量持续下降,当酶用量超过0.5%时,果胶含量下降速度由慢变快,可能是由于在大量酶的作用下,蛋白迅速发生水解,某些果胶也改变了构象,与蛋白一同被分离出来。综合考虑果胶留存率和脱蛋白率选择0.4%~0.6%作为正交试验酶用量的水平范围。
2.1.2 酶解温度对脱蛋白作用的影响
采用酶联合三氯乙酸法对南瓜果胶进行脱蛋白,探讨酶解温度(35,40,45,50,55 ℃)对果胶脱蛋白作用的影响。
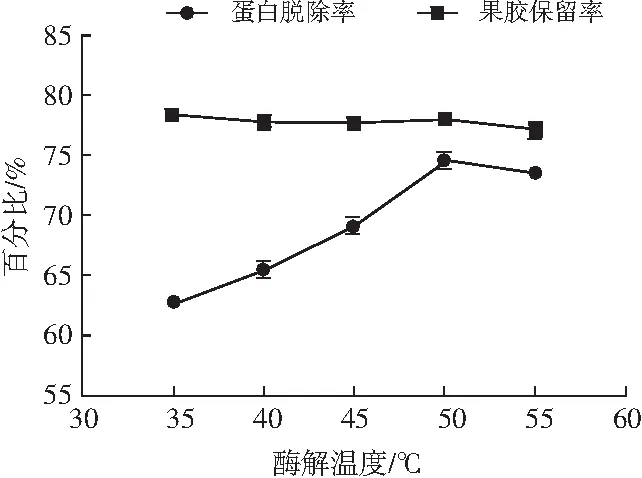
图2 酶解温度对脱蛋白作用的影响Fig.2 The effect of enzymolysis temperature on deproteinization
由图2可知,当温度范围处于35~50 ℃之间,果胶脱蛋白率呈现不断上升趋势,当温度为50 ℃时,果胶脱蛋白效果最好,高出50 ℃后,果胶脱蛋白率稍有下滑趋势,大概与酶作用在最适温度时酶活力达到最大有关,高于最适温度,酶活力开始降低,过高温度会导致木瓜蛋白酶不能充分发挥作用。果胶留存率受酶解温度的影响不大,综合考虑果胶留存率和脱蛋白率,选择45~55 ℃作为正交试验酶解温度的水平范围。
2.1.3 酶解时间对脱蛋白作用的影响
采用ETCA法对南瓜果胶脱蛋白,探讨酶解时间(0.5,1,1.5,2,2.5 h)对果胶脱蛋白作用的影响。
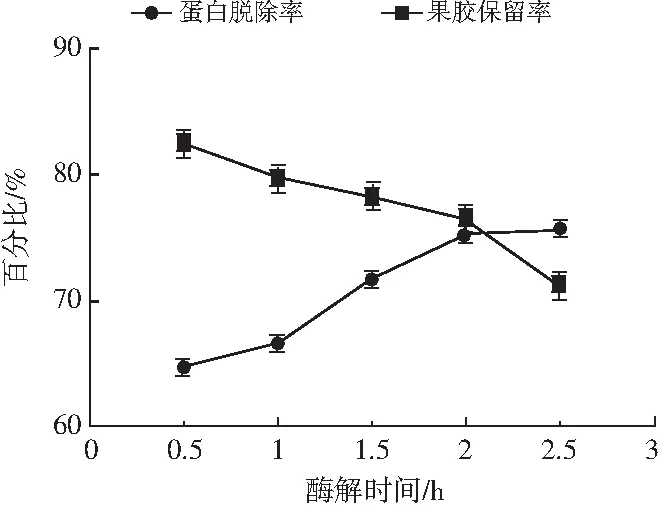
图3 酶解时间对脱蛋白作用的影响Fig.3 The effect of enzymolysis time on deproteinization
由图3可知,在0.5~2 h时,随着时间的增长,果胶脱蛋白率不断增加,果胶留存率缓慢下降。分析原因可能是酶解时间较短时,酶不能与底物充分接触,果胶中蛋白质溶出缓慢。当酶解时间超过2 h时,果胶脱蛋白率基本保持不变,果胶留存率持续降低,可能是由于此时蛋白脱除过程基本完成,进一步延长时间反而导致果胶开始降解,综合考虑果胶留存率和脱蛋白率,选择1.5~2.5 h作为正交试验酶解时间的水平范围。
2.2 正交试验结果
单因素试验结果表明试验中选取的3个因素对果胶脱蛋白都有一定作用。通过1.2.4选取范围进行正交试验以获得果胶脱蛋白最优工艺,以综合评价率为指标,分析脱蛋白作用。
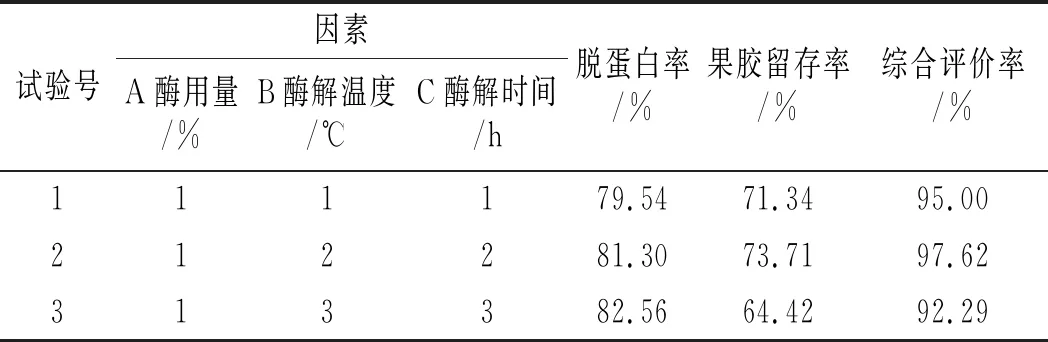
表2 正交试验直观分析表Table 2 The orthogonal experiment intuitive analysis table
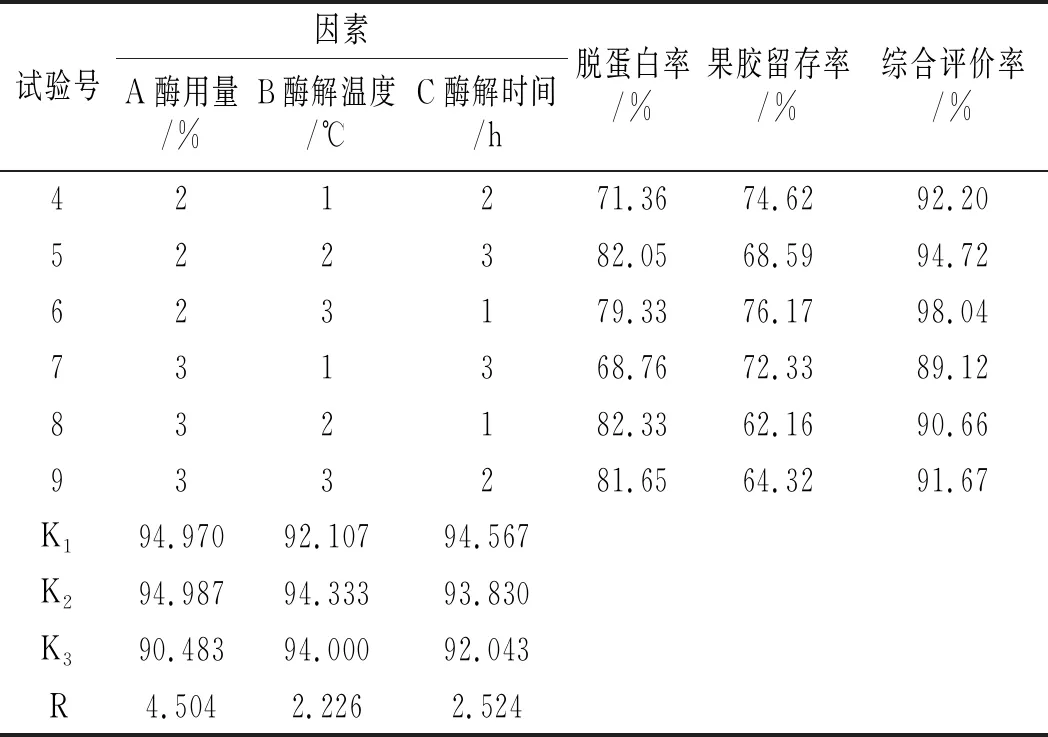
续 表

表3 正交试验方差分析表Table 3 The analysis of variance table of orthogonal test
由表2可知,3个因素中,酶用量的极差(R)最大,酶解温度的极差最小,因而对果胶脱蛋白作用影响从大到小依次是A>C>B。由均值(K)可知,果胶脱蛋白各参数的最优水平为A2B2C1。由表3可知,方差分析结果与直观分析结果相吻合,其中酶用量对果胶脱蛋白所起作用最显著。因此,南瓜果胶的ETCA法脱蛋白最优参数为:酶用量0.5%,酶解温度50 ℃,酶解时间1.5 h。
2.3 验证试验
根据正交试验所得脱蛋白最佳工艺条件,选择ETCA法对南瓜果胶脱蛋白,试验重复3次。
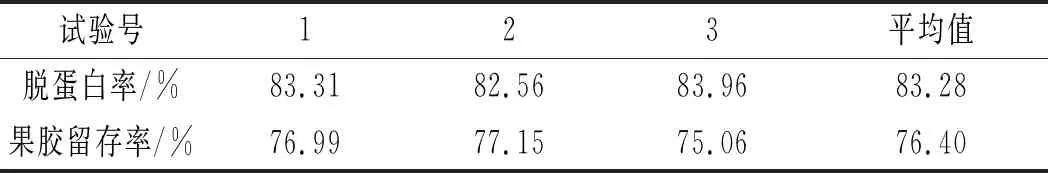
表4 验证试验结果Table 4 The results of verification experiment
由表4可知,脱蛋白率为83.28%,果胶存留率为76.40%,表明ETCA法优化出的南瓜果胶脱蛋白参数可行。
2.4 抗氧化活性结果
羟基自由基(·OH)是最活跃的自由基,差不多所有活细胞中与生命有关的大分子都可以与此自由基产生作用而造成氧化性损伤,使组织细胞病变,进而加速机体的衰老。因此,寻求合适的物质消除这一自由基尤为关键。本试验采用不同浓度(0.625,1.25,2.5,5,10,20 mg/mL)脱蛋白前后南瓜果胶样品溶液作为清除剂,进而评价自由基清除活性。
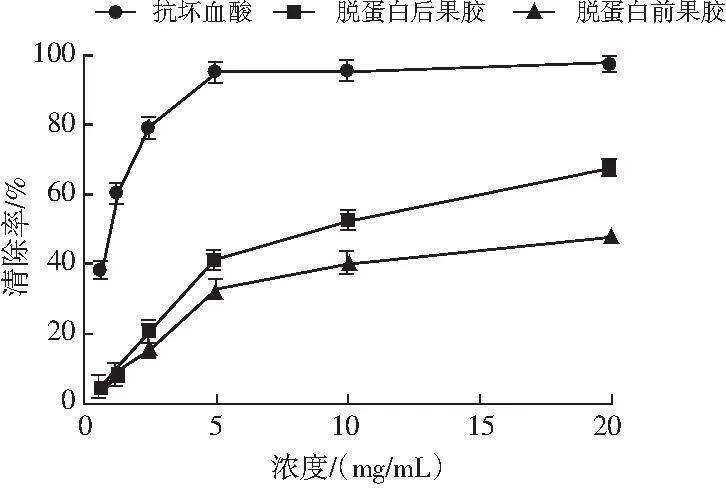
图4 羟基自由基(·OH)试验结果Fig.4 The hydroxyl radical scavenging ability test results
由图4可知,南瓜果胶溶液浓度在一定范围内,随着果胶浓度的增加,对羟基自由基(·OH)的清除作用越来越明显,而后趋于平稳状态,结果显示南瓜果胶有一定的抗氧化作用。相同浓度VC溶液和脱蛋白前后样品清除·OH自由基作用对比结果:VC>脱蛋白后果胶>脱蛋白前果胶。当样品浓度为20 mg/mL时,脱蛋白后样品清除率为67.18%±2.59%,脱蛋白前样品清除率为47.87%±1.91%,脱蛋白后果胶样品抗氧化效果更好。
3 结论
本试验以脱蛋白率和果胶存留率为指标,利用单因素试验方法研究了不同影响因素对ETCA法脱蛋白作用的影响,以综合加权平均法计算综合评价率,运用正交试验并优化了ETCA法的除蛋白过程,验证试验结果表明过程参数切实可行。在一定浓度范围内,羟基自由基清除试验证明南瓜果胶具有良好的抗氧化活性。本研究结果可为南瓜果胶工业开发提供技术支持,从而使南瓜果胶更有效地应用和服务于食品与调味品行业,同时推动南瓜资源的进一步开发利用。

