鸡血藤总黄酮对人乳腺癌细胞株MCF-7增殖凋亡的影响及对Wnt/β-catenin通路的调控作用*
王兰英,孙吉利,苏家茹
青岛市市立医院,山东 青岛 266011
乳腺癌的发病率和死亡率在女性恶性肿瘤中位于首位,全球每年约有40多万人因乳腺癌死亡[1]。我国乳腺癌发病率呈现逐年上升趋势,且发病趋于年轻化[2]。目前对乳腺癌的治疗以手术为主,但乳腺癌细胞通常通过血液和淋巴结迁移扩散至全身,给治疗带来困难[3]。由于肿瘤具有异质性,不同阶段乳腺癌患者对药物选择存在差别,因此,常存在治疗后肿瘤细胞未完全清除的情况,造成治疗失败。此外,肿瘤细胞耐药性也是影响治疗效果的重要因素[4]。因此,研发新的治疗方案,提高乳腺癌治疗效果显得尤为重要。鸡血藤作为我国传统药材,具有补血活血、通络强筋等功效。研究发现,鸡血藤总黄酮具有干扰肿瘤细胞周期、抑制肿瘤细胞转移的作用,但其作用机制未完全明确[5]。Wnt/β-catenin通路对细胞生长发育严格精准调控,但当其过度活化时则会导致肿瘤的生成。已有研究证实,Wnt/β-catenin通路的异常调控可导致肺癌、前列腺癌、直肠癌、肝癌等[6-9]。本实验基于对Wnt/β-catenin通路的调控作用研究鸡血藤总黄酮对人乳腺癌细胞株MCF-7增殖、侵袭、迁移和凋亡的影响。
1 材料
1.1 细胞人乳腺癌细胞株MCF-7(武汉尚恩生物技术有限公司,批号:190351),保存于-80℃冰箱。
1.2 药物与试剂阿霉素(山东西亚化学工业有限公司,纯度≥99.0%,货号:A16278);芦丁(北京中科质检生物技术有限公司,货号:202597)。DMEM培养基、胎牛血清(美国Gibco公司,货号:11054020、16140071);乳酸脱氢酶染色液(四唑盐法)(北京百奥莱博科技有限公司,货号:GL0510);吉姆萨染液试剂盒(北京雷根生物技术有限公司,货号:DM002);RNA提取试剂盒(上海东寰生物科技有限公司,货号:M00501);Trizol、反转录试剂盒[赛默飞世尔科技(中国)有限公司,货号:15596018、K1691];RT-qPCR试剂盒(美国赛默飞公司,货号:AB4105A);蛋白裂解试剂盒(上海江林生物科技有限公司,货号:P1160);Wnt1、β-catenin、Cyclin-D1、c-Myc、MMP-7、β-catenin磷酸化一抗(上海信裕生物科技有限公司,货号:xy-WNTi-Hu、xy-E11315、xy-E10333、xy-1732R、xy-0423R、xy-2063R);β-actin一抗、辣根过氧化物酶(HRP)标记羊抗兔二抗(美国Cell Signaling Technology公司,货号:4967S、7074);TUNEL法试剂盒(德国Merck-Calbiochem公司,货号:G3250);电化学发光(Enhanced Chemiluminescent,ECL)显色试剂盒(北京诺博莱德科技有限公司,货号:P1260);4%多聚甲醛、二甲基亚砜、乙醇(山东西亚化学工业有限公司,货号:B14435、A296671、A10140);MTT粉(上海尚宝生物科技有限公司,货号:T10182);引物合成委托北京睿博兴科生物技术有限公司。
1.3 仪器Herocell 240细胞培养箱(上海润度生物科技有限公司);DNM-9602G酶标仪(北京普朗新技术有限公司);JY300E电泳仪(北京君意东方电泳设备有限公司);Axio Imager2光学显微镜(北京普瑞赛司仪器有限公司);RT-qPCR仪(美国赛默飞公司)。
2 方法
2.1 药物制备鸡血藤总黄酮的提取:取鸡血藤5.0 g,粉碎成粗粉,加入50%乙醇100 mL,加热回流提取2.5 h,重复1次,过滤合并滤液,减压回收乙醇,得到鸡血藤总黄酮;以芦丁为对照品,测得其中鸡血藤总黄酮的含量>80%。
2.2 细胞培养与干预人乳腺癌细胞株MCF-7培养基由10%胎牛血清和90%DMEM培养基配置,细胞培养在5%CO2、37℃恒温细胞培养箱中,当细胞生长至对数期时,按照每孔1×105个细胞加入96孔板中培养,并将其分为5组,阴性对照组、阳性对照组、鸡血藤总黄酮高、中、低剂量组。阳性对照组培养基中加入阿霉素至终浓度为5μmol·L-1,阴性对照组加入等体积的PBS溶液,鸡血藤总黄酮高、中、低剂量组培养基中加入鸡血藤总黄酮使其终浓度分别为80 mg·L-1、40 mg·L-1、20 mg·L-1,培养48 h。
2.3 MCF-7细胞增殖能力检测分别在培养24 h和48 h时,每孔加入5 g·L-1MTT溶液20μL,置于细胞培养箱中继续培养4 h后,弃上清,每孔加入200μL二甲基亚砜,室温避光置于水平摇床上10 min,使用酶标仪读取样品在490 nm处光吸收值,计算增殖抑制率。
增殖抑制率=(1-实验组OD值/阴性对照组OD值)×100%
2.4 MCF-7细胞侵袭能力检测药物干预48 h后,取1×105个·mL-1的MCF-7细胞悬液200μL接种在Transwell小室上室中,小室底部有一层基质胶,小室下加20%胎牛血清和80%DMEM培养基。将MCF-7细胞置于细胞培养箱中培养24 h,擦去上室内的细胞和基质胶,使用吉姆萨染液试剂盒对附着在上室底部的细胞染色,光镜下观察并统计每个视野下细胞的数量。
2.5 MCF-7细胞迁移能力检测药物干预48 h后,将细胞接种在96孔板中,当细胞融合度达到90%以上时,用灭菌枪头在有贴壁细胞的96孔板底部划出一道划痕,清除划痕附近破碎的细胞,将96孔板置于细胞培养箱中培养48 h,光镜下观察并计算细胞迁移率。
细胞迁移率=(1-培养48 h后的间距/起始划痕间距)×100%
2.6 MCF-7细胞凋亡情况检测药物干预48 h后,收集细胞,用约1×106个细胞均匀铺在盖玻片上,自然晾干后使用4%多聚甲醛将细胞固定在载玻片,用PBS清洗2次后加TUNEL混合液并严格按照TUNEL试剂盒说明书进行操作。显色后封片,光镜下观察并统计每个视野中凋亡细胞数和总细胞数。
细胞凋亡指数=细胞凋亡数/细胞总数×100%
2.7Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7的mRNA相对表达量检测使用RT-qPCR检测Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7的mRNA相对表达量。药物干预48 h后,收集细胞于离心管中,加入Trizol,按照RNA提取试剂盒操作说明书对细胞总RNA进行提取,使用反转录试剂盒将细胞总RNA反转录为cDNA,按照NCBI基因库中查找的目的基因序列,设计目的基因上下游引物,引物序列见表1。按照RT-qPCR试剂盒说明书将PCR程序设置为:95℃10 s,58℃30 s,72℃20 s,35个循环后,60℃5 min。GAPDH为内参基因,通过2-△△Ct计算各目的基因mRNA相对表达量。

表1 引物序列
2.8 Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7蛋白表达量和β-catenin磷酸化水平检测采用Western blot检测Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7蛋白表达量和β-catenin磷酸化水平。药物干预48 h后,将细胞收集到离心管中,加入细胞裂解液,提取细胞总蛋白。按照Western blot试剂盒说明书进行操作,加一抗(1∶1 000)、二抗(1∶1 000)后使用ECL显色试剂盒显色,以β-actin蛋白为内参,计算各目的蛋白的相对表达量。
2.9 统计学方法研究结果使用均数±标准差(±s)表示,使用SPSS 16.0对结果进行统计学分析,多组样本间比较使用单因素方差分析,两两比较使用SNK-q检验,组内比较采用t检验。P<0.05表示结果有显著统计学差异。
3 结果
3.1 鸡血藤总黄酮对MCF-7细胞增殖抑制率的影响药物干预24 h和48 h后,与阴性对照组比较,鸡血藤总黄酮可明显升高MCF-7细胞的增殖抑制率(P<0.05),且呈现出明显的剂量依赖性;与药物干预24 h相比,不同剂量的鸡血藤总黄酮干预48 h后MCF-7细胞的增殖抑制率均显著升高(P<0.05)。提示鸡血藤总黄酮可明显抑制MCF-7细胞增殖。见表2。
表2 鸡血藤总黄酮对MCF-7细胞增殖抑制率的影响 (±s,%)
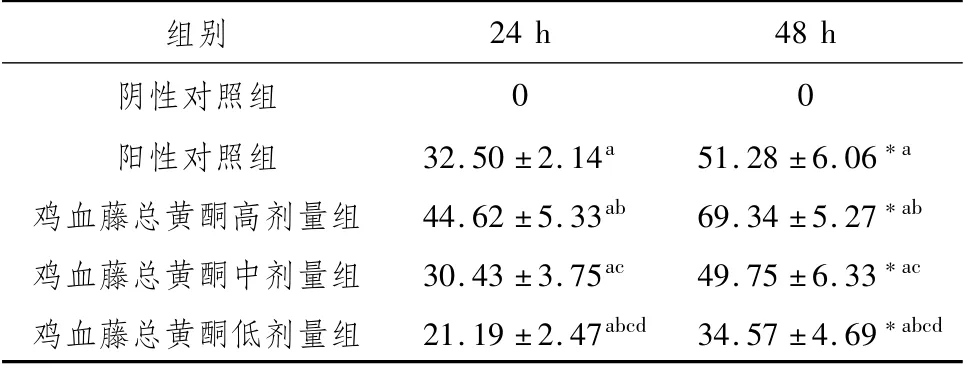
表2 鸡血藤总黄酮对MCF-7细胞增殖抑制率的影响 (±s,%)
注:与24 h相比,*P<0.05;与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
24 h 48 h阴性对照组组别0 0阳性对照组 32.50±2.14a 51.28±6.06*a鸡血藤总黄酮高剂量组 44.62±5.33ab 69.34±5.27*ab鸡血藤总黄酮中剂量组 30.43±3.75ac 49.75±6.33*ac鸡血藤总黄酮低剂量组 21.19±2.47abcd 34.57±4.69*abcd
3.2 鸡血藤总黄酮对MCF-7细胞凋亡的影响药物干预48 h后,TUNEL法观察MCF-7细胞凋亡情况。与阴性对照组比较,鸡血藤总黄酮显著升高MCF-7细胞的凋亡指数(P<0.05),且呈现出明显的剂量依赖性。提示鸡血藤总黄酮可促进MCF-7细胞凋亡。见图1,表3。
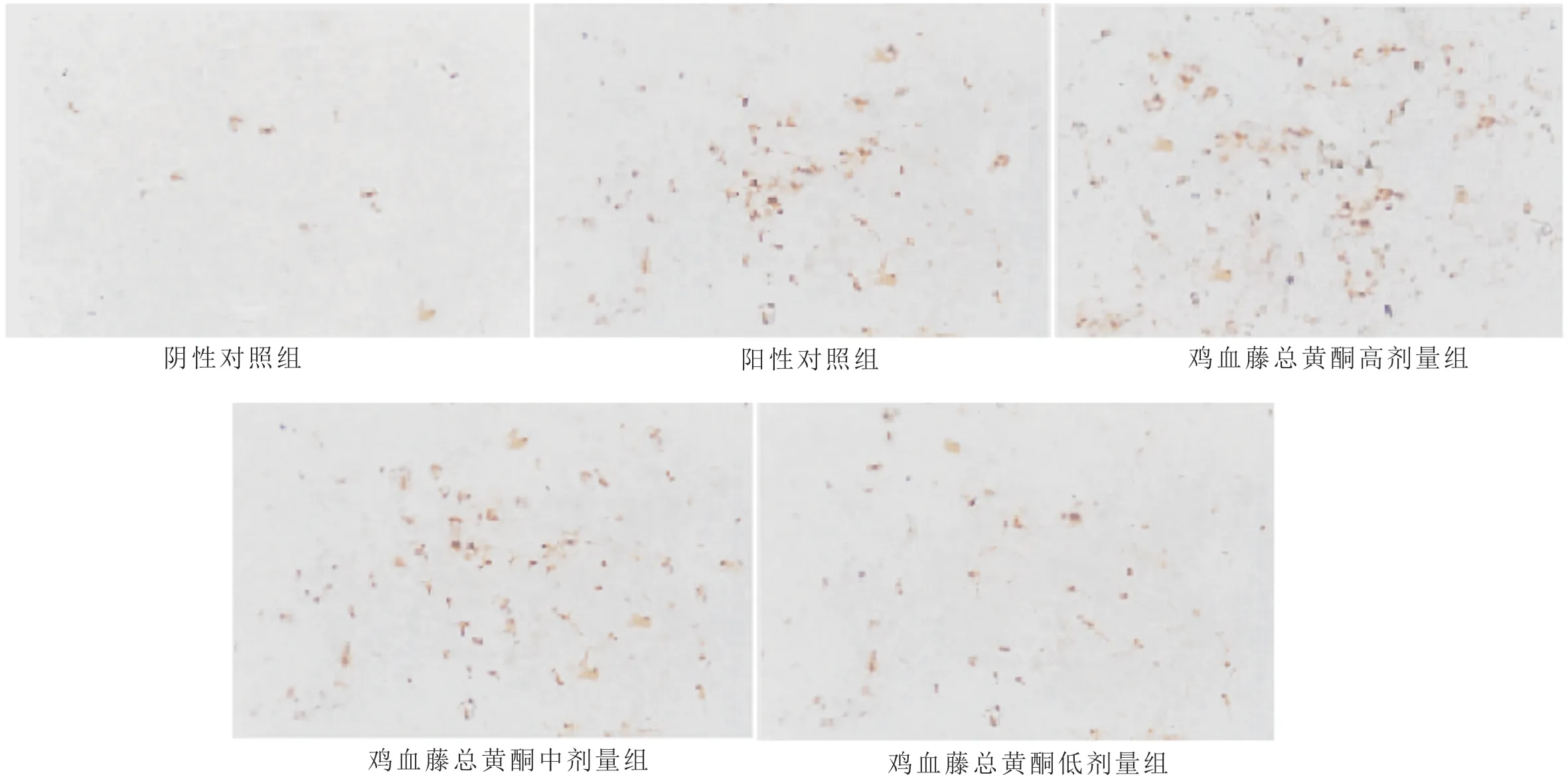
图1 鸡血藤总黄酮对MCF-7细胞凋亡的影响(×200)
表3 鸡血藤总黄酮对MCF-7细胞凋亡的影响 (±s)

表3 鸡血藤总黄酮对MCF-7细胞凋亡的影响 (±s)
注:与24 h相比,*P<0.05;与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
/%阴性对照组组别 凋亡指数5.12±1.02阳性对照组 34.50±5.18a鸡血藤总黄酮高剂量组 45.47±6.22ab鸡血藤总黄酮中剂量组 30.91±4.15ac鸡血藤总黄酮低剂量组 22.14±3.38 abcd
3.3 鸡血藤总黄酮对MCF-7细胞侵袭活性的影响与阴性对照组比较,鸡血藤总黄酮显著降低Transwell小室上室底部MCF-7细胞数(P<0.05),且呈现出明显的剂量依赖性。提示鸡血藤总黄酮可抑制MCF-7细胞侵袭活性。见图2,表4。
表4 鸡血藤总黄酮对MCF-7细胞侵袭活性的影响 (±s)

表4 鸡血藤总黄酮对MCF-7细胞侵袭活性的影响 (±s)
注:与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
组别 阳性细胞数(个/视野)168.40±10.05阳性对照组 93.80±6.43a鸡血藤总黄酮高剂量组 42.60±5.28ab鸡血藤总黄酮中剂量组 96.20±7.75ac鸡血藤总黄酮低剂量组 119.6±12.60阴性对照组abcd
图2 鸡血藤总黄酮对MCF-7细胞侵袭活性的影响(×100)
3.4 鸡血藤总黄酮对MCF-7细胞迁移能力的影响与阴性对照组比较,鸡血藤总黄酮显著降低MCF-7细胞的迁移率(P<0.05),且呈现出明显的剂量依赖性。提示鸡血藤总黄酮可抑制MCF-7细胞的迁移能力。见图3,表5。
表5 鸡血藤总黄酮对MCF-7细胞迁移能力的影响 (±s)

表5 鸡血藤总黄酮对MCF-7细胞迁移能力的影响 (±s)
注:与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
组别 迁移率/%阴性对照组abcd 89.96±6.58阳性对照组 61.41±5.30a鸡血藤总黄酮高剂量组 30.52±4.23ab鸡血藤总黄酮中剂量组 62.35±6.08ac鸡血藤总黄酮低剂量组 73.20±5.91

图3 鸡血藤总黄酮对MCF-7细胞迁移能力的影响(×400)
3.5 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关基因相对表达量的影响RT-qPCR检测MCF-7细胞中Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7的mRNA相对表达量。与阴性对照组比较,鸡血藤总黄酮显著降低Wnt1、βcatenin、cyclinD1、c-Myc和MMP-7的mRNA表达(P<0.05),且呈现出明显的剂量依赖性。见表6。
表6 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关基因相对表达量的影响 (±s)
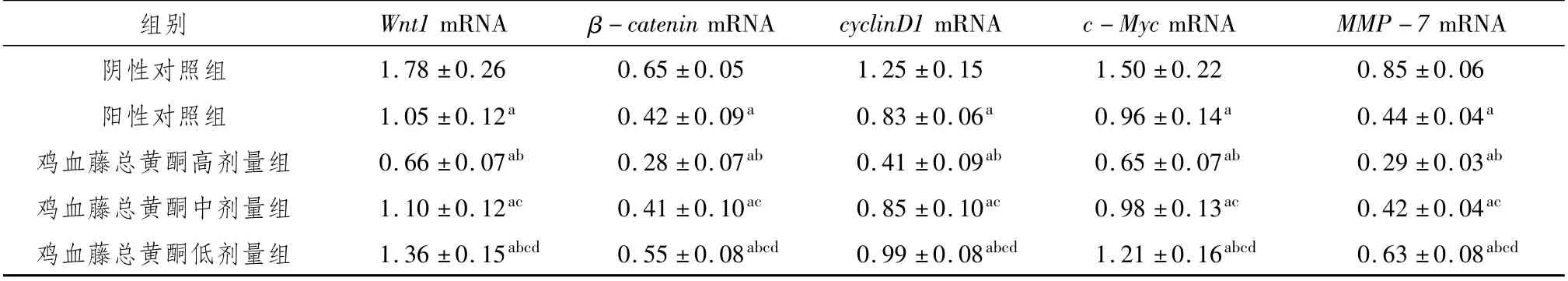
表6 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关基因相对表达量的影响 (±s)
注:与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
mRNA阴性对照组 1.78±0.26 0.65±0.05 1.25±0.15 1.50±0.22 0.8组别 Wnt1 mRNA β-catenin mRNA cyclinD1 mRNA c-Myc mRNA MMP-7 5±0.06阳性对照组 1.05±0.12a 0.42±0.09a 0.83±0.06a 0.96±0.14a 0.44±0.04a鸡血藤总黄酮高剂量组 0.66±0.07ab 0.28±0.07ab 0.41±0.09ab 0.65±0.07ab 0.29±0.03ab鸡血藤总黄酮中剂量组 1.10±0.12ac 0.41±0.10ac 0.85±0.10ac 0.98±0.13ac 0.42±0.04ac鸡血藤总黄酮低剂量组 1.36±0.15abcd 0.55±0.08abcd 0.99±0.08abcd 1.21±0.16abcd 0.63±0.08 abcd
3.6 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关蛋白表达量及其磷酸化水平的影响Western blot检测MCF-7细胞中Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7蛋白表达水平和β-catenin磷酸化水平。与阴性对照组比较,鸡血藤总黄酮显著降低Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7的蛋白表达水平(P<0.05),显著升高β-catenin磷酸化水平(P<0.05),且呈现出明显的剂量依赖性。见图4,表7。

图4 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关蛋白表达量及其磷酸化水平的影响
表7 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关蛋白表达量及其磷酸化水平的影响 (±s)

表7 鸡血藤总黄酮对MCF-7细胞中Wnt/β-catenin通路相关蛋白表达量及其磷酸化水平的影响 (±s)
注:与阴性对照组相比,a P<0.05;与阳性对照组相比,b P<0.05;与鸡血藤总黄酮高剂量组相比,c P<0.05;与鸡血藤总黄酮中剂量组相比,d P<0.05
组别 Wnt1/β-actin β-catenin/β-actin β-catenin磷酸化/β-actin cyclinD1/β-actin c-Myc/β-actin MMP-7/β-actin阴性对照组 2.08±0.32 0.56±0.05 0.14±0.01 1.05±0.12 1.3 5±0.11 1.03±0.14阳性对照组 1.45±0.21a 0.35±0.05a 0.36±0.06a 0.74±0.04a 0.88±0.13a 0.66±0.12a鸡血藤总黄酮高剂量组 0.87±0.14ab 0.19±0.07ab 0.50±0.07ab 0.38±0.05ab 0.49±0.07ab 0.48±0.07ab鸡血藤总黄酮中剂量组 1.48±0.18ac 0.30±0.06ac 0.33±0.05ac 0.76±0.07ac 0.90±0.12ac 0.65±0.09ac鸡血藤总黄酮低剂量组 1.63±0.21abcd 0.43±0.04abcd 0.25±0.03abcd 0.89±0.04abcd 1.13±0.14abcd 0.81±0.10 abcd
4 讨论
乳腺癌作为女性高发恶性肿瘤严重危害女性健康。虽然人们对乳腺癌发病机制的研究不断深入,但是目前仍未完全明确[10]。化疗是该病治疗的重要手段,但是化疗引起的肿瘤耐药性不可忽视。研究报道,90%以上的化疗失败均为肿瘤细胞耐药所致,且此类药物不良症状较多,也使得患者预后不佳[11]。因此,寻找新型治疗方案显得尤为重要。乳腺癌在中医上被认为是肝气郁结、正气不足所致,癌变过程被认为是毒邪停留、气滞血瘀[12]。因此,治疗需以活血化瘀、散节理气为主。鸡血藤为我国传统中药之一,其性味温、苦、甘,具有补血活血、通络活筋、调经止痛的功效[13]。研究表明,鸡血藤总黄酮为鸡血藤的主要成分,具有调节免疫、清除自由基、抗氧化、抗肿瘤等作用[14-15],且鸡血藤总黄酮在抑制肿瘤细胞的同时,对正常细胞毒性较小,安全性较高[16]。基于此,本研究探讨鸡血藤总黄酮对乳腺癌细胞的抑制作用。
阿霉素是广谱类抗肿瘤药物,对乳腺癌具有较强抗癌活性,常见于乳腺癌的临床治疗,但因其不良反应及耐药性导致该药物在临床治疗中无法长期大量使用[17]。因此本研究使用阿霉素作为鸡血藤总黄酮的阳性对照药物具有可行性。本研究使用鸡血藤总黄酮处理人乳腺癌细胞株MCF-7发现,MCF-7细胞增殖抑制率升高,侵袭和转移能力降低,该结果与已有研究结果一致。此外,鸡血藤总黄酮处理组与阳性对照组均表现出对MCF-7细胞抑制作用,但是高剂量鸡血藤总黄酮效果优于阿霉素。癌细胞除了能够增殖、侵袭和转移以外,细胞周期被改变,细胞凋亡被抑制,也是肿瘤发生发展的原因之一。研究证明,鸡血藤可干扰细胞周期,促进人非小细胞肺癌A549细胞凋亡[18]。本研究通过TUNEL法检测人乳腺癌MCF-7细胞凋亡指数发现,鸡血藤总黄酮和阿霉素均可促进MCF-7细胞凋亡,高剂量鸡血藤总黄酮效果优于阿霉素。Wnt/β-catenin信号通路最初发现在胚胎发育形成中起重要作用,随着研究的深入又被证实与肿瘤的形成、发展密切相关[19]。当该信号通路未被激活时,存在细胞质中的β-catenin会与GSK-3β等蛋白结合形成复合物,并发生磷酸化,磷酸化的β-catenin会进入泛素化-蛋白酶体途径发生降解,使得细胞质中βcatenin维持较低水平,Wnt通路下游靶基因表达被抑制,维持正常细胞调控[20]。当细胞质中存在Wnt配体时,GSK-3β被磷酸化,复合物无法形成导致β-catenin无法被磷酸化,在细胞质中大量累积并处于游离状态,游离的β-catenin可进入细胞核并和细胞核内转录因子结合,激活下游靶基因cyclinD1、c-Myc和MMP-7等[21]。cyclinD1是细胞周期蛋白家族成员,其过表达可导致细胞从G1期快速进入S期,导致细胞生长失控,进行恶性增殖,引起肿瘤的生成,因此,在癌细胞中cyclinD1的表达常表现为异常增多[22]。研究表明,乳腺癌的高侵袭转移性和cyclinD1的阳性表达有关[23]。c-Myc是癌基因家族成员,在细胞生长、增殖、分化、凋亡等过程中具有重要作用,由于其在多种肿瘤组织中均可检测出异常高表达量,因此,常作为部分肿瘤诊断的标志物[24]。研究表明,下调乳腺癌细胞中c-Myc基因表达水平可抑制细胞生长和侵袭转移能力[25]。MMP-7是基质金属蛋白酶家族成员,具有降解细胞外基质、促进血管生成、调节细胞间黏附程度等功能。研究发现,MMP-7在肿瘤组织中呈现出较高表达量,并且与肿瘤的浸润转移有密切关系[26]。本研究结果显示,鸡血藤总黄酮处理的MCF-7细胞中Wnt1、β-catenin、cyclinD1、c-Myc和MMP-7的mRNA和蛋白表达水平降低,β-catenin磷酸化水平提高,表明MCF-7细胞中Wnt/β-catenin信号通路异常激活被抑制,且抑制效果具有剂量依赖性。综上所述,鸡血藤总黄酮可抑制人乳腺癌细胞株MCF-7增殖、侵袭和迁移,促进其凋亡,推测其作用机制与抑制Wnt/β-catenin信号通路激活有关。本研究仅从体外实验方面进行探讨,鸡血藤总黄酮能否作为乳腺癌治疗药物应用于临床还需要进一步深入研究。

