miR-93在脑胶质瘤的表达及其对胶质瘤细胞系U87、U251细胞增殖的影响
朱潇鹏,陈泽波,范宏军,李甘,黄永凯,韩德清
脑胶质瘤起源于神经外胚层,约占神经上皮肿瘤的60%,是最常见的原发性颅内肿瘤[1]。其中多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的恶性程度最高,即使手术全切除联合放疗、化疗等综合治疗,患者的中位生存期仅有12~14个月[2]。高级别脑胶质瘤是指WHO Ⅲ-Ⅳ的胶质瘤,肿瘤呈浸润性生长,与瘤周组织分界不清,难以达到手术全切。残余的肿瘤细胞加上其强增殖、强侵袭、新生血管丰富等特点,患者总体预后不佳[3]。当前大量研究从分子遗传水平探索脑胶质瘤发生、发展的分子机制,以期针对关键的肿瘤驱动因素进行靶向治疗,从而提高患者的治疗效果。
microRNAs(miRNAs)是一类内源性、保守长度为20-24nt的非编码小分子RNA,广泛存在于哺乳动物中,参与细胞的增殖、分化、迁移等生理过程[4]。大量的研究证实miRNA与肿瘤的发生发展、恶性程度、患者的预后密切相关。课题组前期选用microRNA组织芯片对WHO Ⅱ-Ⅲ级脑胶质瘤组织和配对瘤周组织的1 924个microRNA分子的表达情况进行分析发现;分析的1 924个microRNA分子中13个表达异常,上调的microRNA分子12个,下调的1个;与瘤周组织相比,脑胶质瘤中miR-93分子呈现异常的高表达[5]。考虑到芯片检测存在一定假阳性率,芯片结果需进一步验证。本研究,通过收集61例不同级别的胶质瘤组织,运用qRT-PCT技术,验证miR-93在胶质瘤组织中的表达情况。并进一步设计实验,探讨miR-93在胶质瘤细胞系中的生物学功能。
1 材料与方法
1.1 一般资料 本组患者中男37例,女24例;WHO Ⅰ-Ⅳ级的患者分别:5例、21例、15例和20例。病理诊断由中南大学湘雅医学院附属株洲医院病理科2名正/副主任医师根据2016版《WHO中枢神经系统肿瘤分类》诊断并进行分型。患者或家属知情同意。用于对照的亚洲人正常大脑总RNA预混合物购自美国Clontech公司。
1.2 细胞培养及miRNA抑制物转染 胶质瘤细胞系U87、U251在DMEM培养基中培养,培养基含10%胎牛血清和1%青霉素-链霉素,置于37 ℃、5% CO2孵箱中培养。构建慢病毒干扰载体(纽恩生物科技有限公司),转染时取对数期生长的U87和U251细胞,以2×105个/孔接种于6孔板,待80%细胞汇合后,按照说明书转染。荧光显微镜下观察是否转染成功,qRT-PCR检测转染后的miRNA的表达情况。将胶质瘤细胞(U87和U251)分为3组:(1)空白对照组(miR-93),U87、U251培养基中加入等量生理盐水;(2)阴性对照组(NC),U87、U251培养基中加入空白病毒载体;(3)转染miR-93抑制物组(miR-93 RNAi),U87、U251培养基中加入miR-93病毒干扰载体。
1.3 胶质瘤组织及细胞中miR-93的表达检测 将收集的胶质瘤组织和U87、U251肿瘤细胞按照TRIzol试剂盒说明书(重庆川东化工公司)提取组织和细胞的总RNA。然后测定所提总RNA样品在280 nm的光密度(D)值并定量。使用逆转录试剂盒合成cDNA,并使用SYBR green one 进行定量PCR。PCR的扩增参数:95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸10 s,共40个循环。miR-93正向引物序列为 5′-AGGCCCAAAGTGCTGTTCGT-3′,反向引物序列为: 5′-GTGCAGGGTCCGAGGT-3′。U6作为miR-93的内参基因,进行3次独立实验。并使用△△CT方法分析基因的相对表达量,目标量=2-△△CT。
1.4 细胞增殖实验 取不同分组(空白对照组、阴性对照组、转染miR-93抑制物组)U87和U251对数生长期的细胞,以1×103/孔接种到96孔中,设置4个复孔;用完全DMEM培养基于37 ℃ 5% CO2培养箱内继续培养24 h、48 h、72 h、96 h后,采用cell counting Kit-8(CCK-8)检测细胞的增殖情况。即每孔加入10 μL CCK-8试剂溶液,于37 ℃、5% CO2培养箱下继续培养1 h,用酶标仪测450 nm波长处细胞的OD值。
1.5 细胞克隆形成实验 检测胶质瘤细胞系U87和U251的细胞克隆形成。胰蛋白酶消化培养的U87、U251细胞,离心、计数,以2×103个细胞每孔重新接种于12孔板。继续于37 ℃温箱中培养2周,每3 d更换一次培养基,PBS洗涤3次后,加入4%多聚甲醛2 mL/孔,固定细胞15 min。去固定液后,加入1%的结晶染色剂1 mL/孔,染色20 min。洗涤染色液后,拍照保存,手动计数克隆。计算克隆形成率=克隆数/接种细胞数×100%。
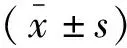
2 结 果
2.1 慢病毒转染干扰miR-93在U87和U251细胞中的表达 U87和U251细胞在慢病毒转染后48 h后,荧光显微镜下细胞带上绿色荧光(图1),提示慢病毒已转染至细胞体内并成功表达。qRT-PCR检测miR-93在3组(空白对照组、阴性对照组、转染miR-93抑制物组)细胞中的表达情况。设空白对照组miR-93的表达值为1,U87细胞系转染miR-93抑制物组表达水平0.022,低于空白对照组和阴性对照组,组间差异有显著统计学意义(P<0.01)。U251细胞系转染miR-93抑制物组表达水平0.082;低于空白对照组和阴性对照组,组间差异有显著统计学意义(P<0.01)。U87和U251的空白对照与阴性对照组的组间差异均无统计学意义。
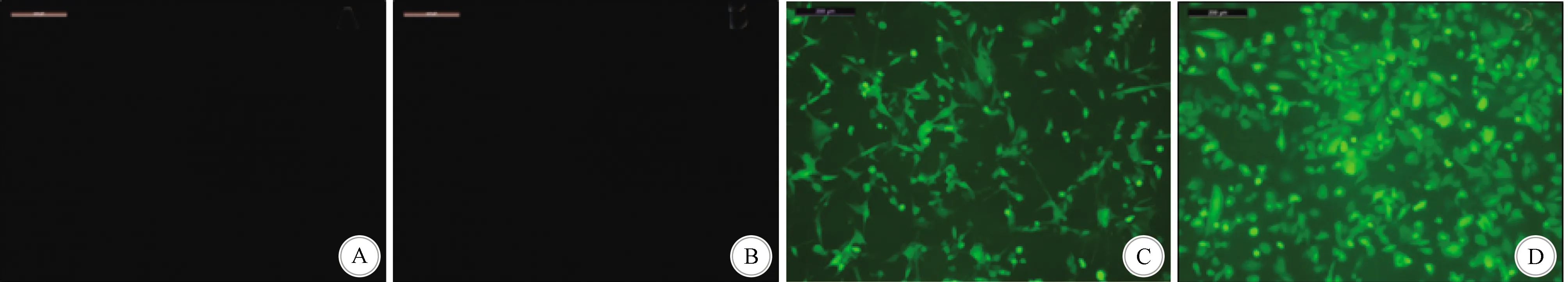
A:空白对照组U87细胞;B:空白对照组U251细胞,在荧光显微镜下无荧光显色;C:miR-93抑制物组U87细胞;D:miR-93抑制物组U251细胞,在荧光显微镜下见荧光显色(荧光染色,×100)
2.2 miR-93在脑胶质瘤组织中的表达水平变化 与正常脑组织对比,61例胶质瘤组织标本中,44例(72.1%)miR-93表达水平明显高于正常脑组织。其中WHO Ⅰ级胶质瘤的阳性表达率为20%(1/5)、Ⅱ级为71.4%(15/21)、Ⅲ级为73.3%(11/15)、Ⅳ级为85%(17/20)。WHO Ⅰ-Ⅳ级胶质瘤组织中miR-93的表达量分别是1.25、5.91、6.71、31.20。WHO Ⅰ和WHO Ⅱ、WHO Ⅰ和WHO Ⅲ、WHO Ⅰ和WHO Ⅳ、WHO Ⅱ和WHO Ⅳ、WHO Ⅲ和WHO Ⅳ组间差异有统计学意义(P<0.01)。见图2。

N—正常对照组;**P<0.01 A:U251细胞;B:U87细胞;**P<0.01;U87、U251—空白对照组,U87-NC、U251-NC—阴性对照组,U87-inhibitor、U251-inhibitor—转染miR-93抑制物组
2.3 miR-93对胶质瘤细胞增殖活性的影响 转染miR-93抑制物组U87和U251细胞在转染后24 h、48 h、72 h、96 h的增殖活性比阴性对照及空白对照明显降低(P<0.05);阴性对照组与空白对照组U87、U251细胞光密度值之间的差异无统计学意义(图3)。结果表明抑制miR-93的表达后,胶质瘤U87、U251细胞的体外增殖活性随之降低。
2.4 miR-93 表达下调对U87、U251细胞克隆形成的影响 转染miR-93抑制物组的U87和U251细胞克隆形成数比阴性对照、空白对照明显下降,差异具有统计学意义(均P<0.01);阴性对照组与空白对照组之间的差异无统计学意义(图4)。表明抑制miR-93的表达后,可以降低U87、U251的细胞克隆形成能力。
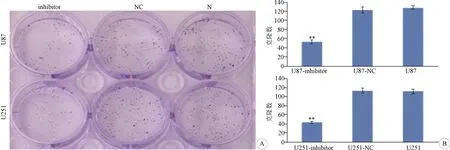
A:平板克隆形成实验;B:各组细胞克隆数比较;**P<0.01;U87、U251—空白对照组,U87-NC、U251-NC—阴性对照组;U87-inhibitor、U251-inhibitor—转染miR-93抑制物组
3 讨 论
microRNAs作为内源性、非编码小RNA,通过与mRNA的3′-非翻译区(3′-UTR)靶向结合,导致靶基因片段降解或失活,与siRNA类似,对靶基因的表达具有负性调控作用[6]。近年来的研究证实,miRNA与许多重要的生物过程相关,包括发育调节,器官形成、细胞增殖和凋亡等。并参与了肿瘤致病过程中的众多环节,在肿瘤的发生发展中起到重要的作用,有望成为肿瘤治疗的新靶点[4,7-8]。之前的研究表明,许多miRNA在胶质瘤中表达异常,一些miRNA在肿瘤耐药、疾病诊断及预后判断中显示出重要的指导作用[9-10]。因此,探明胶质瘤中新的差异表达的miRNA分子,并明确其功能,将其作为治疗靶点或生物标记,可为提高胶质瘤患者的诊治提供新思路。
前期研究利用miRNA芯片技术,发现miR-93分子在脑胶质瘤中表达异常,与瘤周组织相比,miR-93在脑胶质瘤中过表达[5]。越来越多的研究发现,在许多其他的肿瘤中miR-93表达异常,并在肿瘤发生发展过程中发挥重要的作用。如在非小细胞肺癌中,异常表达的miR-93通过调节PI3K/AKT信号通路,最终促进肿瘤的发生及转移[11]。在肝癌中,miR-93通过直接作用于PDCD4促进细胞的侵袭和转移[12]。但在脑胶质瘤中miR-93的表达尚存在争议,miR-93的功能及其机制还需进一步探讨。
其他学者研究表明,miR-93在胶质瘤组织和细胞中过表达,且miR-93的表达水平与肿瘤的恶性程度及患者总生存期密切相关[13-14]。Malekpour等研究报道,应用实时定量PCR检测178 例脑胶质瘤组织及瘤周组织的miR-93表达水平,与瘤周组织对比,脑胶质瘤组织中miR-93呈现明显低表达,和之前的研究相反,并且miR-93的低表达与肿瘤的恶性生物学行为及患者的预后相关[15]。本研究通过检测脑胶质瘤组织和正常脑组织的miR-93表达水平发现,miR-93在胶质瘤组织中普遍高表达。且和肿瘤的WHO分级(肿瘤的恶性程度)呈现一定的相关性。随着胶质瘤的恶性程度增加,miR-93的表达随之增加,可为临床判断肿瘤的恶性程度提供一定的参考。并且miR-93在一定程度长反映了胶质瘤的恶性程度,可能与其促进胶质瘤细胞的增殖活性相关。本研究发现构建慢病毒载体,抑制miR-93的表达后,胶质瘤细胞U87和U251的增殖活力被明显抑制;表明miR-93与胶质瘤细胞的增殖能力密切相关。目前miR-93参与脑胶质瘤发生发展的确切机制尚不清楚。有研究显示,miR-93的上调可通过激活PI3K/AKT 通路,影响肿瘤细胞增殖、迁移、细胞周期等生物学过程,包括PTEN、VEGF、IL-8、PHLPP2、FOXO3等PI3K/AKT 信号通路上关键的基因均已被证实受miR-93的直接调控[13,16-17]。此外miR-93还可通过自我调节环路发挥作用,如在肾癌细胞中,STAT3活化后入核结合到 miR-93 上游启动区域发挥转录作用,促进细胞增殖,抑制细胞凋亡。而这过程是通过miR-93特异性结合 DAPK1-m RNA 3’UTR 区,抑制蛋白翻译所发挥作用的;过表达DAPK1后,又可以反过来影响 STAT3活化,从而影响miR-93的表达[18]。
miR-93系miR-106b-25 cluster的3个成员之一[19]。microRNA组织芯片结果显示脑胶质瘤组织中miR-106b-25 cluster的成员(miR-106b、miR-93和miR-25)均高表达。miR-92a-3p、miR-18a-5p和miR-19b-3p(miR-17-92 cluster的成员)在WHO Ⅱ级胶质瘤中异常表达,miR-106b-5p、miR-93-5p(miR-106b-25 cluster 的成员)在WHO Ⅲ级胶质瘤中表达异常。miR-106b-25 cluster 和miR-17-92 cluster的成员中4个miRNA分子的种子区(seedregion)完全相同。从第2个到第8个核苷酸被称为种子区,是miRNA上进化最为保守的片段。相同种子区的miRNA可能识别并结合相同的3’UTR区域,所调控的靶基因可能相同。miR-93表达水平的增高程度可在一定程度上反映脑胶质瘤的恶性程度。而miR-93在WHO Ⅱ级和Ⅲ级胶质瘤中,具有相同种子区的miRNA依次出现,表明与miR-93类似功能的miRNA分子数目增加,这也可能是miR-93过表达与脑胶质瘤恶性程度相关的机制。基于以上,推测miR-106b-25 cluster 和miR-17-92 cluster的成员增加胶质瘤细胞增殖,抑制凋亡,提高肿瘤的恶性程度,参与了胶质瘤的发生发展过程[19-22]。
综上所述,miR-93在脑胶质瘤组织中高表达,随着胶质瘤的恶性程度不断增加,miR-93的表达水平随之增高;miR-93作为致癌基因,当被抑制后,胶质瘤细胞的增殖活性下降。但miR-93影响脑胶质瘤细胞增殖活性的具体的信号通路及机制尚不清楚,还有待进一步研究探讨。

