利用CRISPR/Cas 9基因编辑技术提高贵州禾产量研究
李光正, 李 岩, 李建容, 郭洪刚, 曾晓芳, 赵德刚,3
(1.贵州大学精细化工研究开发中心, 贵阳 550025;2.贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室,贵州省农业生物工程重点实验室, 贵阳 550025;3.贵州省农业科学院贵州省植物保育技术应用工程研究中心, 贵阳 550006)
水稻是世界上最主要的粮食作物之一,全球50%以上的人口以大米为主食[1]。据估计,到2050年需要水稻增产70%~100%才能满足预测的世界人口增长需求[2]。我国水稻播种面积约占世界水稻种植面积的1/6,稻谷产量居世界第一,约占世界稻谷总产量的30%[3]。中国是世界上最大的稻米生产国,同时也是世界上最大的稻米消费国,水稻种植面积占国内粮食种植面积的26.7%。全国65%以上的人口以稻米为主食。稻米的产量与我国的粮食安全联系紧密[4-5]。穗部性状与水稻产量和品质密切相关,是构成水稻产量的重要农艺性状,也是水稻高产理想株型的重要指标[6]。对我国水稻品种60年来的演进观察发现,水稻获得高产、超高产的关键在于每穗粒数的大幅度增加。随着水稻功能基因组的研究深入,水稻理想株型分子设计育种更加受到重视,穗大、粒多以及适当株高成为了水稻株型育种重要的选择目标。
OsCKX2(Gn1a)是世界上首个被克隆的水稻产量构成因子QTL,OsCKX2基因编码细胞分裂素氧化酶/脱氢酶,可以降解细胞分裂素。OsCKX2基因表达的减弱或突变,可使细胞分裂素在花序分生组织中累积,从而增加穗粒数,最终提高水稻的产量[7]。通过选育自然环境OsCKX2基因突变的植株,采用常规的杂交育种来优化水稻品质,耗费周期长、见效慢,并存在基因连锁和生殖隔离的缺点[8]。CRISPR/Cas系统具有较高的编辑效率和特异性,由于插入与编辑靶位点分离,可以利用自交或回交等手段将T-DNA 插入片段从基因组中分离,可以只对靶基因进行突变,而不留任何外来遗传物质在作物中,从而实现最小范围的改变植物基因组[9]。因此,利用CRISPR/Cas 9基因组编辑技术来修饰植物内源基因,为作物产量提高及品质改良提供了新的育种途径。前期研究利用CRISPR/Cas 9技术对中花11及日本晴中的OsCKX2基因进行定点突变,获得了产量增加的突变体植株[10]。
贵州禾是中国水稻中的一个重要的种质资源,是贵州省黔东南自治州从江、黎平、榕江、剑河等县苗族和侗族人民种植的主要粮食作物,具有耐寒、耐阴、耐烂、耐涝及抗旱等特点,但同时还存在对光温条件要求较高、生育期较长、株型松散、丰产性差等不良性状,需要对其进行改良[11-12]。因此,本研究利用CRISPR/Cas 9技术对贵州黎平杂边禾OsCKX2基因进行定点编辑,获得产量提高的水稻新种质。探索该技术在贵州地方水稻遗传育种中的应用潜力,为水稻分子设计育种奠定基础。
1 材料与方法
1.1 材 料
贵州黎平杂边禾为贵州大学农业生物工程研究院收集并保存。
质粒与菌株:CRISPR/Cas 9基本载体BGK 030购自杭州百格生物有限公司;大肠杆菌(Escherichiacoli) DH 5 α、农杆菌(Agobacteriumtumefaciens)菌株EHA 105均由贵州大学农业生物工程研究院保存。
1.2 研究方法
1.2.1CRISPR/Cas 9表达载体构建
根据贵州禾水稻中OsCKX2基因序列特点,参考Xu等[13]的方法在植物CRISPR在线靶位点设计数据库(http://cbi.hzau.edu.cn/cgi-bin/CRISPR)中设计适用于水稻OsCKX2基因定点突变的sgRNA序列靶位点,用于基因编辑载体构建。在sgRNA引物上下游分别加入“TGTGTGGGTAG TCTGTCCACGACAC”与“AAACGTGTCGT GGACAGACTACCCA”序列,生成Oligo序列,根据选择的sgRNA序列设计鉴定引物。载体构建及验证参考黄小贞等[14]的方法,化学合成sgRNA连接到CRISPR/Cas 9表达载体BGK 030上。

图1 CRISPR/Cas 9植物表达载体BGK 030Fig.1 Construction of CRISPR/Cas 9 plant expression vector BGK 030
1.2.2农杆菌介导的黎平杂边禾愈伤组织遗传转化
农杆菌介导的水稻愈伤组织遗传转化及培养基参考张璠等[15]的方法进行,利用100 μg·mL-1潮霉素的筛选培养基进行抗性愈伤及幼苗筛选;待分化植株长至3 cm时移至生根培养基中诱导生根,最后将生根的抗性植株移栽至培养桶中进行培养。
1.2.3转基因植株鉴定
参考程芳艳等[16]的方法,利用CTAB法提取抗性植株与野生型植株叶片基因组DNA,利用潮霉素抗性基因特异性引物(表1)对抗性植株进行PCR扩增,扩增反应条件为:94 ℃ 3 min→(94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s)35次循环→72 ℃延伸7 min;14 ℃保存。扩增产物在1%琼脂糖凝胶电泳后检测。

表1 潮霉素检测引物Table 1 Detection primer for hygromycin-resistant gene
1.2.4转基因植株突变位点鉴定
利用CTAB法提取To转基因植株叶片基因组DNA,利用靶位点基因特异测序引物(表2)进行PCR 扩增后,回收扩增产物,送Invitrogen公司进行测序,利用DSDecode在线软件(http://skl.scau.edu.cn/dsdecode/)分析靶位点的突变情况。

表2 OsCKX2基因编辑靶点测序引物Table 2 Sequencing primers for editing targets of OsCKX2 gene
1.2.5突变植株农艺性状分析
2019年5月,将测序结果为纯合的突变植株与野生型植株种植于贵州省农业生物工程研究院转基因植物示范种植地(贵州贵阳),常规肥水管理,成熟期对水稻进行农艺性状调查,种子收获后进行考种。
2 研究结果
2.1 OsCKX2基因敲除靶位点获得及表达载体构建
OsCKX2基因位于水稻1号染色体上,含有4个外显子。根据贵州地方水稻OsCKX2基因的特点,选择第一外显子中距离起始密码子(ATG)520位~542位序列AGGTAGTCTGTCCACGACACCGG作为基因编辑的sgRNA(图2)。靶序列经Blast比对筛选,未找到脱靶序列。将sgRNA序列插入BGK 030为基本载体的CRISPR/Cas载体,获得以水稻U 6启动子驱动的适用于OsCKX2基因定点修饰CRISPR/Cas 9 sgRNA表达载体。

图2 水稻OsCKX2基因敲除位点Fig.2 Schematic diagram of knockout sites of rice OsCKX2 gene
将构建好的重组载体进行PCR扩增测序分析,测序峰图表明靶位点成功构建到重组载体上(图3)。

图3 sgRNA测序结果Fig.3 Sequencing results of sgRNA
2.2 转基因植株获得
对通过100 μg·mL-1潮霉素筛选获得的水稻抗性植株提取总DNA,利用潮霉素特异性引物进行PCR验证,转基因植株在481 bp左右有明显条带,阴性对照扩增无条带,初步证明基因编辑载体已经转入水稻。利用PCR检测获得阳性的转基因植株20株(图4)。
2.3 OsCKX2基因靶位点突变检测
利用OsCKX2基因突变位点特异测序引物对20株转基因植株DNA进行PCR 扩增(图5),回收扩增产物,送Invitrogen公司(重庆)测序,以CRISPR简并序列解码在线软件DSDecode分析靶位点的突变情况。结果表明,7株转基因植株靶位点发生了突变,突变率为35%,其中3个株系CR-ckx2-04、CR-ckx2-10及CR-ckx2-11为纯合的突变株系,占突变植株的42.86%。3个纯合植株均为4个碱基缺失的突变体,其中,CR-ckx2-04与CR-ckx2-10突变缺失位点相同,均为GACA缺失,CR-ckx2-11则为ACGA 4个碱基缺失。其余4株为杂合突变,其中CR-ckx2-01植株为缺失与替换并存的突变,CR-ckx2-03则为插入与缺失杂合型(表3)。

表3 黎平杂边禾OsCKX2基因突变位点分析Table 3 Mutation site analysis of OsCKX2 of ‘Lipingzabianhe’
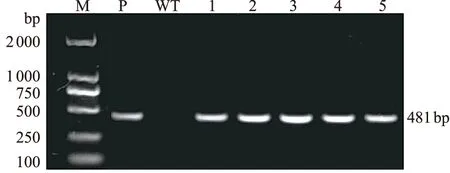
注:M为DL 2 000 bp Marker;P为质粒;WT为野生型黎平杂边禾;1~5为转基因植株。图4 转基因植株的PCR鉴定Fig.4 PCR identification of transgenic plants

注:M为DL 2 000 bp DNA Marker;1~4为转基因植株。图5 靶位点序列扩增产物Fig.5 PCR amplification of target site sequence
2.4 突变体植株农艺性状分析
将获得的CRISPR敲除黎平杂边禾纯合突变体CR-ckx2-11株系的T1代植株于2019年5月种植于农业生物工程研究院转基因植物种植示范基地,成熟期对突变体及野生型植株进行农艺性状调查。结果表明,CR-cks2-11突变体株高、粒宽、粒长、粒厚、千粒重、分蘖数等与野生型相比没有差异,但突变体穗长、穗粒数及单株产量明显增加,其中,穗粒数与单株产量差异达极显著水平。与野生型相比,突变体穗粒数增加16.67%,平均单株产量增加25.03%(表4,图6),获得了产量增加的基因编辑黎平杂边禾突变体新种质。
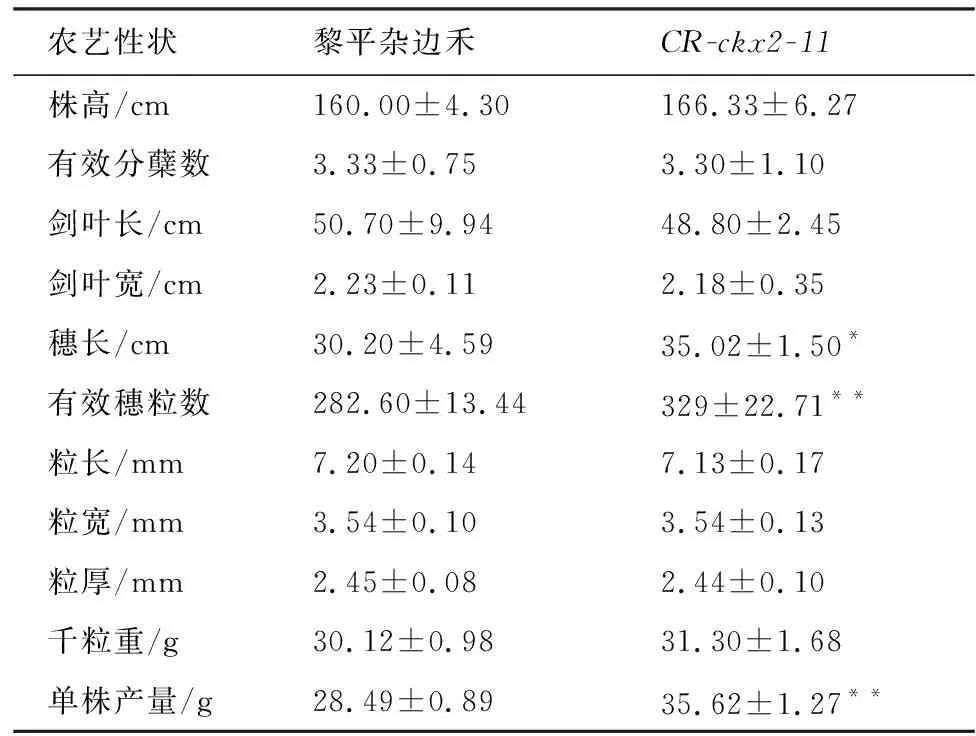
表4 OsCKX2基因敲除植株农艺性状Table 4 Comparsion of agronomic traits between wild and OsCKX2-knocked rice plants

注:A为CR-ckx2-11与野生型穗部性状;B为CR-ckx2-11与野生型籽粒;C为CR-ckx2-11与野生型穗部小穗枝。 图6 OsCKX2基因敲除植株(CR-CKX 2-11)表型 Fig.6 Phenotypic comparison of OsCKX2-knockout rice (CR-CKX 2-11) and wild rice
3 讨 论
与需要多年回交和选种的传统作物育种的方法相比,基因组编辑技术用时较短,突破物种间生殖隔离限制,可对基因组内功能已知的特定DNA序列进行调整,精确到基因组的某个特定碱基对,育种效率可大幅提高。CRISPR/Cas 9系统介导的基因组编辑技术以其精准简单稳定高效等优点,被广泛运用于各类农作物的新品种选育[17]。近年来,应用CRISPR/Cas 9技术在水稻抗病虫害、抗逆性以及各种农艺性状改良方面的研究取得了长足进步[18-19]。
水稻颖花的数量决定了一个有效分蘖上的最大穗粒数。OsCKX2基因表达量的降低或功能缺失,可使细胞分裂素在花序分生组织中累积,从而增加穗粒数,最终提高水稻的产量[7]。本研究设计并构建适用于黎平杂边禾OsCKX2基因定点突变的CRISPR/Cas 9表达载体对目的基因进行定点编辑,获得了穗粒数比野生型黎平杂边禾穗粒数与单株产量增加的突变体植株,表明利用基因编辑技术对贵州禾OsCKX2基因进行定点敲除可以获得产量增加的突变体植株。黎平杂边禾虽然具有优良的食味品质,但其株高较高且易倒伏等原因,导致其产量较低。在前期研究中,对黎平杂边禾株高控制基因OsGA20ox2进行了编辑,并获得了株高半矮化的突变体植株,但这些突变体植株同时也存在穗粒数减少等问题[20]。因此,在之后的研究中可以对这些半矮化的基因编辑植株的OsCKX2基因再进行编辑,以获得OsGA20ox2与OsCKX2基因同时突变的株高半矮化且穗粒数增加的黎平杂边禾新种质。因此,可以利用CRISPR/Cas 9技术对贵州禾材料的OsGA20ox2与OsCKX2基因同时进行编辑,以期获得株高半矮化、穗粒数增加且其他优良性状不变的贵州禾新种质。本研究获得了OsCKX2基因突变的产量提高的水稻新种质,为探索CRISPR/Cas 9技术在贵州地方水稻遗传育种中的应用潜力,以及开发贵州地方稻种优良基因的有效转移和聚合提供新手段,为利用基因编辑技术改良贵州地方水稻提供了技术支持。

