盐胁迫对苦豆子、大豆芽期和苗期生长发育的影响
高子为, 朱有成, 刘雅婧, 杨旭光, 马志鹏, 张鑫生, 刘宇淇,陈彦文, 王庆钰, 闫 帆, 李景文
(吉林大学植物科学学院, 长春 130062)
盐胁迫是制约植物生长发育的主要非生物胁迫之一,在盐胁迫条件下,植物生长状况、发芽情况和产量受到严重影响,许多盐敏感植株无法生长或产量明显下降[1]。目前,我国有盐渍化土壤近1亿hm2,且数值仍在上升[2]。因此,对抗盐植物的筛选和利用研究对盐渍土壤的改良和利用具有重要意义。
植物在不同生长阶段对于不良环境的耐受性以及适应性不同[3],种子萌发期和幼苗期是植物对于盐胁迫最敏感的时期。袁伊旻等[4]研究表明,0.9%NaCl为豆科植物最适的耐盐性鉴定指标。苦豆子(Sophoraalopecuroides)作为豆科植物中耐盐性较强的植物,生长环境多为干旱及荒漠地区,抗盐碱性和抗旱性强[5],不同种属植物的生长环境具有较大差异,造成不同植物之间耐盐性差异巨大[6-7]。大豆W 82作为豆科植物中研究较多的大豆品种,其抗盐性属于中等水平。另外,苦豆子还作为一种药用植物,其中很多生物碱可被提取出来用于疾病治疗,还可用作农药防治病虫害,且苦豆子根系发达,在干旱荒漠地区作为防风固沙植物被广泛种植,防止水土流失[8]。
为了进一步验证苦豆子的耐盐性,探究苦豆子和大豆2个种属之间的耐盐性差异,以不同浓度盐溶液处理苦豆子和大豆种子及幼苗,通过发芽临界浓度以及生理指标检测,进行耐盐性鉴定、评价,为植物耐盐性研究以及苦豆子耐盐性基因的进一步利用提供参考。
1 材料与方法
1.1 试验材料
实验材料选用我国新疆库尔勒苦豆子和中等抗盐水平的大豆品种W 82(Williams 82)。
1.2 试验方法
试验设置盐胁迫(0、0.6%、0.9%、1.2%、1.5%NaCl)5个浓度处理,每个处理3次重复。苦豆子种子在实验前用98%浓硫酸处理10 min,无菌蒸馏水冲洗6~7次后无菌蒸馏水浸泡8~12 h,大豆W 82种子用氯气灭菌处理。选取颗粒饱满、大小均匀的种子,将种子放置在铺有双层滤纸的培养皿中,每皿30粒种子加3 mL处理溶液,大豆W 82每皿20粒种子,加5 mL处理溶液,每24 h各培养皿等量补充处理溶液,报纸和黑布进行遮光处理,置于恒温气候室中。实验开始后每天记录种子发芽数(胚根长度大于种长为发芽标准),连续3 d无种子发芽时结束试验。
盐胁迫对幼苗影响实验采用水培法,4周龄的苦豆子幼苗和大豆W 82幼苗,用蒸馏水轻轻刷洗干净后分别移入配置好的不同盐浓度(1/8×Hoagland和1.0×Hoagland)的营养液中,每日观察幼苗状态,拍照记录。
1.3 测定项目与方法
发芽率(%)=(最终发芽种子总数/供试种子总数)×100%;
发芽势(%)=(发芽胁迫实验第3天正常发芽种子数/供试种子总数)×100%;
CAT活性=[ΔA×V反总/(ε×d)×109]/(W×V样/V样总)/T;
POD活性=[ΔA×V反总/(W×V样/V样总)]/0.01/T;
SOD活性=[抑制百分率/(1-抑制百分率)×V反总]/(W×V样/V样总)×F。
式中:ΔA为吸光度差值;W为样本鲜重;V反总为反应体系总体积;ε为H2O2摩尔吸光系数;d为比色皿光径;V样为加入样本体积;V样总为加入提取液体积;T为反应时间。
苦豆子和大豆胚根用常量生化试剂盒(购自索莱宝科技有限公司)进行POD、CAT、SOD活性检测。
1.4 耐盐性综合评价
以不同盐浓度胁迫下的相对发芽率、相对发芽势为耐盐指标,根据隶属函数值大小综合评价苦豆子和大豆种子的耐盐性,比较两个物种间耐盐性差异[9]。
隶属函数公式:
X(μ)=(X测-Xmin)/(Xmax-Xmin)
式中:X测为测量值,Xmin为测量值中最小值,Xmax为测量值中最大值。
1.5 数据统计及分析
数据用SPSS 19.0软件统计分析,Excel软件作图,各处理间的多因素方差分析以及各处理的单因素方差分析用SPSS软件处理。
2 结果与分析
2.1 不同浓度盐溶液对苦豆子和大豆种子发芽率的影响
不同浓度的盐溶液对苦豆子和大豆W 82种子发芽率影响具有显著性差异(表2)。不同时间段盐溶液处理下的苦豆子和大豆种子发芽率对比发现,苦豆子和大豆发芽率有同样变化趋势,在0.9%盐溶液浓度下苦豆子发芽率为94.52%,大豆W 82种子发芽率为41.67%,在1.2%盐溶液浓度下苦豆子发芽率为68.83%,大豆发芽率为22.50%(图1),盐溶液浓度提高了200 mmol·L-1,苦豆子发芽率下降了29.09%,大豆W 82发芽率下降了77.5%,大豆种子发芽率下降趋势更加明显,表明苦豆子种子发芽阶段耐盐性强于大豆种子(图1、表1)[10-11]。
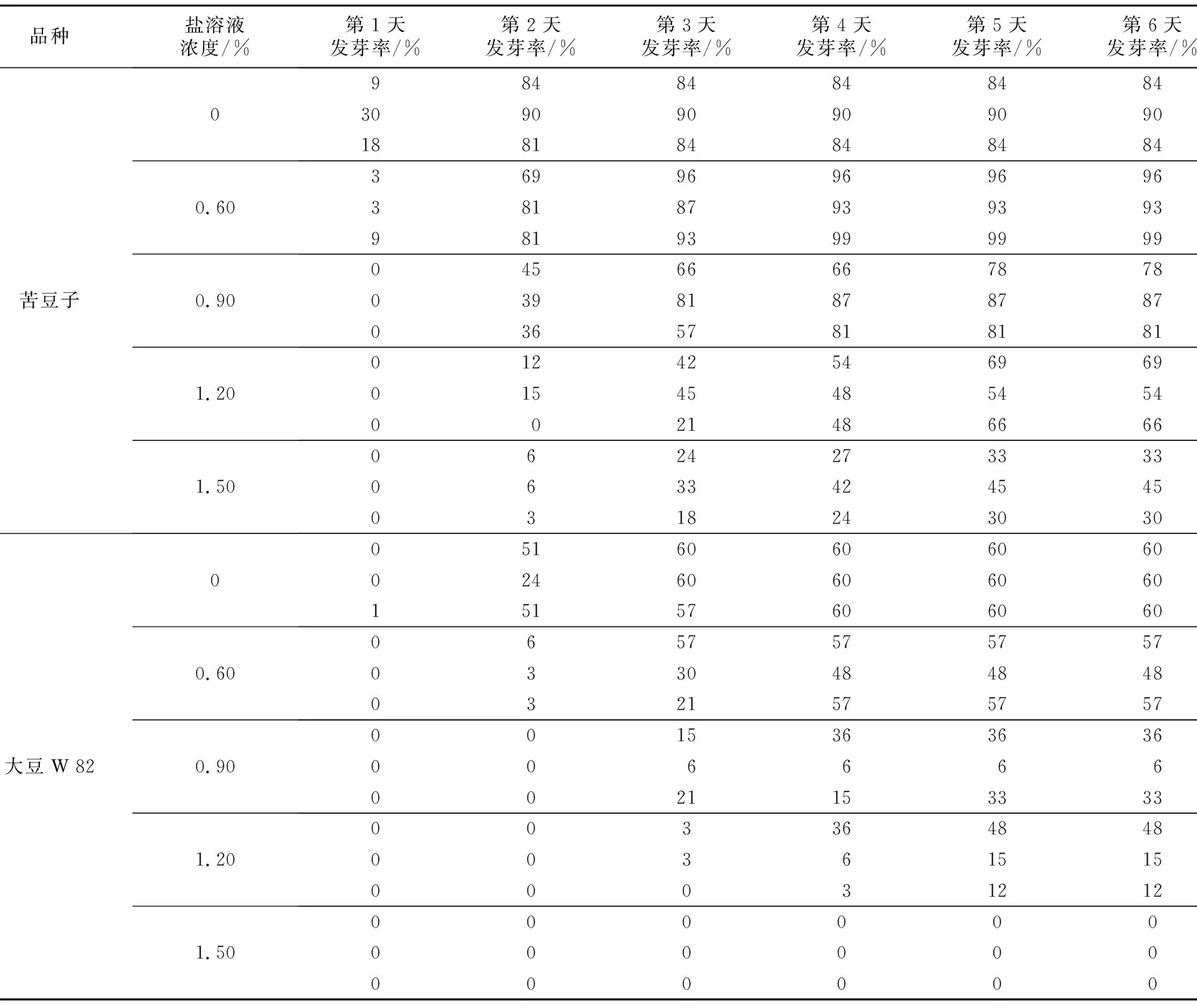
表1 盐胁迫下苦豆子和大豆种子发芽率Table 1 Comparison of germination index between S. alopecuroides and soybean under salt stress

表2 盐胁迫下大豆、苦豆子种子发芽率差异分析Table 2 Variance analysis of seed germination rate of soybean and S. alopecuroides under salt stress
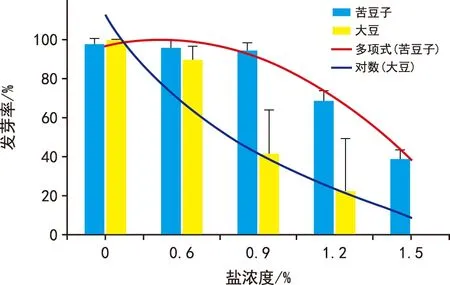
图1 不同盐浓度梯度下苦豆子和大豆种子平均发芽率对比Fig.1 Comparison of average seed germination rate between S. alopecuroides and soybean under different salt concentration gradients
2.2 不同浓度盐溶液对苦豆子和大豆种子发芽势的影响
盐溶液处理3 d后(图2),苦豆子和大豆W 82种子在蒸馏水中发芽势均接近1,随着盐溶液浓度逐渐提高,苦豆子和大豆的发芽势逐渐下降,差值逐渐增大,证明苦豆子抗盐性明显优于大豆W 82[12-13]。
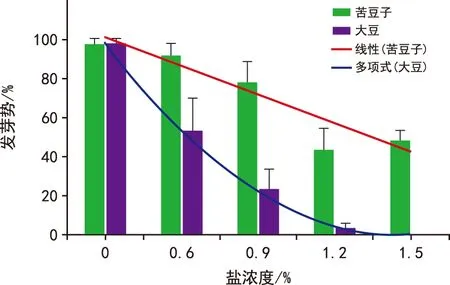
图2 不同盐溶液浓度梯度下大豆和苦豆子种子发芽势对比Fig.2 Comparison of seed germination potential between S. alopecuroides and soybean under different salt concentration gradients
2.3 不同浓度盐溶液对苦豆子和大豆种子芽期生理指标的影响
在植物体中H2O2有双重作用,H2O2在植物体内抗胁迫进程中起着至关重要的作用,适量的H2O2作为胁迫信号,通过诱导一系列防御机制来保护植物细胞免受氧化胁迫,但过量的H2O2导致过氧化损伤,因此植物体内进化出相应的抗氧化机制,SOD、CAT和POD是抗氧化机制中较为重要的3种酶[14-20]。
过氧化氢酶(CAT)在抗氧化机制中通过催化过量的H2O2分解形成H2O,减少植物体内H2O2活性,减轻氧化伤害。随着盐溶液浓度的升高,盐胁迫越来越强,苦豆子和大豆W 82通过增加H2O2活性来抵御盐胁迫环境。但低浓度盐胁迫条件下苦豆子生长不受影响,CAT活性下降,而随着盐胁迫浓度上升,可能苦豆子中存在其他抗盐机制,CAT活性持续下降且低于对照(图3);低浓度盐胁迫下大豆W 82生长受到影响,产生H2O2抵御盐胁迫,CAT活性上升,而高浓度下大豆W 82中CAT活性下降且明显低于对照(图3,表3),可能是大豆在高浓度盐溶液中受到严重伤害[21-22]。

表3 不同浓度盐溶液处理中苦豆子种子CAT活性差异分析Table 3 Variance analysis of CAT activities of S. alopecuroides under salt solution with different concentrations
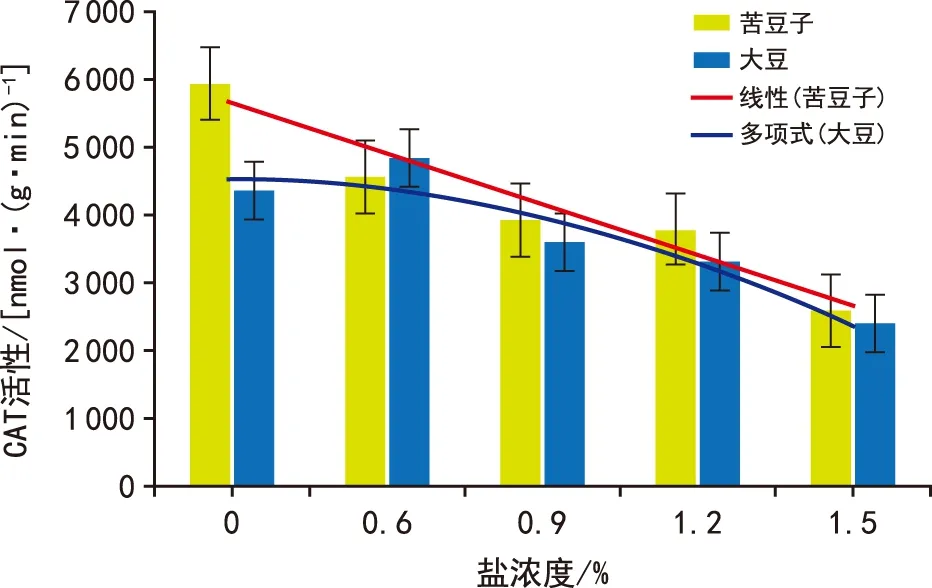
图3 不同浓度盐溶液处理中苦豆子根的过氧化氢酶活性Fig.3 Comparison of CAT activities between S. alopecuroidesand soybean roots under different salt concentration gradients
在抗逆过程中,POD也起着至关重要的作用,POD作用底物是H2O2以及有机过氧化物等,通过促进H2O2的反应,减少H2O2的积累,防止H2O2带来的过氧化效应对植物造成伤害。在抗逆过程中POD同时参与植物组织构建,将组织中的碳水化合物转化为木质素,使植物体的木质化程度增加,减少外界盐离子进入,进而提高植物抵抗外界压力的能力。
不同浓度盐溶液处理后,经试剂盒检测和紫外分光光度计测量吸光度,最终数据分析得到不同浓度梯度下苦豆子和大豆W 82胚根中POD活性和趋势图(图4),盐溶液低浓度条件下,苦豆子中POD活性下降,且随着盐溶液浓度上升,苦豆子中POD活性逐渐增加。各浓度梯度处理下POD活性之间有显著差异(表4),证明POD在苦豆子抵抗外界盐胁迫过程中起着重要作用[23-24]。

图4 不同浓度盐溶液处理下苦豆子和大豆W 82种子过氧化物酶活性Fig.4 Comparison of POD activities between S. alopecuroides and soybean W 82 under different salt concentration gradients

表4 不同浓度盐溶液处理下苦豆子种子POD活性差异分析Table 4 Variation analysis of POD activities of S. alopecuroides seeds under different concentrations of salt solution
低浓度盐胁迫条件下,苦豆子生长受到盐胁迫影响小,SOD活性下降,在高浓度盐胁迫条件下,可能存在其他抗盐机制,苦豆子SOD活性持续下降,最终低于对照;低浓度盐胁迫下大豆W 82生长受到影响,为了响应盐胁迫环境,SOD活性上升,但高浓度下大豆W 82中SOD活性下降且明显低于对照(图5),可能是大豆W 82种子受到严重伤害。不同浓度盐处理条件下苦豆子和大豆W 82种子中SOD活性差异显著(表5)[25]。

表5 不同浓度盐溶液处理下苦豆子种子SOD活性差异分析Table 5 Variation analysis of SOD activities of S. alopecuroides seeds under different concentrations of salt solution

图5 不同浓度盐溶液处理下苦豆子种子SOD活性Fig.5 Comparasion of SOD activities of S. alopecuroides seeds under different concentrations of salt solution
2.4 不同浓度盐溶液对苦豆子和大豆幼苗期的影响
选取4周龄苦豆子和大豆W 82幼苗进行水培实验,将幼苗移栽至不同浓度Hoagland营养液中,以此探究苦豆子和大豆幼苗能够稳定生长的最适浓度。经过多次实验,最终确定苦豆子幼苗在1/8×Hoagland营养液中生长状况最为稳定,大豆幼苗在1.0×Hoagland营养液中生长状况稳定。
24 h处理下苦豆子幼苗和大豆W 82幼苗均可以正常生长,低浓度下大豆W 82幼苗和苦豆子幼苗之间并无明显差异,但高浓度盐胁迫下的大豆W 82幼苗已经出现发黄现象(图6),同期处理下苦豆子幼苗虽然出现萎蔫情况,但生长状况并未受到明显影响(图7),长势良好。

图6 24 h内不同浓度盐溶液处理下大豆幼苗生长状况Fig.6 Comparison of growth status of soybean seedlings treated with different concentrations of salt within 24 h

图7 24 h内不同浓度盐溶液处理下苦豆子幼苗生长状况Fig.7 Comparison of growth status of S. alopecuroides seedlings treated with different concentrations of salt within 24 h
72 h盐溶液处理下的苦豆子和大豆W 82幼苗均开始出现萎蔫现象,盐溶液浓度高于0.9%处理下的大豆幼苗开始死亡,0.6%浓度盐溶液处理下的大豆W 82幼苗也开始出现发黄干枯现象(图8);大豆W 82根系生长受到盐溶液影响,根系生长状况差;苦豆子在高浓度盐溶液处理下,也开始出现萎蔫现象,长势受阻,但萎蔫程度远低于大豆,大于0.9%盐溶液处理下仍能够生长,根系生长状况良好,不造成死亡现象(图9)。实验探究得到苦豆子在营养液中盐处理临界浓度为1.2%,高于大豆的临界浓度(0.9%)[26-27]。

图8 不同浓度盐胁迫72 h大豆幼苗生长状况Fig.8 Comparison of growth status of soybean seedlings under different concentration of salt stress for 72 h

图9 72 h不同浓度盐胁迫下苦豆子幼苗生长状况Fig.9 Comparison of growth status of S. alopecuroides seedlings under different concentration of salt stress for 72 h

表6 苦豆子和大豆W 82幼苗生长状况Table 6 Statistics of growing status of S. alopecuroides and soybean W 82
盐溶液处理下的大豆和苦豆子幼苗生长状况随时间和盐溶液浓度而改变,24 h处理下苦豆子和大豆W 82幼苗都能够正常生长,并未表现出显著差异。但在72 h处理下,苦豆子幼苗和大豆W 82幼苗抗盐性存在差异,同浓度盐溶液处理下苦豆子幼苗生长状况明显好于大豆W 82幼苗。结果表明,苦豆子幼苗耐盐性强,苦豆子幼苗的抗盐能力远高于大豆W 82幼苗。
2.5 苦豆子和大豆W 82萌发期和幼苗期耐盐性综合评价
根据不同浓度盐胁迫下的苦豆子和大豆W 82种子的平均发芽率、平均发芽势对苦豆子和大豆W 82种子的耐盐性进行综合评价分析,结果表明,苦豆子种子抗盐性强于大豆W 82种子;以不同浓度盐溶液中苦豆子和大豆幼苗生长状况为指标对苦豆子和大豆W 82幼苗的耐盐性进行对比,结果表明,苦豆子幼苗抗盐性强于大豆W 82幼苗。
3 讨 论
3.1 高浓度盐胁迫对苦豆子和大豆发芽率的影响
盐胁迫是影响种子发芽率和幼苗生长的一种主要非生物胁迫,在盐胁迫条件下种子发芽率和幼苗生长均会受到一定程度的影响。盐胁迫最初通过渗透压调节造成植物体失水,随着时间增加,盐胁迫危害方式转变成离子毒害。发芽临界浓度是衡量植物耐盐性的指标。实验结果表明,苦豆子发芽临界浓度为1.2%,高于大豆W 82种子发芽临界浓度(0.9%)。临界浓度的不同可能与植物的生长环境有关,新疆库尔勒苦豆子生长在盐碱、干旱地区,而大豆W 82生长在正常环境条件下,这可能是苦豆子耐盐性强于大豆W 82的原因之一[28]。
今后应改变苦豆子的生长环境,将库尔勒苦豆子栽种到正常环境下,每年观察苦豆子的临界发芽浓度是否改变,以此探究苦豆子的耐盐性是否与生长环境有关;研究苦豆子的耐盐机理,确定苦豆子中耐盐基因,为改良大豆耐盐性提供一定的参考依据。
3.2 高浓度盐胁迫对苦豆子抗氧化酶活性的影响
本研究发现,盐胁迫下苦豆子抗氧化酶活性发生变化,其中CAT、SOD活性持续下降,POD活性先下降后上升,且低于对照。Pramod等[29]研究表明,肉桂酸诱导了玉米中CAT活性下降,POD活性上升,本实验得到的抗氧化酶变化趋势总体与玉米中抗氧化酶活性变化趋势相同,玉米中抗氧化酶受肉桂酸调控,所以苦豆子中抗氧化酶活性变化可能与肉桂酸活性有关,但仍需进一步探究。宋苗苗[30]研究表明,紫花苜蓿在盐溶液处理下CAT活性下降;段才绪等[31]研究表明,决明种子在盐胁迫条件下CAT、SOD活性下降且低于对照。盐胁迫下苦豆子中CAT、SOD活性变化趋势与决明和紫花苜蓿趋势相似,但在低浓度盐溶液下决明种子的CAT、SOD活性上升,本实验结果与之不同,可能是物种间耐盐机理不同造成的差异。
4 结论与展望
苦豆子种子发芽和幼苗生长临界浓度均为1.2%,胚根的SOD、 CAT活性持续下降,POD活性先下降后上升,但高浓度下POD活性仍低于对照。
大豆W 82种子发芽临界浓度为0.6%,幼苗生长临界浓度为0.9%,胚根的POD、CAT、SOD活性均先上升后下降且低于对照。
苦豆子的抗氧化酶活性变化趋势相较于大豆更加平稳,可能与二者抗盐性不同有关,低浓度下苦豆子受盐胁迫影响小,抗氧化酶含量下降,而大豆W 82抗氧化酶活性上升,是因为低浓度下大豆W 82受到盐胁迫影响。发芽率和抗氧化酶活性对比表明,苦豆子芽期的抗盐性强于大豆W 82;幼苗期大豆W 82和苦豆子的表型分析表明,苦豆子幼苗期的抗盐性也强于大豆W 82。
苦豆子和大豆同属豆科,生理生化反应类似,研究苦豆子芽期和苗期的耐盐性对进一步培育大豆耐盐新品种具有一定的参考意义,并为研究大豆的抗逆机理,改变大豆的抗盐性提供了一定的理论依据。

