新型冠状病毒灭活疫苗研发及应用
邓涛,年悬悬,张家友,黄仕和,杨晓明
1.武汉生物制品研究所有限责任公司,湖北武汉430207;2.国家联合疫苗工程技术研究中心,湖北 武汉430207;3.中国生物技术股份有限公司,北京100029
过去十几年,因重症急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARSCoV)及中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)感染引起的呼吸道传染病的流行,使冠状病毒成为21世纪新的公共卫生问题[1]。2019年12月,中国武汉报告了一种伴随不明原因发热的呼吸道疾病病例,随后通过病毒分离鉴定为一种由新型冠状病毒引起的肺炎[2]。国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)将该病毒命名为重症急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2),世界卫生组织(WHO)将其引起的疾病命名为新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)[3]。COVID-19已演变为全球大流行,截至2021年5月30日,全球已有超过1.69亿的确诊病例和超过351.91万的死亡病例[4]。接种疫苗是预防控制COVID-19大流行最有效的措施之一。灭活疫苗一直是疫苗的重要研发方向,已被广泛用于狂犬病、流感、脊髓灰质炎、霍乱等疾病的预防。目前,全球范围内至少有9种COVID-19全病毒灭活疫苗已进入Ⅲ期临床试验,其中武汉生物制品研究所有限责任公司(简称武汉生物)、北京生物制品研究所有限责任公司(简称北京生物)及北京科兴生物制品有限公司(简称科兴生物)的3种COVID-19灭活疫苗已在多个国家授权使用[5-6]。
本文对SARS-CoV-2的特征以及COVID-19灭活疫苗研发的毒种与细胞基质选择、生产工艺、临床前与临床研究、对突变株的保护作用和未来面临的挑战作一综述。
1 SARS-CoV-2的特征
冠状病毒为单股、正链RNA病毒,具有球形包膜,直径为100~160 nm[7],可感染蝙蝠、猪、猫、啮齿动物和人类等多个物种[8]。与人类相关的冠状病毒有7种:HCoV-NL63、HCoV229E、HCoV-OC43、HKU1、SARS-CoV、MERS-CoV和SARS-CoV-2,其中前4种仅引起轻度的上呼吸道症状,而后3种是引起严重呼吸系统疾病的高致病性冠状病毒[7]。SARS-CoV-2、SARS-CoV和MERS-CoV均属于冠状病毒科β冠状病毒属,具有极高的致病性和传染性。SARS-CoV-2和SARS-CoV与几种蝙蝠冠状病毒密切相关[9],在COVID-19疫情早期阶段,从5名患者身上获得的全基因组序列与SARS-CoV序列相似性为79.6%[2]。尽管遗传证据表明,SARS-CoV-2是一种可能起源于动物的自然病毒,但目前尚不清楚这种病毒首次感染人类的时间及地点[10]。SARSCoV-2基因编码的蛋白包括S、M、E白和N蛋白4种主要结构蛋白。S蛋白的同源三聚体构成病毒表面的棘突,在病毒的附着、融合和侵入中起关键作用,也是目前开发疫苗及治疗的靶点[11]。此外,研究表明,SARS-CoV-2 S蛋白的受体结合域(receptor binding domain,RBD)与血管紧张素转换酶(angiotensin converting enzyme,ACE2)受体的结合能力比SARS-CoV高10~20倍,这可能使SARS-CoV-2比SARS-CoV具有更高的传染性[12]。与SARS-CoV和MERS-CoV相比,SARS-CoV-2的传播速度似乎更快[13],且不断发现新的传染性更强的病毒突变株,COVID-19的预防控制显然比SARS-CoV和MERSCoV难度更大。
2 疫苗毒种与细胞基质选择
灭活疫苗研制的首要任务是筛选毒株。理想情况下,应收集不同地区不同来源的病毒分离株,比较各种病毒株在遗传稳定性、免疫原性、交叉保护性以及细胞中的传代适应性等,从中选择免疫原性强、交叉保护范围广、能稳定传代的毒株用于灭活疫苗生产。WANG等[14]从3名COVID-19住院患者中分离出3株SARS-CoV-2毒株HB02、CQ01和QD01,其中HB02株在Vero细胞中复制最为理想,产毒量最高。全基因组序列比较发现,HB02株与其他毒株具有同源性,主要保护抗原(S蛋白)同源性为100%,表明其对各种SARS-CoV-2毒株具有广泛的保护作用。因此,北京生物使用HB02株进行COVID-19灭活疫苗的生产。武汉生物则选择从武汉金银潭医院1名肺炎患者支气管肺泡灌洗液中分离出的SARS-CoV-2原始毒株(WIV04)作为灭活疫苗毒种,并在Vero E6细胞中进行分离培养[15-17]。科兴生物从11名住院患者(5名来自中国,3名来自意大利,1名来自瑞士,1名来自英国,1名来自西班牙)支气管肺泡灌洗液样本中分离出SARS-CoV-2,并选择具有良好遗传稳定性的CN2株作为疫苗生产毒株[18]。印度Bharat Biotech公司从COVID-19患者分离出包含D614G突变的病毒株NIV-2020-770用于研发灭活疫苗[19-20]。
其次,选择易感、稳定传代、高效增殖及具有遗传稳定性的细胞基质也是研发灭活疫苗的关键因素。常用于病毒疫苗生产的细胞基质有鸡胚成纤维细胞、Vero细胞、二倍体细胞、MDCK细胞及CHO细胞等。WANG等[21]评估了常用于分离培养病毒的细胞系对SARS-CoV-2的敏感性,发现猴肾细胞最敏感,包括来自于非洲绿猴肾的Vero细胞系、Vero76细胞系和BGMK细胞系,以及来自恒河猴肾的LLCMK2细胞系、RhMK细胞系,但来自人类、狗、猫、鼠和鸡的多种细胞类型对SARS-CoV-2不敏感,同时最常用于流感病毒研究的MDCK细胞对SARS-CoV-2也不敏感。武汉生物、北京生物、科兴生物以及印度Bharat Biotech公司等众多企业生产的COVID-19灭活疫苗均选择Vero细胞作为传代培养细胞。WHO已对Vero细胞进行了疫苗生产认证[14]。
3 灭活疫苗的生产工艺
全病毒灭活疫苗的生产工艺一般包括病毒扩增、病毒灭活和分离纯化3个主要阶段。武汉生物制备COVID-19灭活疫苗的主要步骤包括:使用SARS-CoV-2 WIV04株在Vero细胞中进行传代培养,在细胞病变效应(cytopathic effect,CPE)出现的第3~4天收集上清液,采用β-丙内酯灭活48 h后进行澄清、超滤,进行第2次β-丙内酯灭活后,经凝胶层析、离子交换层析、除菌过滤后加入氢氧化铝佐剂制备灭活疫苗[15,17]。北京生物通过将SARSCoV-2 HB02株接种Vero细胞,经培养、收获、灭活、澄清、浓缩、纯化后,加入氢氧化铝佐剂制备灭活疫苗[14]。中国医学科学院医学生物学研究所(简称医科院生物所)对收获的病毒上清液用甲醛进行灭活,色谱法进行纯化浓缩,并使用β-丙内酯进行二次灭活,再次纯化和浓缩制备灭活疫苗[22]。
在过去几十年中,已经研发出多种用于疫苗生产的培养工艺,包括转瓶、细胞工厂及生物反应器等培养工艺。目前,大多疫苗生产企业均采用生物反应器培养替代传统的转瓶或细胞工厂培养工艺。基于生物反应器的疫苗生产的主要优势包括:使用封闭系统,可有效避免污染风险;生产流程及过程自动化程度高,可减少人为操作因素的影响,提高疫苗各批次的一致性和稳定性;通过监测培养参数控制细胞生长和病毒复制来实现产量最大化,降低了运营成本及生产时间[23]。基于生物反应器培养一般分为微载体、片状载体及悬浮细胞培养。北京生物研发了自主知识产权的蜂窝交联片状载体,其相同培养体积的细胞密度较微载体高10余倍,极大提高了COVID-19灭活疫苗的产量[14]。
灭活疫苗的灭活方法包括化学灭活或物理灭活,前者如β-丙内酯、乙烯亚胺和甲醛灭活,后者如γ辐射、紫外光和加热灭活。这些方法的作用机制主要是通过共价修饰、交联、氧化和结构改变对病原体的蛋白质和核酸结构进行化学修饰,使处理的病毒不能感染靶细胞或在机体内复制[24]。甲醛和β-丙内酯作为最常用的灭活剂,广泛用于人用灭活疫苗的生产,如对脊髓灰质炎病毒、流感病毒等均显示出较好的灭活效果。烷化剂和双氧水也可用于病毒灭活[25],但目前仍处于临床前研究阶段。目前报道的SARS-CoV-2全病毒灭活疫苗最常见使用 β-丙内酯进行灭活[15,18],武汉生物和科兴生物生产的疫苗还采用了二次β-丙内酯灭活策略;医科院生物所生产的疫苗先经甲醛灭活后,再采用β-丙内酯进行第2次灭活策略。RAGAN等[24]报道了一种新的灭活方法来制备灭活疫苗,即使用核黄素结合紫外照射来改变病毒核酸结构,该方法制备的SARS-CoV-2全病毒灭活疫苗在仓鼠的攻毒模型中具有保护作用。与常规用于灭活疫苗生产的β-丙内酯灭活剂不同的是,该方法中使用的核黄素具有良好的安全性,并且没有致突变性和致癌性,同时避免了烷基化、交联和共价修饰[26]。KARAKUS等[27]使用γ射线灭活的SARS-CoV-2疫苗(OZG-3861-01),在BALB/c小鼠体内可诱导具有中和能力的抗体产生,并且未观察到抗体依赖增强效应(antibody dependent enhancement,ADE)。佐剂的应用对灭活疫苗也非常重要,其能增强机体对抗原的免疫应答或改变免疫应答类型,减少抗原用量。目前至少10家企业计划研发含佐剂的COVID-19疫苗,包括葛兰素史克公司的AS03、Seqirus公司的MF59和Dynavax公司的CpG 1018[28],而几种候选灭活疫苗均选择较为常用的氢氧化铝作为佐剂。见表1。

表1 COVID-19候选灭活疫苗制备的比较Tab.1 Preparations of candidate inactivated COVID-19 vaccines
灭活病毒收获液通常除含有病毒颗粒外,还含有宿主细胞及残留蛋白/核酸、培养基成分和引入的外来物质如灭活剂等。如果疫苗制剂中含有杂质过多,则极有可能增加过敏等不良反应风险。因此,在生产灭活疫苗时需要进行纯化。灭活疫苗通常采用的纯化工艺包括超滤、层析、过滤等,病毒是否被彻底灭活是生产工艺研究的重点,需对灭活条件进行充分的研究及验证,同时应考虑灭活程序对疫苗抗原含量、效价等的影响。
4 临床前研究
疫苗的临床前研究多基于动物模型评价免疫原性及安全性。小型动物如大鼠、小鼠、家兔和仓鼠可用于对候选疫苗的安全性、免疫原性和剂量进行初步评估,而大型动物尤其是非人灵长类动物(nonhuman primates,NHPs)则是评估疫苗保护效力的理想模型,其中恒河猴是公认为研发SARS-CoV-2疫苗的理想动物模型[30]。几种候选灭活疫苗的NHPs模型见表2。SARS-CoV和MERS-CoV的中和抗体具有保护作用,但也有研究发现SARS-CoV和MERSCoV存在ADE现象[31-32]。ADE是一种非中和抗体与病毒结合,通过Fcγ受体或补体受体介导的导致疾病增强现象[32-34]。有研究认为冠状病毒的S和N蛋白具有能够引起ADE的抗原表位,同为冠状病毒的SARS-CoV-2是否引起ADE也备受关注[35-36]。临床前研究的安全性评价一般在动物模型中进行免疫后攻毒试验,检测动物保护效力以及有无抗体介导的免疫病理反应。目前4种类型的COVID-19候选疫苗包括灭活疫苗、mRNA疫苗、蛋白亚单位疫苗和腺病毒载体疫苗的动物模型中均未观察到明显的免疫病理损伤或ADE现象[14-15,18,29,37-43],见表2。虽然这4种类型的候选疫苗在接种和SARS-CoV-2攻击动物的肺中未显示免疫病理学变化的证据,但在人体身上是否产生免疫病例损伤有待进一步研究。
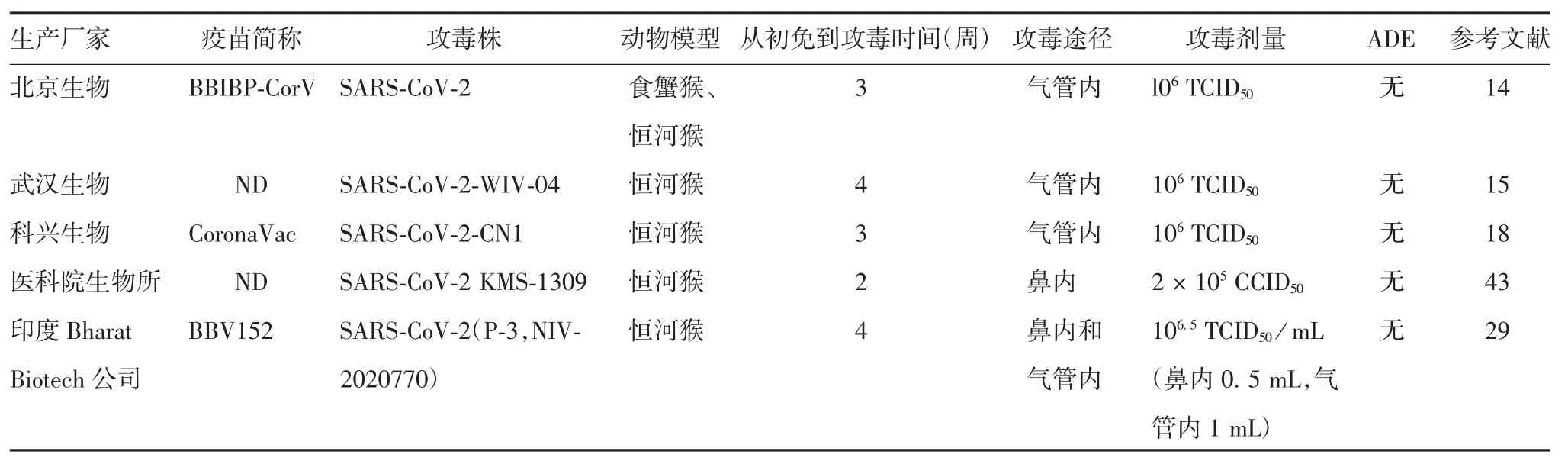
表2 COVID-19灭活疫苗的NHPs模型试验比较Tab.2 NHIPs model tests on inactivated COVID-19 vaccine
5 临床研究
一种新疫苗的研发周期较长,需经过临床前的动物试验以及严格的临床试验,这对于保证疫苗的安全性及有效性是必要的。目前,全球范围内至少有24种COVID-19灭活疫苗在研发,其中有15种进入临床研究阶段[5],见表3。在COVID-19灭活疫苗研发进程中,中国处于全球领先地位,在获得紧急使用或附条件上市的4种COVID-19灭活疫苗中,中国占据其中3种,见表4。

表3 全球进入临床阶段的COVID-19候选灭活疫苗Tab.3 Candidate inactivated COVID-19 vaccines in clinical trials worldwide
5.1 北京生物COVI D-19灭活疫苗 国家药品监督管理局于2020年12月30日附条件批准了北京生物研发的COVID-19灭活疫苗(BBIBP-CorV)的注册申请,在此之前,阿联酋和巴林已相继批准该疫苗注册上市[44]。Ⅰ/Ⅱ期临床试验在中国河南省进行,其中Ⅰ期纳入18~80岁健康人群共192人,Ⅱ期纳入18~59岁健康人群共448人,BBIBP-CorV在两个年龄组的所有试验剂量下安全性和耐受性均良好,在第42天,所有疫苗接种者体内均诱导了针对SARS-CoV-2的体液免疫应答[45-46]。Ⅲ期临床试验为随机、双盲、安慰剂对照的多中心临床研究,13 086人完成了2剂次注射,自第2剂接种后14 d,累计确诊21例有效病例,疫苗保护效力为78.1%。接种后7 d内严重不良事件59例,报告发生率为0.4%,严重不良事件发生率与仅接种氢氧化铝佐剂组(严重不良发生事件78例,报告发生率0.6%)相似,显示出该疫苗良好的安全性[47]。目前,该研究仍在进行中,长期保护性和安全性仍在评估中。
5.2 科兴生物COVI D-19灭活疫苗 科兴生物研发的COVID-19灭活疫苗克尔来福®(CoronaVac),于2021年2月6日经国家药品监督管理局批准附条件上市,目前,在32个国家授权紧急使用[48]。该疫苗Ⅰ期和Ⅱ期临床试验同时进行,针对不同年龄健康人群分别开展临床试验,18~59岁健康人群纳入744名志愿者,60岁以上健康人群纳入422名志愿者。该公司于2020年6月14日进行Ⅰ/Ⅱ期临床试验揭盲,初步结果显示,CoronaVac具有良好的安全性和免疫原性[49]。Ⅲ期临床试验中期结果表明,该疫苗具有良好的保护效力,巴西、土耳其、智利还提供了针对住院病例的保护效力临床数据。该疫苗对巴西和土耳其住院病例的保护效力均为100%;对智利住院病例的保护效力为85%。在巴西,CoronaVac预防症状性感染有50.4%的保护效力,预防严重病例有100%的保护效力;安全性方面,接种该疫苗后大多数不良事件为轻度 /中度[48,50]。
5.3 武汉生物COVI D-19灭活疫苗 国家药品监督管理局于2021年2月25日批准了该疫苗附条件上市申请。该疫苗是全球首个进入临床试验的SARSCov-2灭活疫苗。Ⅰ/Ⅱ期临床试验是在18~59岁健康成人中进行的一项随机、双盲、安慰剂对照试验,Ⅰ期和Ⅱ期临床试验分别纳入96和224名志愿者。结果显示,不同剂量疫苗组均诱导了高滴度抗体,2剂接种后中和抗体阳性率达100%,无严重不良事件发生[17]。在阿联酋、巴林、秘鲁、摩洛哥、阿根廷等国家进行的Ⅲ期临床试验中,疫苗组完成第2剂注射的志愿者共13 066人,自第2剂接种后14 d,累计确诊26例有效病例;2针免疫程序接种后,中和抗体阳转率超过99%,针对由COVID-19的保护效力为72.8%。接种后7 d内严重不良事件64例,报告发生率为0.5%,不良事件发生率与对照组无显著差异,显示出该疫苗良好的安全性[47]。
5.4 医科院生物所COVI D-19灭活疫苗 该疫苗于2020年5月15日正式启动Ⅰ期和Ⅱ期临床试验。在Ⅰ/Ⅱ期临床试验评估了该疫苗在18~59岁健康成人的安全性及免疫原性,Ⅰ期和Ⅱ期分别招募192和750名志愿者[51-52]。Ⅰ期临床试验数据显示,2剂次接种后,不同剂量组血清转换率均超过87.5%,未观察到与免疫病理相关的细胞因子和免疫细胞[53]。Ⅱ期临床试验数据显示,不同试验组内检出高滴度的中和抗体和抗S/N蛋白抗体,在研究期间未报告与疫苗接种相关的严重不良事件[52]。目前,该种疫苗正在进行Ⅲ期临床试验[5]。
5.5 康泰生物COVI D-19灭活疫苗 该疫苗由深圳康泰生物制品有限公司(简称康泰生物)和北京民海生物技术有限公司研发的一款SARS-CoV-2灭活疫苗(KCONVAC)。Ⅰ/Ⅱ期临床试验均在18~59岁健康成年人中进行,Ⅰ期和Ⅱ期分别招募60和500名志愿者。在Ⅰ期和Ⅱ期临床试验中,除了报道的1例与疫苗无关的严重不良事件外,未有其他严重不良反应报道,2剂次后,耐受性良好,能够在健康成人中诱导强烈的的免疫反应,目前正在进行Ⅲ期临床试验[54]。
5.6 印度Bharat Biotech公司COVI D-19灭活疫苗印度Bharat Biotech公司开发的COVID-19灭活疫苗(BBV152)是进入临床试验的第5种灭活疫苗[55],也已被批准在印度紧急使用。在印度11家医院进行双盲、多中心、随机、对照的Ⅰ期临床试验,排除SARS-CoV-2核酸和/或血清学检测阳性的个体,共纳入375名18~55岁健康成人;Ⅰ期临床试验结果显示,BBV152具有可接受的安全性和较强的免疫反应,可产生较高中和抗体滴度,期间报告了1例与疫苗无关的病毒性肺炎的严重不良事件[19,56]。Ⅱ期临床试验受种人群扩大到12~65岁健康人群,共380名志愿者参与;Ⅱ期临床试验结果显示了良好的免疫原性、安全性以及强烈的体液和细胞介导的免疫反应,研究中未报告严重的不良事件[56]。
5.7 其他COVI D-19灭活疫苗 除了上述COVID-19候选灭活疫苗,全球还有多款灭活疫苗正在开发中,包括哈萨克斯坦生物安全问题研究所、法国Valneva公司、伊朗Shifa Pharmed Industrial公司、土耳其Erciyes大学、泰国政府制药组织、日本KM Biologics公司、伊朗防御创新与研究组织等单位研发的COVID-19灭活疫苗相继进入临床研究阶段,见表4。

表4 紧急使用或附条件上市的COVID-19灭活疫苗Tab.4 Inactivated COVID-19 vaccines for emergency use or conditional marketing
6 对突变株的保护作用
随着大流行持续蔓延,出现了多种SARS-CoV-2变异株。值得注意的是,最近出现的SARS-CoV-2变异株可能会影响疫苗保护效力,而引发全球公众担忧。2020年首次在美国发现的包含D614G的突变株,显著增强了病毒传播能力,并逐渐在流行病毒株中占据主导地位[57]。最近从南非分离的B.1.351变突株在D614G株上引入了进一步突变,这些突变可逃避COVID-19康复者以及一些疫苗受试者的血清中和作用[58]。据报道,诺华(Novartis)、强生(Johnson)和阿斯利康(AstraZeneca)生产的COVID-19疫苗针对B.1.351变突株的保护作用均有下降[59]。在南非的一项Ⅲ期临床试验中,发现B.1.351突变株显著降低了SARS-CoV-2 S蛋白疫苗的保护效力[14]。突变株的传播给通过接种疫苗预防及控制SARSCoV-2大流行带来了巨大挑战,相继出现的突变株是否影响灭活疫苗的效力同样令人担忧。
HUANG等[60]评估了COVID-19灭活疫苗BBIBPCorV对突变株的影响,与原始SARS-CoV-2和目前流行的D614G病毒株相比,BBIBP-CorV在很大程度上保留了对B.1.351突变株的中和作用,这些数据表明,B.1.351变突株不能逃脱灭活疫苗诱导的免疫。最近CHEN等[61]评估了COVID-19灭活疫苗CoronaVac接种者血清对B.1.1.7,B.1.351,P.1,B.1.429和B.1.526突变株的中和活性,共研究了93份CoronaVac接种者血清,发现76份(82%)血清样本能够中和野生型假病毒,接种后血清中和D614G、B.1.1.7和B.1.429突变株假病毒同样有效;然而对B.1.526、P.1、B1.351血清中和效率显著降低,对B.1.526血清中和效率降低了4.03倍(95%CI 3.26~4.80),对P.1降低了3.92倍(95%CI 3.18~4.65),对最受关注的南非突变株B1.351降低了5.27倍(95%CI 4.19~6.34);此外,仅有一小部分疫苗接种后血清能够中和B.1.526(26%)、P.1(34%)和B.1.351(5%)。
7 COVID-19灭活疫苗的应用及面临挑战
在COVID-19疫苗研发中,疫苗企业同步开展生产车间建设,对缓解疫苗安全量产的压力非常必要。国药集团中国生物在北京和武汉已经建立或正在扩建高等级安全生产车间,预计COVID-19灭活疫苗年产量将超过40亿剂[44,62]。2021年5月7日,WHO总干事谭德塞宣布,北京生物研发生产的COVID-19灭活疫苗获得紧急使用授权,纳入全球“紧急使用清单”,为实现COVID-19疫苗作为全球公共产品特别是在发展中国家的可及性和可负担性迈出了重要一步。mRNA疫苗临床研究的成功,将是疫苗制备技术的历史性、革命性突破,但mRNA疫苗本身不稳定,需低温和超低温运输及储存,而灭活疫苗4℃条件即能满足储存及运输。常规、成熟技术、利用现有储运接种系统的灭活疫苗,可及性强,特别适合分发于发展中国家。
多种灭活疫苗的开发及应用,为日趋严峻的COVID-19疫情防控带来希望。灭活疫苗工艺成熟,免疫原性稳定,安全性良好,可及性高,但一些关于灭活疫苗的潜在挑战也备受关注:①有报道COVID-19在老年人和其他疾病患者的死亡率更高[63],因此灭活疫苗在老年、儿童、基础性疾病等低免疫力人群的保护效力备受关注;②随着多种SARS-CoV-2突变株的出现,灭活疫苗能否对突变株具有有效的保护也备受关注;③COVID-19康复期患者血清中产生中和抗体反应,但抗体水平在一定时间内达到峰值后逐渐降低[64],提示疫苗诱导产生的特异性免疫反应可能随时间延长而减弱,面对COVID-19疫情并未减弱的情况下,灭活疫苗的长期有效性有待进一步研究;④灭活疫苗的安全性以及安全生产也至关重要,2004年有报道在灭活SARS-CoV后第3天检测出活病毒[65],提示COVID-19灭活疫苗应特别需要关注灭活效果;⑤目前已有多种病毒被观察到ADE现象,包括登革病毒、西尼罗河病毒、人类免疫缺陷病毒、埃博拉病毒等[66],COVID-19灭活疫苗是否在人体引起ADE也有待进一步研究;⑥灭活疫苗通常表现出中等的免疫原性,需要应用佐剂来增强免疫原性,但佐剂的应用通常也增加了不良反应的风险;⑦灭活疫苗相对安全稳定,但接种1剂通常不产生具有保护作用的免疫反应,且免疫效果维持时间较短,需多次接种和加强免疫,目前进入临床阶段COVID-19灭活疫苗均采用2剂接种策略,COVID-19灭活疫苗最终需要接种几剂次也有待于进一步研究。

