lncRNA CASC9通过调控miR-424-5p/SOX9分子轴对食管鳞状细胞癌细胞恶性生物学行为的影响
郑华山,陈成辉,蔡亲平,林献科,李 合
(海南医学院a.第二附属医院东湖外科,海口 570311;b.第一附属医院普通外科,海口570102)
食管癌是第八大常见肿瘤,癌症死亡率居第六位[1]。食管癌有2种主要的组织学类型,即腺癌和鳞状细胞癌。食管鳞状细胞癌(ESCC)是我国食管癌患者的主要患病类型,5年成活率低[2]。长链非编码RNA(lncRNA)是长度大于200 nt的RNA分子[3],其在各种生理、病理发展过程中发挥着重要作用,其中癌症易感性候选基因9(CASC9)对各种肿瘤细胞的发生发展起重要作用。有研究[4]发现,lncRNA在结直肠癌中表达上调并促进结直肠癌发展,lncRNA还参与头颈部癌症的转移[5]。microRNA(miRNAs)是单链非编码小RNA片段,通过与mRNA靶标的3′端未翻译区域序列特异性相互作用而发挥抑制翻译的作用并调控转录后的基因表达,参与多种肿瘤进程。miR-424-5p具有抑癌作用,抑制食管癌细胞侵袭转移以及调控食管癌细胞的G1/S和G2/M细胞周期转变[6-7]。有研究[8]表明,lncRNA-miRNA-mRNA相互作用与癌症的发生发展密切相关。但是lncRNA-miR-424-5p共表达网络在食管鳞癌中发挥的作用暂且未知。本研究构建lncRNA、miRNA、mRNA调控和共表达网络,探讨lncRNA CASC9通过调控miR-424-5p/SOX9分子轴对食管鳞状细胞癌细胞恶性生物学行为的影响,为食管鳞状细胞癌的治疗提供新方法。
1 材料与方法
1.1 材料
1.1.1 标本来源
收集2017年3月至2020年3月在海南医学院第二附属医院手术切除的40例食管鳞状细胞癌患者癌组织标本和35例癌旁正常组织标本。术前所有患者均知晓该研究,并签署知情同意书,术后立即将肿瘤组织和配对的癌旁组织液氮储存。入选标准:1)符合食管癌诊疗规范(2018年版)食管鳞癌诊断标准;2)在本院进行食管鳞癌切除术,食管鳞癌肿瘤标志物呈阳性患者;3)能够并愿意遵守研究方案操作。排除标准:1)不同意采集标本的患者;2)有影响实验结果解释的其他恶性肿瘤史的患者;3)有免疫系统疾病的患者。
1.1.2 试剂
食管鳞状细胞癌细胞系(KYSE150、KYSE450、EC109、EC9706)以及正常人食管鳞状上皮细胞株(Het-1A)来自于上海中国科学院细胞库;DMEM高培养基(美国Gibco公司),RNA提取试剂盒、反转录试剂盒(日本Takara公司),si-CASC9质粒、si-SOX9质粒(北京擎科生物有限公司),miRNA-424-5p mimics(Genepharma公司),CCK-8试剂盒(上海碧云天生物科技有限公司),Transwell室(美国HyClone公司),一抗、二抗(英国Abcam公司),Cell Cycle试剂盒(美国Millipore&Billerica公司)。
1.2 细胞培养
将KYSE150、KYSE450、EC109、EC9706及Het-1A细胞置于DMEM高培养基(含10%胎牛血清、100 U·mL-1青霉素、100 mg·mL-1链霉素)中,37 ℃、5% CO2的饱和湿化培养箱中常规培养。
1.3 RT-qPCR检测组织和细胞系中CASC9和miR-424-5p的表达
RNA提取试剂盒提取细胞中的总RNA,使用反转录试剂盒将CASC9和miR-424-5p分别转录为cDNA,取适量cDNA配置PCR反应体系。采用GAPDH作为内参,检测CASC9和miR-424-5p相对表达量。反应体系总量20 μL。cDNA产物2 μL、上下游引物各0.5 μL(10 μmol·L-1)。反应条件:95 ℃预变性5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。测定模板的Ct值,循环数法(2-ΔΔCt)定量相对表达量。引物序列如表1。
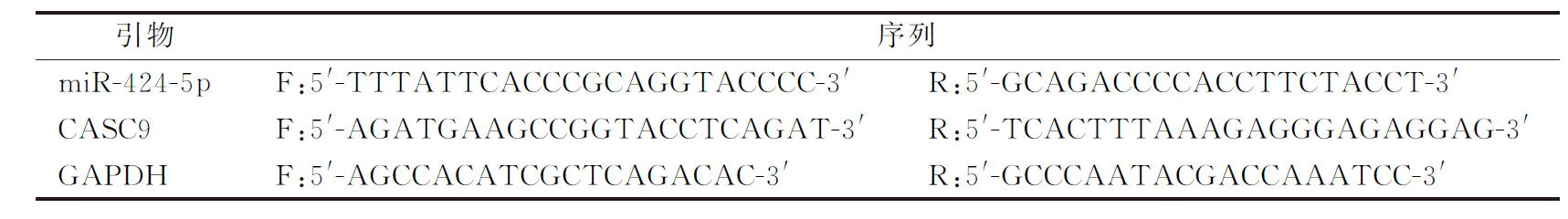
表1 引物序列
1.4 细胞转染
选用对数生长期KYSE450细胞进行细胞转染实验,使用胰酶消化后,接种至6孔板中,每孔含2 mL细胞悬液(1×105个细胞),培养24 h。随后,按照LipofectamineTM 2000试剂盒说明书将si-CASC9、miRNA-424-5p mimics、miRNA-424-5p mimics+CASC9、miRNA-424-5p mimics+SOX9以及CASC9+si-SOX9转染到KYSE450细胞中,48 h后在荧光显微镜下观察转染效果。
1.5 CCK-8检测KYSE450细胞增殖活力
采用CCK-8法检测细胞增殖能力。将对数生长期的KYSE450细胞和转染后的细胞接种于96孔板,每孔含细胞悬液100 μL,将培养板置于37 ℃、5%CO2的培养箱内孵育1~4 d,并于每天同一时间在每孔分别加入10 μL CCK-8试剂,使用酶标仪测定在450 nm处的吸光度,按照CCK-8试剂盒说明书分析细胞活力。实验重复3次。
1.6 Transwell检测KYSE450细胞侵袭能力
根据制造商的指示使用Transwell室(孔隙大小8 μm)。细胞生长至亚融合(约75%~80%),血清饥饿24 h。胰蛋白酶分离后,PBS洗涤细胞,在无血清培养基中复苏。接下来,100 μL细胞悬液(5×104cells·mL-1)添加到上室。将基质凝胶涂层添加到小室的底部。24 h后,使用棉签将没有侵袭的细胞从过滤器的表面去除,侵袭的细胞用5%戊二醛溶液固定,以确定侵袭细胞的数量。滤光片的下表面用0.25%台盼蓝染色。采集每个膜上6个不同视野的图像(×40),统计侵袭细胞数,并计算侵袭细胞的数量。实验重复3次。
1.7 Western blotting检测周期相关蛋白及SOX9蛋白表达情况
收集各组待检验KYSE450细胞,PBS缓冲液冲洗3次,分别加入RIPA细胞裂解液裂解细胞,BCA法测定蛋白浓度。每组取50 μg进行10%SDS-PAGE电泳分离蛋白条带,根据Marker切取目的条带,将目的条带转移至PVDF膜上,随后用5%脱脂奶粉封闭1.5 h,一抗(1:1500)4 ℃孵育过夜。弃去一抗,TBST洗涤3次后加入二抗(1:2000)室温孵育2 h,TBST再次清洗3次后进行ECL染色,随后在凝胶成像仪上观察,实验重复3次。Image J软件分析蛋白条带。
1.8 双荧光素酶报告基因验证miR-424-5p与CASC9或SOX9的靶向关系
将野生型CASC9和突变型CASC9分别插入pmirGLO报告载体。利用Lipofectamine 2000将miR-424-5p模拟物与野生型CASC9或突变型CASC9共转染。转染48 h后,在双荧光素酶报告基因检测系统上测定相对荧光素酶活性。同法转染SOX9,测定相对荧光素酶活性。数据表示为肾荧光素酶活性与萤火虫荧光素酶活性的比值。
1.9 流式细胞仪检测KYSE450细胞周期
收集各组待检验KYSE450细胞,1 mL 0.25%胰酶消化后加入PBS终止消化,移液枪轻轻吹打细胞使细胞悬浮,细胞悬液转入离心管中,1500 r·min-1离心5 min收集细胞,弃去上清液。随后加入3 mL 4 ℃预冷的PBS完全重悬细胞,1500 r·min-1离心5 min,弃上清,沉淀震荡混匀。随后用-20 ℃ 75%乙醇固定细胞,4 ℃固定过夜。次日,加入2 mL PBS混匀,1500 r·min-1离心5 min收集细胞,PBS重悬,离心收集细胞,随后用100 μL PBS重悬细胞。加入2 μL RNaseA(1 mg·mL-1),37 ℃水浴40 min。随后加入100 μL PI染色液,避光染色20 min,所有操作按照Cell Cycle试剂盒说明书进行。使用流式细胞仪测定G1、S期细胞百分比。
1.10 统计学方法
数据采用SPSS 19.0统计软件进行处理分析,采用t检验或单因素ANOVA法分析计算2组样本或多组样本间的差异显著性。以P<0.05为差异有统计学意义。
2 结果
2.1 CASC9在ESCC组织及细胞系中高表达
RT-qPCR检测结果显示,CASC9在ESCC组织中的表达为(0.26±0.47),明显高于癌旁组织的(0.09±0.45)(P<0.01,图1A)。CASC9在EC109、EC9706、KYSE150、KYSE450中的表达分别为(0.54±0.71)、(1.25±0.33)、(2.04±0.39)、(3.08±0.84),均显著高于Het-1A细胞的(0.23±0.38),且在KESE450中表达最高(P<0.01,图1B)。
2.2 敲降CASC9抑制KYSE450细胞增殖、侵袭,阻滞细胞周期G1/S期
RT-qPCR检测结果显示,与对照组(NC组)比较,敲降CASC9(si-CASC9组)能显著降低CASC9在KYSE450细胞中的表达(P<0.01,图2A);CCK-8法检测结果显示,与NC组比较,敲降CASC9可显著抑制KYSE450细胞增值活力(P<0.01,图2B);Transwell实验结果显示,与NC组比较,敲降CASC9可显著抑制KYSE450细胞侵袭能力(P<0.01,图2C—D);流式细胞仪检测结果显示,与NC组比较,敲降CASC9可显著上调G1期细胞数,下调S期细胞数(P<0.01,图2E);Western blotting检测结果显示,与NC组比较,敲降CASC9明显下调了KYSE450细胞中G1期和S期细胞周期蛋白(CCND1、CCNA、CDK4、CDK6)的表达(P<0.01,图2F—G)。由此可知,敲降CASC9可降低CASC9在KYSE450细胞中的表达水平,显著抑制KYSE450细胞增殖和侵袭,并诱导细胞G1/S期阻滞。
2.3 lncRNA CASC9靶向调控miR-424-5p/SOX9分子轴
通过生物信息学数据库Starbase V2.0预测miR-424-5p可能是lncRNA CASC9的靶基因,其预测序列见图3A。双荧光素酶报告基因实验结果显示,过表达miR-424-5p使荧光素酶活性降低(P<0.01,图3B),而共转染miR-424-5p mimics和靶向位点发生突变的pmirGLO-CASC9-MUT载体,miR-424-5p对荧光素酶活性的抑制作用丧失(P>0.05,图3B),由此可知miR-424-5p是lncRNA CASC9的靶基因。RT-qPCR检测结果显示,敲降CASC9可明显上调miR-424-5p表达水平(P<0.01,图3C),表明miR-424-5p是lncRNA CASC9的靶基因。
生物信息学数据库Starbase V2.0预测miR-424-5p的靶基因,发现SOX9是miR-424-5p的候选靶基因,其结合序列如图3D。双荧光素酶报告基因实验结果显示,过表达miR-424-5p使荧光素酶活性降低(P<0.01,图3E),而共转染miR-424-5p mimics和靶向位点发生突变的pmirGLO-SOX9-MUT载体,miR-424-5p对荧光素酶活性的抑制作用丧失(P>0.05,图3E);Western blotting检测结果显示,与对照组相比,过表达miR-424-5p抑制SOX9的表达(P<0.01,图3F—G)。由此可知SOX9是miR-424-5p的靶基因。
2.4 lncRNA CASC9通过调控miR-424-5p/SOX9分子轴影响KYSE450细胞恶性生物学行为
Western blotting检测结果显示,单独过表达miR-424-5p抑制SOX9在KYSE450细胞中的表达(P<0.01),回复组(miRNA-424-5p mimics+CASC9组、miRNA-424-5p mimics+SOX9组及CASC9+si-SOX9组)显著回复单独过表达miR-424-5p对SOX9表达的抑制作用(P<0.01),回复组与NC组SOX9表达水平比较差异无统计学意义(P>0.05),见图4A—B。CCK-8和Transwell实验结果显示,单独过表达miR-424-5p显著抑制KYSE450细胞增殖和侵袭(P<0.01),而回复组则显著下调单独过表达miR-424-5p对KYSE450细胞增殖和侵袭的抑制作用(P<0.01),见图4C—E。流式细胞仪检测结果显示,单独过表达miR-424-5p显著上调G1期细胞数(P<0.01),下调S期细胞数(P<0.01),而回复组则显著下调单独过表达miR-424-5p对细胞G1期和S期的调控作用(P<0.01),见图4F—G。Western blotting结果显示,单独过表达miR-424-5p显著抑制周期蛋白(CCND1、CCNA、CDK4、CDK6)表达(P<0.01),而回复组则显著下调单独过表达miR-424-5p对周期蛋白的抑制作用(P<0.01),见图4H—L。以上结果表明,lncRNA CASC9可以通过靶向下调miR-424-5p对SOX9表达的抑制作用,进而抑制KYSE450细胞增殖,侵袭,并调控细胞周期。
3 讨论
ESCC在亚洲国家占食管癌患者的90%,且发病率一直在上升,我国是世界上食管癌高发地区之一[9]。在亚洲和西方国家,新辅助化疗或新辅助放化疗加食管癌切除术已成为局部晚期食管鳞癌的标准初始治疗方法。虽然新辅助化疗和新辅助放化疗已逐步改善,但由于局部复发、淋巴结转移和远处转移,局部晚期ESCC 5年生存率仍为37%~55%[10]。因此,找寻新的方法抑制ESCC细胞的增殖、侵袭具有重要意义。
lncRNA包括一类长度>200 nt的转录本,不作为蛋白质合成的模板[11]。lncRNA信号在异常表达时参与肿瘤发生,与肿瘤行为和预后相关[12]。大量研究[13-16]表明,CASC9对各种肿瘤细胞的发生发展起重要作用。CASC9在口腔鳞癌组织中高表达,通过激活AKT/mTOR通路抑制自噬,促进肿瘤发生发展[13]。CASC9在胃癌组织中高表达,促进细胞生长,对胃癌中的紫杉醇和多柔比星产生耐药[14]。CASC9在体外促进胶质瘤的发生,还参与细胞侵袭转移的分子水平[15]。CASC9促进了血管瘤的细胞生长和侵袭,为血管瘤的诊断和分子治疗提供了新的思路[16]。上述研究提示CASC9能够作为癌基因参与调控癌症的发展。本研究采用RT-qPCR实验发现CASC9在食管鳞状细胞癌细胞株(KYSE150、KYSE450、EC109、EC9706)中的表达量不同,笔者猜想CASC9在食管鳞状细胞癌细胞株中的表达高低可能存在细胞特异性,但笔者重点关注的是CASC9在ESCC组织中高表达,且在食管鳞状细胞癌细胞株表达水平均高于Het-1A细胞,提示CASC9的异常表达可能与ESCC发展有关。进一步通过CCK-8、Transwell实验检测ESCC细胞的生物学功能,发现敲降CASC9显著抑制ESCC细胞增殖和侵袭,这与之前的研究结果一致,说明CASC9在ESCC发展中也发挥了明显的促癌作用。
细胞周期运转在细胞维持正常生命活动的过程中发挥关键作用,当细胞周期运转出现异常时,细胞往往会发生癌变。细胞进入增殖周期后会激活CDK4/CDK6等蛋白激酶,与Cyclin D1结合形成具有活性的复合体,使细胞从G1期进入S期。在此过程中,CDK4/CDK6失活后,会使细胞周期阻滞在G0/G1期,诱导细胞癌变。而CCND1、CCNA、CCNB1等细胞周期调节因子也在细胞周期运转过程中发挥重要作用。本研究发现敲降CASC9显著抑制ESCC细胞增殖、侵袭,进一步检测细胞周期,发现下调CASC9明显诱导细胞周期阻滞。说明下调CASC9通过使细胞中CCND1、CCNA、CDK4和CDK6表达下调,阻碍细胞周期正常运转,促进细胞癌变。研究表明microRNAs(miRNAs)通过阻断一组或多组mRNA的翻译或促进其降解来调节细胞表型,在正常生理和病理条件下是细胞表型的关键调控因子[17]。越来越多的学者发现研究[18-20]发现miR-424-5p与各种癌症的发展密切相关。如miR-424-5p在肝癌细胞中显著下调,病理分级越高、TNM分期越晚的患者miR-424-5p表达水平越低[18]。miR-424-5p通过针对SMAD3/TGF-β信号通路促进胃癌细胞增殖[19]。miR-424-5p在卵巢癌组织和细胞系中表达下调,并通过E2F1-pRB通路靶向CCNE1调控卵巢癌的增殖、细胞周期[20]。本研究通过双荧光素酶报告基因实验验证miR-424-5p是CASC9的靶基因,随后发现敲降CASC9明显增强miR-424-5p的表达水平,结果提示CASC9通过靶向和负调节miR-424-5p进一步调控了ESCC细胞的增殖和侵袭。
SOX9是性别决定区Y家族成员,控制广泛的转录程序的建立,与细胞增殖、细胞外基质沉积和上皮-中央区(ETM)转化中的发育作用有关[21-22]。LEUNG等[23]的研究结果表明,SOX9在肝癌组织中高表达,SOX9转录水平的上调与肿瘤细胞分化较差、静脉侵犯、肿瘤晚期和总生存期较短有关,并通过Wnt/β-catenin通路赋予干细胞特性。本研究通过双荧光素酶报告基因实验验证SOX9是miR-424-5p的靶基因,并通过CCK-8、Transwell法和Western blot法发现lncRNA CASC9可以通过靶向下调miR-424-5p对SOX9表达的抑制作用,进而抑制KYSE450细胞增殖、侵袭,并调控细胞周期。
综上,lncRNA CASC9可通过抑制miR-424-5p/SOX9分子轴的表达,抑制ESCC细胞增殖、侵袭,并调控细胞周期,可能作为食管鳞状细胞癌患者治疗的新型靶点,值得进一步深入研究。

