不同类型水稻土微生物群落结构特征及其影响因素*
王晓洁,卑其成,刘 钢,谢祖彬†
(1. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2. 中国科学院大学,北京 100049)
土壤是微生物的大本营,通常每克土壤中含有约十亿个微生物细胞。目前,自然界中绝大多数微生物难以被分离培养,这极大地限制了人们对环境微生物生物多样性及其功能的认识[1-2]。近年来,高通量测序技术的飞速发展极大地推动了人们对微生物世界的认知。
国内外学者对森林、草地、农田等不同生态系统中土壤微生物的多样性开展了广泛研究[3-7]。大量的研究表明土壤微生物群落组成及其丰度受到多种因素的影响,如环境的理化性质(土壤pH、碳氮比、含水量)、地上植被类型、外界气候因素(降雨量、温度)和自然因素(海拔、纬度)[8-13]。土地利用方式的改变、施肥方式和耕作方式的改变也会影响土壤微生物群落结构及丰度的变化[14-18]。
水稻土是长期水稻种植并且在翻耕和水肥管理措施下形成的一类独特的土壤资源。水稻土发生、发展和发育过程,同样也离不开土壤微生物的参与[19]。我国是世界上最主要的稻米产区之一,从南到北分布的水稻土类型复杂多样。根据第二次土壤普查数据统计,我国水稻土共分为潴育、淹育、渗育、潜育、脱潜、漂洗、盐渍及咸酸水稻土8个亚类,共114个土属。研究发现,生活在水稻根际的土壤微生物,有的可以通过生物固氮作用为植株提供氮素,有的可以分泌铁载体活化铁元素,有的可以分泌生长激素促进植物生长[20]。因此,了解水稻土中微生物资源状况对维持土壤的生产力具有重要的现实意义。
本研究选取基于我国土壤地理发生分类的不同类型土壤发育的四种水稻土,利用15N2气体示踪法测定生物固氮速率,通过提取稻田土壤总DNA,借助高通量测序Illumina Hiseq平台,以16S rRNA基因为分子标靶,揭示四种类型水稻土中细菌群落的数量、组成及多样性,分析细菌群落结构与土壤理化性质的相关关系,分析影响土壤细菌群落结构差异的关键因子。
1 材料与方法
1.1 供试土壤及理化性质测定
本研究供试土壤为:(1)下位砂姜土发育的水稻土,(2)红壤发育的水稻土,(3)黑土发育的水稻土,(4)紫色土发育的水稻土。于2014年4月分别在江苏江都(32°35′48″N,119°42′49″E)、江西鹰潭(28°12′28″N,116°56′13″E)、吉林长春(44°04′16″N,125°44′16″E)和四川盐亭(31°16′14″N,105°28′27″E)四个省份的长期种植水稻的稻田采集耕作层土壤(0~15 cm)。风干过2 mm筛,去除根系及石子等,室温保存。土壤基本理化指标测定参照《土壤农业化学分析方法》[21]。pH采用酸度计法(土水比1︰5)测定,有机碳采用重铬酸钾容量法测定,碱解氮采用碱解扩散法测定,有效磷采用碳酸氢钠浸提-钼锑抗比色法测定,速效钾采用乙酸铵浸提-火焰光度计法测定。
1.2 土壤固氮菌固氮速率测定
采用同位素标记15N2气体示踪法,将水稻盆栽密闭于智能植物生长箱,定量计算单位时间单位面积土壤中固氮菌固定的氮量[22]。每个盆钵(12 cm×12 cm×20 cm)内种植1株水稻(武运粳23),装土2.6 kg。以4种水稻土类型为4个处理,并设置3份重复。42 d后,采集土壤样品(0~1 cm、1~2 cm、2~5 cm、5~15 cm),取一份土样烘干后用于测定土壤全氮的含量及15N atom%丰度,另一份土样于-20℃保存,用以土壤DNA提取。
1.3 土壤DNA提取
准确称取0.5 g鲜土样,采用FastDNA Spin kit for soil(MP Biomedicals,Cleveland,OH,USA)试剂盒和FastPrep-24核酸提取仪(MP Biomedicals,CA,USA),按照操作手册提取土壤样品的DNA。经1 %琼脂糖凝胶电泳测定DNA质量,ND-1000 UV-Vis 微量紫外/可见分光光度计(NanoDrop ND-1000,NanoDrop Technologies,Wilmington,USA)测定DNA纯度和浓度,然后将提取的DNA保存于-20℃备用。
1.4 实时荧光定量PCR
采用实时荧光定量PCR法在Applied Biosystems®7500 Real-Time PCR system定量PCR仪(Applied Biosystems,Foster,CA,USA)上测定不同类型水稻土细菌的16S rRNA基因拷贝数。扩增引物为细菌通用引物341F(CCTACGGGAGGCAGCAG)/518R(ATTACCGCGGCTGCTGG),反应体系为16 μL,主要包括:模板DNA 8 μL,引物各0.5 μL,SYBR Green 7 μL。构建目的基因标准质粒,计算目的基因拷贝数,以10倍稀释法建立标准曲线。扩增程序:95℃预变性10 min;95℃变性10 s;60℃退火34 s;72℃延伸45 s,40个循环,并采集分析溶解曲线。实时荧光定量PCR标准曲线的扩增效率为93.0%,R2=0.99。
1.5 16S rRNA基因的高通量测序
利用细菌通用引物341F(CCTACGGGAGGCA GCAG)/518R(ATTACCGCGGCTGCTGG)对样品DNA的16S rRNA的V3区域进行扩增,扩增条件:95℃,3 min;25循环×(95℃,30 s;55℃,30 s;72℃,30 s);72℃,5 min;在4℃下保存,进行普通PCR扩增。将PCR产物用磁珠AMPure XP beads(Beckman Coulter Genomics,Danvers,MA,USA)纯化后进行加Nextera XT Index测序标签的普通PCR扩增,扩增条件:95℃,3 min;8循环×(95 ℃,30 s;55℃,30 s;72℃,30 s);72℃,5 min;在4 ℃下保存,PCR产物再次用磁珠纯化,将构建好的每个DNA样品的文库按照DNA定量试剂盒Qubit dsDNA HS Assay Kit说明书在荧光定量仪(Qubit 2.0 Fluorometer)上测定浓度,均一化后等体积混合,将混合好的文库在2%普通琼脂糖凝胶上电泳,电压120 V,电泳60 min。在紫外透射仪上用刀片将相应的目标片段切割下来,利用胶回收试剂盒(Qiagen MinElute Gel Extraction Kit)进行回收纯化。最终构建好的文库在Illumina Hiseq 2500测序仪上机测序,测序读长为2×250 bp。Hiseq文库的构建及测序在中国科学院上海植物逆境生物学研究中心基因组学平台完成。
1.6 数据处理
Hiseq测序得到的结果采用Quantitative Insights Into Microbial Ecology(QIIME,version 1.9.0)、Mothur等软件分析。首先对原始FASTQ文件进行质控、拼接,然后将拼接后的序列进行过滤,去除嵌合体序列。基于97%相似度水平,通过聚类分析获得不同可操作分类单元(operational taxonomic unit,OTU)。进一步抽取每个OTU的最优势序列作为代表性序列,与RDP提供的SILVA128数据库进行比对并获得分类信息。采用Mothur软件计算多样性指数。使用R软件基于Bray-Curits距离算法进行聚类分析。采用非度量多维尺度(Non-metric multidimensional scaling,NMDS)分析样品间群落结构差异。采用SPSS 20.0对数据进行皮尔森相关性分析(Pearson correlation)和单因素方差分析(One-way ANOVA),差异显著性检验采用Tukey法(P<0.05)。
2 结 果
2.1 四种类型水稻土的理化性质及生物固氮能力
本试验中,红壤发育的水稻土pH最低,与其他三种类型土壤发育的水稻土相比,具有较高的有机碳、碱解氮和有效磷含量(表1)。四种类型的水稻土经过42 d的田间原位15N2培养后,计算所得其土壤生物固氮速率如图1所示。四种水稻土的生物固氮速率由大到小依次为:紫色土、下位砂姜土、黑土和红壤。其中,紫色土发育的水稻土生物固氮作用最为活跃,尤其在土壤表层(0~1 cm)其生物固氮速率达3.2±0.7 mg·kg-1·d-1,并且显著高于其他三个土壤层次检测到的生物固氮速率(图1)。
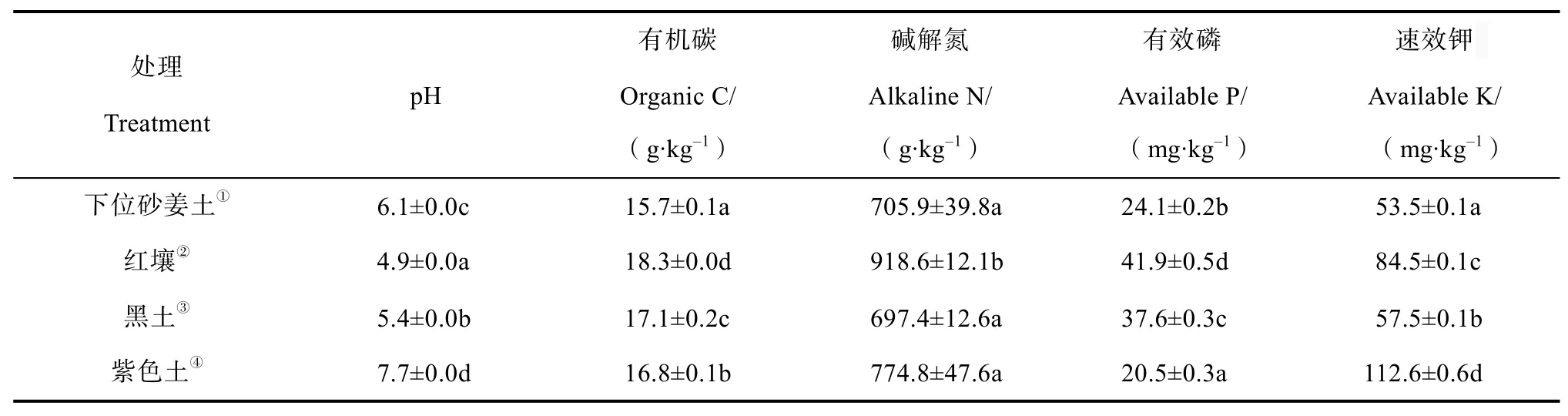
表1 四种类型水稻土的理化性质Table 1 Physico-chemical properties of the four types of paddy soils
2.2 四种类型水稻土的细菌丰度和群落多样性
针对生物固氮速率最高的表层土壤(0~1 cm),采用实时荧光定量PCR测定不同类型水稻土微生物16S rRNA基因拷贝数,结果见图2。四种类型水稻土中的细菌丰度范围在1.8×107~6.7×109copies·g-1干土。其中,红壤发育的水稻土中细菌16S rRNA基因拷贝数最多,达(6.7±1.7)×109copies·g-1干土,显著高于其他三种水稻土(P<0.05)。
Illumina高通量测序结果显示,12个土壤样品共获得有效序列666 738条,可分为13 097个OTU。每个测序样品平均序列55 562±9 298条。根据样品最少序列数,将12个样品统一抽样至38 715条序列进行下游分析。操作分类单元OTU数目和Chao 1指数反映物种丰富度。由表2可知,下位砂姜土发育的水稻土中土壤细菌Chao 1指数最高,达7 095±88。OTU数目与Chao 1指数显示相同的趋势,即下位砂姜土发育的水稻土中细菌OTU数目显著高于其他三种土壤发育的水稻土(P<0.05)。红壤和紫色土发育的水稻土中细菌OTU数目和Chao 1指数均未达显著差异。PD指数可反映土壤细菌群落的多样性,四种水稻土中土壤细菌多样性由高到低依次为:下位砂姜土、黑土、紫色土、红壤。

表2 四种类型水稻土细菌丰富度指数与多样性指数Table 2 Richness and diversity of the bacterial communities in the four types of paddy soils
2.3 四种类型水稻土的细菌群落组成
在门分类水平,四种类型水稻土的土壤微生物群落组成相似(图3)。相对丰度≥1%的门类有11个,主要包含变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、蓝藻门(Cyanobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes),约占各样品序列总数的97%。相对丰度<1%的门类约有40个,仅占各样品序列总数的3%左右(图3)。
变形菌门(Proteobacteria)是土壤中最为优势的菌群,相对丰度占30%左右。其次是酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和蓝藻门(Cyanobacteria)。这四大优势类群共占总细菌群落的70%以上。进一步分析土壤细菌群落在属水平的分布,结果表明相对丰度≥1%的菌属中最为优势的6个类群,主要是归属于变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和蓝藻门(Cyanobacteria)(图4)。其中,厌氧黏细菌属(Anaeromyxobacter)在紫色土发育的水稻土中的相对丰度显著低于其他三种水稻土(P<0.05)。细鞘丝藻属(Leptolyngbya)在紫色土发育的水稻土中相对丰度最高,约为红壤发育的水稻土的6倍,其相对丰度显著高于红壤发育的水稻土(P<0.05)(图4)。
2.4 环境因子对水稻土的细菌丰度、群落多样性及结构的影响
通过分析四种类型土壤发育的水稻土中细菌的丰度与土壤理化性质的关系,发现16S rRNA基因拷贝数与土壤有机碳、碱解氮和有效磷含量则呈极显著正相关(P<0.01)(表3)。通过分析四种类型土壤发育的水稻土中细菌群落的物种丰富度和多样性指数与土壤理化性质的关系,发现OTU数目、Chao 1指数和PD指数均与土壤有机碳和碱解氮含量存在极显著的负相关性(P<0.01)(表3)。表明土壤有机碳和碱解氮含量显著影响水稻土中细菌丰度和群落多样性。利用非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)对四种类型水稻土的细菌群落的相似性进行二维排序,结果表明四种类型水稻土的细菌群落结构差异显著(Stress<0.001)(图5)。相关性分析表明细菌群落结构分异的NMDS1主轴(解释度42%)与土壤pH呈显著的正相关关系(P<0.01)(表3),并且NMDS1主轴与优势类群厌氧黏细菌属(Anaeromyxobacter)和细鞘丝藻属(Leptolyngbya)显著相关(P<0.05)(表4)。表明土壤pH影响水稻土中优势类群的分布,是影响细菌群落结构分异的主要因子。
3 讨 论
本研究采用高通量测序技术对四种不同类型土壤发育的水稻土中土壤细菌丰度和群落结构进行了分析研究。前人研究表明,土壤有机碳含量能显著影响土壤微生物的多样性和功能[23]。土壤微生物是构成土壤肥力的重要因素。较高的微生物丰度通常意味着土壤的营养供给充足,同时也具有较高的微生物活性。在本研究中,水稻土中细菌16S rRNA基因拷贝数与土壤有机碳和碱解氮含量之间呈极显著正相关关系(r=0.76,P<0.01;r=0.74,P<0.01)(表3)。红壤发育的水稻土中的土壤细菌16S rRNA基因拷贝数显著高于其他三种水稻土(图2)。针对江西长期定位试验的红壤性水稻土的研究表明,长期施肥可增加土壤养分含量(如有机质、全氮、有效磷和速效钾),这在一定程度上能够给土壤微生物带来更多的碳源和营养元素[24-25]。前人研究发现施用化肥及有机肥与化肥配施均显著提高了土壤细菌丰度[26]。在四种水稻土中,红壤发育的水稻土的土壤有机碳、碱解氮和有效磷含量显著高于其他三种类型水稻土(表1)。本研究中所采集的红壤为长期水稻种植区的耕层土壤,长期耕种施肥提升了红壤肥力,为微生物创造了良好的生存环境,进而刺激了微生物的生长和活动。因此,推测红壤肥力较高可能是本研究中红壤发育的水稻土中细菌丰度显著高于其他三种水稻土的重要原因之一。
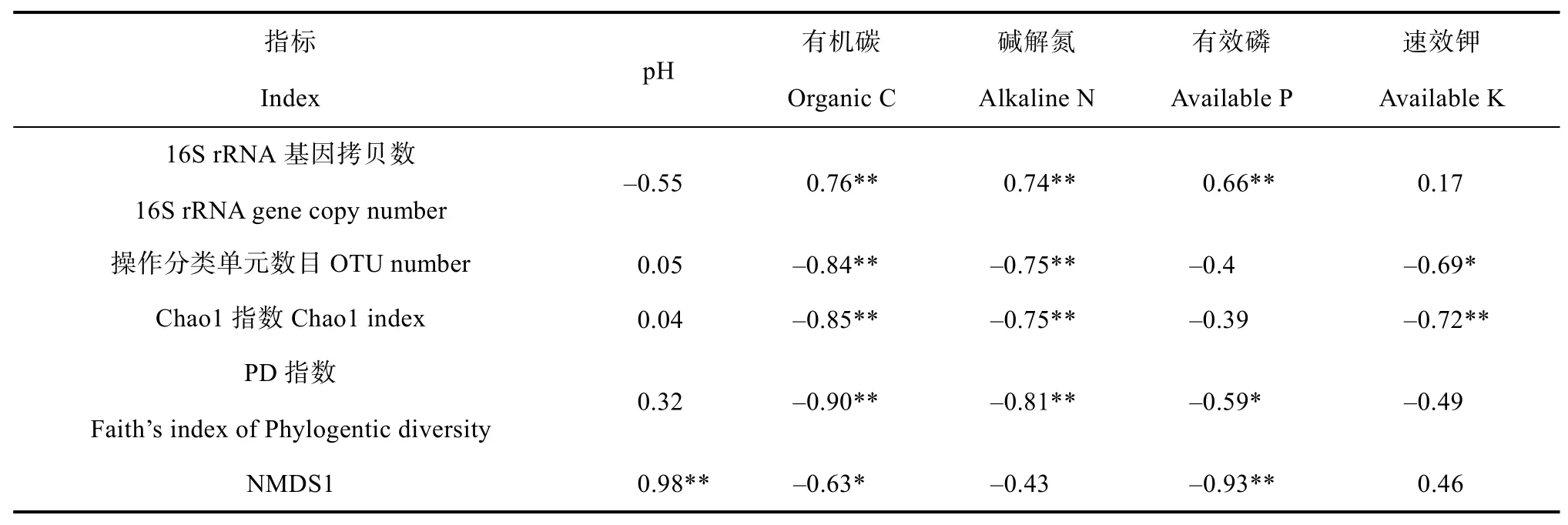
表3 土壤理化性质与细菌丰度、群落多样性及结构的相关性Table 3 Relationships of soil properties with abundance,diversity and structure of the bacterial communities in the four types of paddy soils
目前已知绝大部分的细菌均适宜在中性环境(pH 7.0)中生存,仅少数细菌可以在极酸或极碱的环境下生长[27]。前人研究发现大分子(如DNA,蛋白质)的生物过程受pH影响,pH的变化会引发蛋白质发生构象的改变而导致其生理活性的下降、丧失[28]。本研究中酸性红壤发育的水稻土中的细菌丰富度指数(OTU数目和Chao 1指数)均显著低于下位砂姜土和黑土,但是与中性紫色土发育的水稻土中的细菌丰富度指数无显著差异(表2)。目前,微生物资源调查的研究发现土壤pH能够显著影响细菌的多样性,并发现细菌群落的分布显著受到土壤pH的影响[8,29],土壤养分含量、温度、水分等因素也均能够影响微生物的群落组成、多样性以及分布[3,9-10]。pH的改变会导致土壤营养元素(如磷、钾)有效性的变化[13],重金属离子毒性的变化等[30],这些均有可能会对细菌群落产生显著的影响。由于底物生物可利用性的限制,进一步可能会使得具有特定碳源偏好性的微生物类群大量增殖,从而导致生态系统中群落多样性丢失的风险增加。在酸性土壤中,尤其当土壤pH<5时,无毒的难溶性铝硅酸盐或氧化铝极易转变为交换性铝(主要是Al3+、Al(OH)2+和大量溶出的铝离子会抑制植物根系伸长及其吸收功能[31]。同时有研究发现在酸性条件下,铝离子通过与ATP结合导致菌株细胞生理代谢失活[32]。因此,推测pH降低导致土壤铝活化的毒害作用可能是本研究中酸性红壤发育的水稻土中细菌多样性降低的重要原因之一。
虽然固氮酶只有在厌氧条件下才能催化氮气还原成氨,本研究中水稻土的生物固氮速率随着土壤深度的增加而降低,表层土壤(0~1 cm)生物固氮速率显著高于其他土壤层次(1~2 cm,2~5 cm,5~15 cm)。pH 7.7的中性紫色土和pH 6.1的中性下位砂姜土发育的水稻土表层土壤固氮作用较为活跃,而pH 5.4的酸性黑土和pH 4.9的酸性红壤发育的水稻土表层土壤中的固氮作用则较为微弱。表明在一定的范围内,随着pH的升高,水稻土中的固氮作用也有着明显的增强(r=0.82,P<0.01)。在进一步分析四种水稻土中的细菌优势类群的结果中发现,土壤生物固氮速率和优势类群细鞘丝藻属(Leptolyngbya)呈极显著的正相关关系(P<0.01)(表4),并且土壤pH与优势类群厌氧黏细菌属(Anaeromyxobacter)和细鞘丝藻属(Leptolyngbya)显著相关(P<0.05)(表4)。细鞘丝藻属(Leptolyngbya)隶属于δ-变形菌亚纲,是一类已知具有nifH基因由固氮酶介导能将空气中的氮气还原为植物可利用氨的微生物[33]。对于固氮菌而言,生物固氮是一个高耗能的过程,固氮基因的表达与土壤中有效氮的含量密切相关[34-35]。当环境中有效氮富余的时候,固氮菌存在但是其固氮基因并不一定表达活性。Ma等[36]通过田间15N2气体示踪法结合稳定性同位素核酸探针技术(DNA-stable isotope probing)证实在稻田土壤中细鞘丝藻菌属(Leptolyngbya)是生物固氮最主要的贡献者之一。因此,推测酸性红壤发育的水稻土表层土壤生物固氮作用弱于紫色土的原因可能在于,首先紫色土中性偏碱的土壤pH环境更有利于细鞘丝藻属(Leptolyngbya)大量繁殖,其次红壤中较高的碱解氮含量抑制细鞘丝藻菌属(Leptolyngbya)的固氮活性,可能导致红壤发育的水稻土固氮速率显著低于紫色土。此外在本研究的结果中发现优势类群厌氧黏细菌属(Anaeromyxobacter)与土壤有效磷含量显著正相关(P<0.01)(表4)。已知厌氧黏细菌属(Anaeromyxobacter)是一类典型的呼吸型铁还原菌,具有代谢乙酸盐的特质,在厌氧条件下通过微生物异化Fe(Ⅲ)还原作用,能够有效地竞争电子供体抑制水稻土中依赖乙酸盐的产甲烷过程[37]。因此关于厌氧黏细菌属(Anaeromyxobacter)的铁还原能力与土壤有效磷含量的关系值得进一步深入研究。同时,重视细鞘丝藻属(Leptolyngbya)在水稻土细菌群落中的优势地位,对提升水稻土的生物固氮潜力和制定稻田生物固氮调控措施具有重要参考意义。
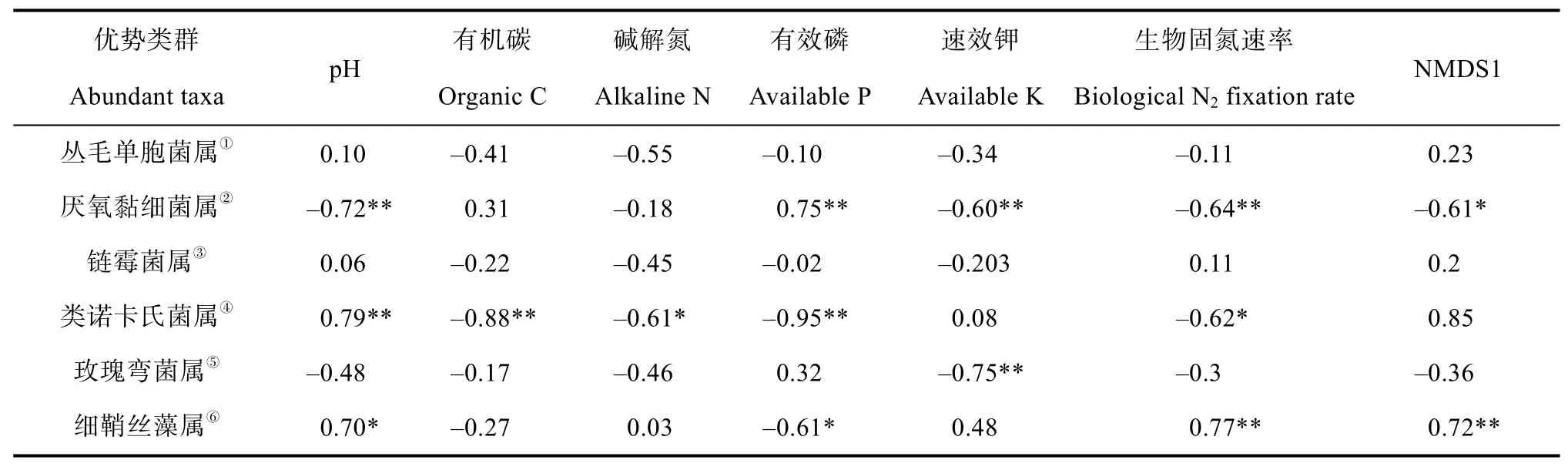
表4 土壤理化性质与优势细菌类群的相关性Table 4 Relationships between the soil properties and dominant bacterial groups in the four types of paddy soils
4 结 论
本研究利用多种分子技术得出不同类型土壤发育的四种水稻土中细菌群落的数量、组成及多样性的分布规律。四种类型土壤发育的水稻土细菌群落优势类群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和蓝藻门(Cyanobacteria)。四种类型土壤发育的水稻土细菌群落结构差异显著。红壤发育的水稻土中细菌丰度最高,群落多样性最低。紫色土发育的水稻土具有最高的土壤生物固氮速率,其中优势类群细鞘丝藻属(Leptolyngbya)是潜在的生物固氮主要贡献者。土壤pH、有机碳和碱解氮含量是显著影响四种类型土壤发育的水稻土细菌群落结构的主要因子。

