有机物料施用对潮土活性有机碳及微生物群落组成的影响*
李慧敏,田胜营,李丹丹,李增强,谭 钧,赵炳梓†
(1. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2. 中国科学院大学,北京 100049;3. 南京林业大学林学院,南京 210037;4. 北京中向利丰科技有限公司,北京 100022)
土壤活性有机碳是土壤中周转速度快,易被土壤微生物利用的有机碳组分,是土壤有机碳的重要组成部分,包括可溶性有机碳(DOC)、易氧化有机碳(ROC)、微生物生物量碳(MBC)、颗粒有机碳(POC)、可矿化有机碳(PCM)等[1-2]。有研究表明土壤活性有机碳与作物产量、土壤大团聚体的形成和稳定有显著正相关关系[3-4],并且能够影响土壤养分的含量及其生物有效性[5]。此外,土壤活性有机碳是土壤微生物的重要碳源及养分来源,能够显著影响土壤微生物的活性及群落组成[6]。Cleveland等[7]研究证明,生态系统中动植物可用性碳底物的增加可能促进微生物群落结构和组成的迅速变化。由于土壤活性有机碳能够快速响应土壤管理措施及环境条件的变化,且与土壤其他性质的变化密切相关,因此被广泛用来表征土壤有机碳的早期变化并作为衡量土壤质量和可持续性的重要指标[6]。
土壤微生物是土壤生态系统的重要组成之一,是推动土壤有机碳和养分转化的主要驱动力[8]。大量研究表明施用有机物料能显著改变微生物群落组成[9-10]。由于不同微生物类群的生理代谢功能不同,微生物群落组成的变化会影响外源有机物料和土壤有机碳的转化,进而可能影响土壤中活性有机碳的组成及其含量[10]。Zhao等[1]发现,相比单独施用无机肥,秸秆还田基础上施用有机无机肥显著增加土壤中闭蓄态碳氮及微生物生物量碳,除了随有机肥添加而增加的碳源能激发微生物生长和刺激微生物活性外,有机肥通过刺激本土微生物生长导致的微生物组成变化同样是造成易利用碳库变化的主要原因。基于13C标记秸秆的盆栽试验,Li等[11]发现革兰氏阴性菌的刺激生长能够促进秸秆分解、增加来自秸秆的微生物生物量碳及来自于秸秆的碳和氮在土壤-作物系统的回收率。因而,猜测不同环境条件下形成的活性有机碳的种类和数量可能与不同微生物群落组成有关。
黄淮海平原是我国重要的粮食生产基地之一,该地区较低的土壤有机碳含量是限制作物产量提高的重要因子之一[12]。合理添加外源有机物料可以显著提升土壤有机碳含量[6],其中,秸秆还田是该地区常用的措施。然而秸秆还田提升土壤有机碳的速度和效率较低[13]。木本泥炭是木本植物残体在低温厌氧的沼泽环境中形成的一种有机物料,具有腐殖酸含量高、比表面积大等优点[9],对于快速提升土壤有机碳含量具有很大的应用潜力[14]。由于本身性质差异,秸秆和木本泥炭施用对土壤活性有机碳的影响可能不同,但尚未有研究对它们进行系统比较,其与微生物群落组成及酶活性的相关关系也不清楚。本研究以黄淮海平原典型潮土为研究对象,比较小麦-玉米轮作条件下,秸秆还田和木本泥炭等碳量连续施用2年对玉米收获后土壤性质影响,其主要目的包括:(1)明确不同有机物料施用对土壤活性有机碳含量、酶活性及基于高通量测序的细菌和真菌群落组成影响;(2)评估活性有机碳含量改变与微生物群落组成变化之间关系。
1 材料与方法
1.1 研究区概况
试验地位于河南省封丘县农田生态系统国家野外科学观测研究站(114°24′E,35°00′N),该地区属于半干旱、半湿润季风气候,年均气温13.9℃,年均降水量615 mm,无霜期约220 d。土壤母质来源于黄河冲积沉积物,土壤类型主要为潮土。种植制度以冬小麦-夏玉米轮作为主。试验前耕层土壤基本性质如下:pH8.15、有机碳 7.77 g·kg-1、全氮1.10 g·kg-1、有效磷7.50 mg·kg-1、速效钾79.00 mg·kg-1。
1.2 试验设计
田间试验于2016年10月13日冬小麦种植季开始,处理包括(1)秸秆移除(CK)、(2)秸秆还田(R)、(3)秸秆移除并施用木本泥炭(MT)、(4)秸秆还田并施用木本泥炭(RMT)。秸秆和木本泥炭的基本性质见表1。每个处理均设3个重复小区,每个小区面积为75 m2(长15 m×5 m)。

表1 物料养分含量信息Table 1 Nutrient contents of the organic materials tested
在小麦季,木本泥炭和秸秆按照等碳量的方式还田,秸秆施用量为7 500 kg·hm-2,木本泥炭施用量为5 422 kg·hm-2(以干物质质量计算)。所有处理的化肥施用量均为施 N 210 kg·hm-2、P2O5105 kg·hm-2,K2O 105 kg·hm-2。氮肥用尿素,磷肥用磷酸二铵,钾肥用硫酸钾,其中60%的氮肥和全部磷钾肥作为基肥施入,40%的氮肥以尿素形式追肥。有机物料和化肥均匀撒在土壤表面然后旋耕使其与土壤混合。在玉米季,四个处理的小麦秸秆均采用就地覆盖还田,后免耕播种。玉米季的化肥施用量与小麦季相同,其中40%的氮肥和全部磷钾肥作为基肥施入,60%的氮肥以尿素的形式追施。小麦品种为矮抗58,玉米品种为登海605。2017至2018年度小麦与玉米的管理方式与上述完全相同。试验用木本泥炭购自北京利丰公司。
1.3 样品采集与测定
2018年玉米收获后,采用随机多点混合取样法采集耕层(0~20 cm)土壤样品。土样过筛后(<2 mm)分成三部分,一部分风干,用于基本性质的测定,一部分鲜样用于速效氮、微生物生物量碳、可溶性碳、颗粒有机碳以及酶活性的测定,另一部分放于-80℃冰箱冷藏保存,用于DNA的提取。
土壤pH、有机碳(SOC)、铵态氮(NH4+-N)、硝态氮(NO3--N)、有效磷(AP)以及速效钾(AK)采用常规的土壤农化分析方法测定[15]。土壤微生物生物量碳(MBC)采取氯仿熏蒸-K2SO4浸提法测定,以熏蒸和未熏蒸土壤的有机碳之差除以转换系数0.45得到[15]。易氧化有机碳(ROC)含量采用高锰酸钾氧化法进行测定[16],颗粒有机碳(POC)含量采用Cambardella和Elliott[17]的方法测定。土壤可溶性有机碳(DOC)含量采用Jones和Willett的方法测定[15]。可矿化有机碳(PCM)含量采用CO2释放法测定[15],共培养60 d,分别在1、2、3、4、5、7、9、12、15、18、21、24、27、30、48和60 d之后更换含有NaOH的玻璃瓶,并用HCl标准溶液进行滴定;PCM含量基于60 d培育结果计算获取,计算公式为:
式中,M为有机碳矿化量,mg·kg-1;V0为空白滴定时消耗标准盐酸的体积,mL;V为样品滴定时消耗标准盐酸的体积,mL;C为标准盐酸的浓度,mol·L-1;12为碳的摩尔质量;m为样品干质量;M1,M2,…,M60分别表示第1,2,…, 60天的有机碳矿化量。
采用比色法测定土壤转化酶(Invertase)、β-D-葡萄糖苷酶(β-D-glucosidase,BDG)、碱性磷酸酶(Alkaline phosphatase,PHO)和N-乙酰-β-氨基葡萄糖苷酶(N-acetyl-β - Glucosaminidase,NAG)的含量[18-19]。
1.4 DNA 提取与高通量测序
采用 Fast®DNA Spin 试剂盒(MP Biomedicals,Santa Ana,CA,美国)从 0.5 g 新鲜土壤中提取每个样本的总 DNA。并使用 Nanodrop™2000 分光光度计(Nanodrop Technologies,Wilmington,DE,USA)测量 DNA 质量(A260/A280 范围为 1.85~1.92)和浓度(112.89~157.71 ng·μL-1)。选取细菌 16S rRNA V4~V5 区进行高通量测序测定。PCR 扩增采用特异性引物 515F( 5′-GTGCCAGCMGCCGCG G-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)。PCR扩增条件包括95 ℃ 3 min,(95℃ 30 s,55 ℃30 s,72 ℃ 40 s),27个循环,之后72 ℃ 10 min。真菌PCR扩增引物对为ITS1F(5′-CTTGGTCATTT AGAGGAAGTAA-3′)/ITS2R(5′-GCTGCGTTCTTC ATCGATGC-3′),PCR扩增条件为95℃ 3 min,(95 ℃ 30 s,53℃ 30 s,72℃ 40 s),37个循环,之后72℃ 10min。反应产物采用QIA quick PCR Purification kit(Qiagen)进行纯化。将不同样品的PCR扩增产物等摩尔混合后,采用Illumina公司MiSeq测序仪完成序列分析(委托上海美吉生物医药科技有限公司测定)。
1.5 数据处理
采用Excel2016和Origin2019软件进行数据处理和绘图;使用SPSS22.0软件进行单因素方差分析,相关性分析采用Spearman双尾检验;平均值多重比较采用LSD法进行显著性检验(P<0.05)。
高通量测序所得序列在QIIME(1.91)软件中采用以下步骤进行分析:(1)采用FLASH软件进行序列双端合并;(2)使用Cutadapt软件切除引物;(3)细菌和真菌序列分别去除短于300 bp和150 bp的低质量序列和嵌合体序列,经过质量控制后,细菌和真菌分别得到132 194和182 794条高质量序列,其中细菌和真菌每个样品序列条数分别为9 832~12 584和10 140~20 957。随后,每个细菌和真菌样品分别随机抽取9 832和10 140条序列进行后续分析,细菌和真菌的覆盖率分别为98.76%~99.23%和99.61%~99.87%;(4)高质量序列采用Uparse软件,以97%相似度进行OTU划分,采用Blast方法以 Greengeens13.8数据库和 UNITE(ver.8.0)数据库分别对细菌和真菌进行注释。利用R包DESeq2进行微生物群落物种丰度差异分析及Origin2019软件绘制差异火山图。
使用典范对应分析(CCA)和冗余分析法(RDA)建立土壤不同形态碳与细菌和真菌群落组成之间的关系,通过DCA去趋势分析结果中Axis Lengths的第一轴的大小,大于4.0选择CCA分析,小于3.0则选择RDA分析。用Vegan包内“ordistep”函数根据置换检验中F统计量的显著性水平(P值)选择最好的解释变量,并采用999次的蒙特卡罗置换检验(Monte Carlo permutation test,999permutatio-ns)进行显著性检验,使用“envfit()”函数检验每个环境因子的显著性。使用R语言软件的vegan包进行排序运算,提取物种和环境变量的排序坐标,采用Origin2019软件进行RDA绘图。
2 结 果
2.1 不同有机物料添加下土壤pH和养分含量变化
表2 表示,不同处理对土壤pH和NO3--N含量无显著影响,但土壤NH+4-N、AP、AK含量则显著变化(P<0.05)。R和RMT处理的NH+4-N含量分别较CK低77.38%和73.47%,AK含量分别较CK低27.21%和23.66%,但MT处理的AP含量则较CK高59.18%。

表2 秸秆和木本泥炭施用对土壤pH和养分含量影响Table 2 Effects of straw and woody peat application on soil pH and nutrient content(n=3)
2.2 不同有机物料添加下土壤活性有机碳变化
不同处理对SOC、PCM、MBC和ROC含量均无显著影响,但显著影响DOC、POC含量(表3)。与CK相比,R和RMT处理的DOC含量分别增加30.33%和31.46%,而MT处理的DOC含量则与CK类似;POC含量显著增加的处理主要发生在MT和RMT处理,分别较CK增加104.9%和64.78%(P<0.05)。
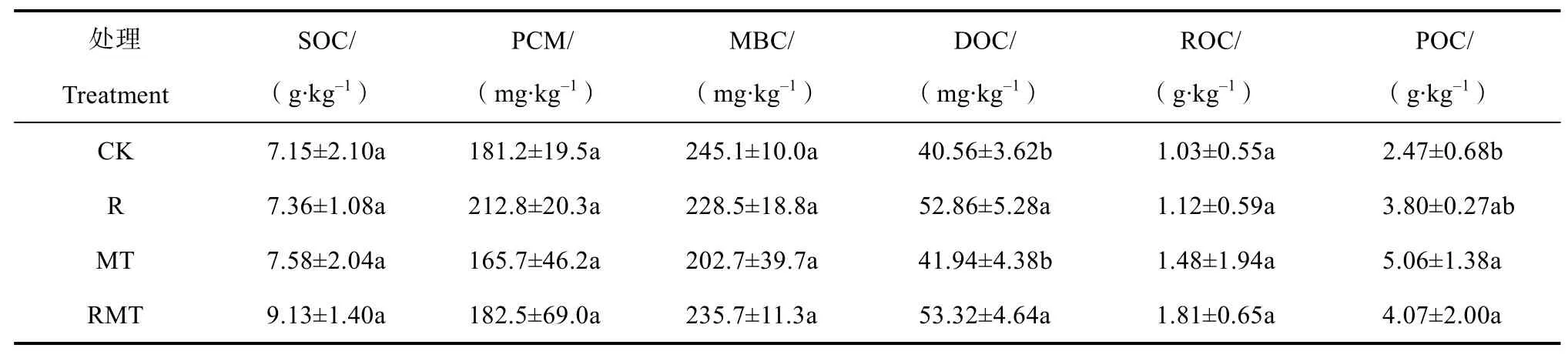
表3 秸秆和木本泥炭施用对土壤有机碳及其活性组成部分影响Table 3 Effects of straw and woody peat application on soil organic carbon and its active components(n=3)
2.3 不同有机物料添加下土壤酶活性变化
表4 表示,四种处理间的β-D-葡萄糖苷酶和β-1,4-n-乙酰氨基葡萄糖酶均无显著差异,但显著影响转化酶和碱性磷酸酶活性。与CK相比,R和RMT处理的转化酶活性分别增加364.69%和485.31%,但其碱性磷酸酶活性则与CK类似,此外,MT处理的碱性磷酸酶活性较CK降低28.15%。

表4 秸秆和木本泥炭施用对土壤酶活性影响Table 4 Effects of straw and woody peat application on soil enzyme activities(n=3)
2.4 有机物料对土壤细菌和真菌群落组成影响
2.4.1 土壤细菌和真菌门水平处理间差异 细菌16S rRNA高通量测序序列经过物种注释后归属于16个门,57个纲,109个目,168个科和215个属(图1A),不同处理的细菌优势菌门均为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes),其相对丰度分别为28.00%、23.90%、19.70%、8.10%、5.10%。上述优势菌门相对丰度在不同处理间几乎没有显著性差异,仅RMT处理的绿弯菌门较 CK处理增加了 25.82%(P<0.05)。
真菌ITS高通量测序序列经过物种注释后归属于12个门、28个纲、49个目、90个科和130个属(图1B)。不同处理的真菌优势菌门均为子囊菌门(Ascomycota)、鞭毛菌门(Mortierellomycota)、担子菌门(Basidiomycota),其相对丰度分别为75.4%、7.0%、4.9%。与CK处理相比,R和MT处理的子囊菌门相对丰度分别提高10.17%和9.34%。RMT处理的鞭毛菌门相对丰度较CK处理提高83.90%。
2.4.2 基于OTU水平的土壤细菌和真菌处理间差异物种分析 以CK处理为对照,基于OTU水平对R、MT和RMT处理进行差异物种分析(图2),结果显示,R和MT处理的细菌群落组成与CK之间没有差异物种,而RMT处理仅显著增加了Aquicellaunidentified丰度(图2A)。
图2 表示,在真菌群落中,与CK相比,R处理共有6个OTU显著增加,7个OTU显著降低(图2B),其中丰度最高的为Trichoderma peltatum和Trichoderma aerugineum;MT处理中,仅一个OTU显著增加,3个OTU显著降低(图2C),包括Basidiobolus ranarum和Cladorrhinum flexuosum;RMT处理中共有10个OTU显著增加,16个OTU显著降低(图2D),其中增加的Chaetothyriales unidentified和Pyrenochaetaunidentified变化最为显著。
2.5 土壤理化性质与细菌和真菌群落组成之间关系
图3 展示了不同土壤理化性质对细菌和真菌群落组成的影响。其中,约束排序CCA(图3A)和RDA(图3B)结果分别展示了细菌和真菌物种分布与土壤理化性质之间的关系。
图3 A表示,细菌的CCA中,限制在2个选定变量的CCA前两个典范轴能够解释全部方差的20.79%,其中第一轴单独解释11.19%。NH+4-N和POC是显著影响土壤细菌群落组成的限制性环境因子(P<0.01)。Anosim分析显示不同处理间的细菌群落组成无显著差异(P>0.05,R=0.188)。
图3 B表示,真菌的RDA分析中,限制在6个选定变量的前两个典范轴能够解释33.31%的方差,其中POC、DOC、NH+4-N是真菌物种分布的主要驱动因素(P<0.05)。R和RMT处理的真菌群落组成与CK和MT处理的真菌群落组成沿RDA1轴分开,DOC、SOC和NH+4-N含量是驱动真菌群落组成沿该轴分开的主要环境因子。而CK和MT处理则进一步沿RDA2轴分开,PCM和POC含量则是驱动真菌群落组成沿RDA2轴分开的主要环境因子。不同处理的真菌群落组成显著不同(P<0.01,R=0.694)。
2.6 活性有机碳含量与酶活性及差异OTU之间的相关性
将活性有机碳含量与酶活性及差异OTU之间进行Spearman相关性分析(表5),结果表示,DOC、POC均与转化酶显著正相关。此外,DOC和转化酶均与Trichoderma peltatum、Trichoderma aerugineum、Pyrenochaeta_unidentified丰度显著正相关;POC和转化酶均与Chaetothyrialesunidentified显著正相关,与Basidiobolus ranarum和Cladorrhinum flexuosum显著负相关。

表5 土壤酶活性与土壤活性有机碳及差异物种间的关系Table 5 Relationships of soil enzyme activity,soil labile organic carbon with different microbial species
3 讨 论
3.1 有机物料施用对土壤基本性质的影响
与CK相比,R和RMT处理显著降低了NH+4-N和AK含量(表2)。前人研究证明,秸秆添加可能通过影响微生物群落结构和胞外酶的活性,导致土壤中N矿化降低,从而降低了NH+4-N含量[20]。罗照霞等[21]研究结果表明,玉米植株氮、磷、钾等吸收量随着产量的增加而增大,本研究显示R和RMT处理较CK相比,籽粒和秸秆产量显著升高(数据未列出),土壤中较多的养分被植株吸收带走,导致土壤中NH+4-N和AK含量降低。此外,MT处理中AP含量显著增加,可能是因为木本泥炭疏松多孔,具有吸附性,使得土壤中的AP被固定,减缓了磷元素的淋失[9]。有趣的是RMT处理的AP含量升高并不显著,这可能与RMT处理中含有秸秆,而秸秆分解过程中需要吸收土壤中的磷素有关[9]。此外,RMT处理籽粒和秸秆产量最高(数据未列出),可能随作物吸收带走了更多的磷从而导致土壤中AP含量降低。
3.2 有机物料施用对土壤活性有机碳的影响
DOC和POC等土壤活性有机碳是反映土壤受干扰程度最灵敏的指标[2]。贺美等[4]研究发现,秸秆还田可提高土壤DOC含量,与本研究结果相同(表3)。秸秆加入土壤后,分解产生大量的水溶性物质,直接增加土壤DOC含量,又通过激发效应促进土壤原有有机质的分解,间接导致DOC含量的升高[22]。秸秆等外源有机物料施入土壤后,一方面为微生物提供了充足的碳源,从而促进微生物的生长和繁殖,而微生物分解的有机物质是活性碳组分的主要来源。另一方面,秸秆腐烂分解过程中,改变了微生物的种群,提高了微生物及相关酶的活性,加快土壤非活性有机碳向活性有机碳的转变,从而导致了DOC含量的升高[6]。
前人研究发现,作物残茬和秸秆等外源有机物料的输入可提高土壤中POC的含量[4,23],与本研究结果中,添加物料的三个处理土壤POC含量增加一致(表3)。研究证明,添加植物残体有利于改善土壤结构,使有机碳进入大团聚体中被保护,促进POC的形成和稳定[24]。此外,土壤中的POC主要来自于未完全分解的植物残体[2],杨军等[25]利用尼龙网袋法发现小麦和玉米秸秆经过6个月的分解后仍然能够残留50%左右,因此R、MT、RMT中升高的POC含量可能是由未完全分解的秸秆和木本泥炭残留造成的。
3.3 有机物料施用对土壤酶活性的影响
土壤中的酶是微生物参与土壤生物地球化学过程的主要媒介,在有机物的分解以及养分循环中起着重要的作用[26]。MT处理的碱性磷酸酶活性显著低于CK、R和RMT处理,这可能与MT处理具有高的速效磷含量有关。Li等[26]研究结果发现,速效磷含量与碱性磷酸酶活性呈显著负相关关系,速效磷含量升高会导致土壤对有机磷转化为无机磷的需求减少,从而抑制了碱性磷酸酶的活性。先前研究表明,秸秆还田可显著提高土壤转化酶活性[27],这与我们的研究结果一致。转化酶是一种广泛存在于土壤中的水解酶,能将蔗糖水解为植物和微生物可利用的葡萄糖和果糖[28],对增加土壤中易溶性物质起着非常重要的作用[27],本研究结果也表明,转化酶活性与DOC和POC含量显著正相关(表5),R和RMT处理中转化酶活性的增加有助于将更多的秸秆成分转化为DOC,从而导致R和RMT处理中DOC含量的显著升高。转化酶的活性与土壤微生物的数量和活动密切相关[28]。
3.4 影响微生物群落组成的土壤理化性质
研究表明,营养底物(有效碳,NH4+-N等)的变化与土壤中细菌和真菌群落的变化密切相关[29-30],与我们的研究结果一致。Zheng等[30]发现,细菌和真菌群落与DOC含量呈现出非常强的相关性,且DOC与细胞外酶显著相关。DOC是微生物不稳定C和能量的主要来源,其组分有10%~40%能够被微生物直接分解利用[5]。Wang等[20]研究结果表明,POC是显著影响微生物群落组成的关键因子之一。POC代表粗大的有机质,能为微生物提供底物[3]。有机物料施入土壤引起的大部分微生物变化都是由碳源可用性的变化引起的[2],DOC和POC作为微生物可用性的碳底物,能为微生物提供足够的养分来源,从而促进微生物的生长和繁殖,影响微生物的组成。
Wang等[29]研究发现,添加对土壤微生物活动和群落组成有显著的影响。对秸秆等凋落物的分解具有刺激作用,添加的N可能通过分解者的竞争作用改变了微生物的组成[31]。一方面作为微生物的氮源,可直接为微生物提供营养,微生物在对氮素的竞争过程中,会发生组成上的变化;另一方面,在氮素限制的土壤中,可为作物提供营养促进其生长,从而刺激微生物的生长和活动,植物与微生物群落之间的竞争以及土壤中的不同作用,也可能对微生物群落组成产生影响[29]。
3.5 土壤活性有机碳与酶活性及微生物群落组成之间关系
Zheng等[30]研究认为,微生物群落通过调节细胞外酶水平来影响土壤中有机物分解过程,而真菌被认为较细菌具有更大的能力来产生分解复杂植物有机物的细胞外酶。且本研究中,不同处理间细菌群落组成没有显著差异(图3A),但真菌群落组成产生了显著的变化(图3B)。因此这里主要讨论真菌群落组成和相关微生物的变化及其与活性有机碳和酶活性之间的关系。对于真菌群落门水平的差异,与CK处理相比,R和MT处理显著提高了子囊菌门丰度,而RMT处理显著提高了鞭毛菌门丰度,真菌的子囊菌门大多数为腐生菌,能够产生纤维素酶,是分解不溶性和顽固底物(如木质素)的重要菌种[32]。因此,在R和MT处理中,子囊菌门显著升高可能与有机物料添加导致的顽固性底物增加有关。有意思的是,RMT处理中子囊菌门的丰度并未显著提高,对真菌门水平相对丰度的相关性分析显示(结果未列出),子囊菌门与鞭毛菌门为显著的负相关关系(P<0.01),因此猜测RMT处理中显著升高的鞭毛菌门,其可能与子囊菌门存在相互竞争或拮抗作用,导致RMT处理中子囊菌门并没有显著升高。
对于OTU水平的真菌物种差异,DOC与Trichoderma peltatum、Trichoderma aerugineum、Pyrenochaetaunidentified三种OTU的丰度以及转化酶的活性显著正相关(表5)。Trichoderma peltatum和Trichoderma aerugineum均属于木霉菌属,张立恒等[33]研究证明,接种木霉菌能够显著提高土壤转化酶的活性。因此我们推测R处理可能通过增加这两种OTU的丰度从而提高土壤转化酶的活性,进而引起土壤活性有机碳的变化。此外,Pyrenochaetaunidentified所属的棘壳孢属具有促进植株生长的作用[34],其在RMT处理中显著升高有利于更多的根系分泌物进入土壤,而根系分泌物主要是由易溶于水的简单有机小分子组成[35],其输入能够直接促进RMT处理中DOC含量的增加。土壤POC含量与Chaetothyriales unidentified 显著正相关,与Basidiobolus ranarum(真菌蛙粪霉属)以及Cladorrhinum flexuosum(粪壳菌目)显著负相关(表5)。Chaetothyriales unidentified是土壤有机质的主要真菌分解类群[36],其在RMT处理中显著增加可能为转化酶提供了足够的碳底物,导致转化酶活性的提高,从而加快有机物料的分解,导致POC含量的增加。此外,蛙粪霉属是分解顽固有机物质的腐生真菌[37],粪壳菌目被认为具有降解腐烂有机质和纤维素的作用[38],二者在MT处理中丰度的降低以及Cladorrhinum flexuosum在RMT中丰度的减低可能会导致残留物分解速度减慢,致使未完全分解残留物即POC在这两个处理土壤中累积。
4 结 论
连续两年在小麦-玉米轮作潮土中施用秸秆和木本泥炭后,土壤POC和DOC等活性有机碳含量发生了改变,且含有秸秆处理(R、RMT)的土壤DOC含量显著升高,而含有木本泥炭处理(MT、RMT)的土壤POC含量显著升高,这与转化酶活性及一些真菌菌种的相对丰度改变有关。秸秆和木本泥炭施用改变了土壤微生物群落组成,从而调节土壤酶活的作用,提高了部分土壤活性有机碳的含量,且真菌在该过程中发挥了更为重要的作用。

