南美蟛蜞菊、蟛蜞菊和杂交蟛蜞菊土壤磷组分特征及其影响因素*
孙 锋,曾令达,彭长连,赵梦欣
(1. 植物病虫害生物学国家重点实验室,北京 100000;2. 华南师范大学生命科学学院,广州 510631;3. 惠州学院生命科学学院,广东惠州 516001)
生物入侵是一个影响深远的全球性生态安全问题,严重威胁生物多样性[1]。我国是遭受生物入侵威胁最为严重的国家之一,阐明外来植物入侵机制是控制其扩张的重要前提。
入侵植物具有耐贫瘠和养分利用效率高等特点[2-3],这使外来植物相对于本地植物在一定的环境中获得相对的竞争优势[4]。近年来,大量的研究工作致力于揭示入侵植物耐土壤贫瘠的机理。例如入侵植物增加土壤氨氧化古菌生物量,加快土壤硝化速率[5];榕果舌(Carpobrotus edulis)通过根系分泌物抑制硝化细菌活性,降低土壤硝化速率,抑制本地植物氮吸收,而自身则可以在低氮水平下正常生长[6],因此,前人大部分研究主要关注入侵植物对氮素的利用机制,很少开展磷的研究[7]。
一项Meta分析发现,入侵植物叶片磷含量显著高于土著植物[8]。因此,磷利用是影响入侵植物快速扩张的重要因素之一。我国华南地区土壤有效磷含量极低,是初级生产力的主要限制因子[9]。但是,华南地区却是外来植物入侵危害最严重的地区之一,以南美蟛蜞菊为代表的入侵植物快速扩张。外来植物为何能成功入侵土壤缺磷的华南地区,土壤磷组分转化过程与驱动机制是什么?
在湿热气候区,土壤微生物增加有机磷分子的吸收,并在细胞中水解,显著影响土壤磷循环[10]。而且,土壤微生物生物量磷通过矿化作用也能转变成速效磷被植物吸收利用,是土壤有效磷的重要部分[11]。最近研究表明,我国亚热带植物通过分解土壤有机磷显著提高土壤有效磷含量[12]。土壤酸性磷酸酶和碱性磷酸酶能水解大量磷酸酯,而且碱性磷酸酶能水解90%以上的有机磷[13]。因此,土壤有机磷分解可能是我国亚热带地区土壤有效磷的重要来源之一。
入侵植物通过改变土壤微生物活性、群落结构和酶活性显著影响土壤物理和化学性质[1]。例如,植物入侵显著增加了土壤固氮菌,进而增加了土壤硝态氮含量[14];入侵植物改变了土壤细菌群落,进而增加了蛋白酶活性和土壤铵态氮含量[15];Han等[16]从入侵植物薇甘菊根际土壤分离的放线菌(Streptomyces rochei)能分泌次生代谢物质溶解钾矿物质,为薇甘菊提供钾养分;最近研究[17]表明入侵植物显著降低了土壤总磷含量,然而,参与磷分解的酶活性并不清楚。
南美蟛蜞菊(Wedelia trilobata(L.)Hitchc.)为菊科蟛蜞菊属多年生草本植物,起源于中南美洲,20世纪70年代作为地被植物引入中国。南美蟛蜞菊生长迅速,已被列为“世界最有害的100种外来入侵种”之一[18]。其同属植物蟛蜞菊(Wedelia chinensis(Osbeck)Merr.)亦为多年生草本植物,匍匐状,自然分布于我国东南部,与南美蟛蜞菊有相同的生活史特征,但生长缓慢[19]。同时,南美蟛蜞菊和蟛蜞菊的自然杂交种也被证实[20]。国内外学者对南美蟛蜞菊入侵机理的研究主要集中在生理生态方面[19-20],但对南美蟛蜞菊能快速活化贫瘠土壤养分的过程与驱动机制未知,这在很大程度上制约了对外来植物入侵机制的深刻理解。
基于此,本研究拟结合土壤酶学和化学计量学,深入解析南美蟛蜞菊土壤磷组分活化过程和驱动机制,为揭示南美蟛蜞菊在土壤缺磷的华南地区成功入侵提供新见解,为控制南美蟛蜞菊扩张提供理论依据。
1 材料与方法
1.1 研究区域概况
研究地点位于广东省惠州野外控制试验地,属于亚热带季风气候区,年平均气温22℃,年降水量2 000 mm,土壤类型为老成土[21]。
1.2 试验设计与取样
试验开始于2016年7月,在弃荒地中设置样方(22°52′N,114°22′E),去除地表植物后,采用完全随机试验设计,包括南美蟛蜞菊、蟛蜞菊、杂交蟛蜞菊三个处理,每个处理5个重复,每个样方大小为2.6 m×2.6 m,样方之间间隔1 m,样方边缘插入15 cm深的聚氯乙烯塑料板,防止三种植物根蔓延生长至另一样方,三种植物以相同密度(25 m-2)种植于样地中,每个处理最初的土壤全磷含量分别为0.55 mg·kg-1、0.53 mg·kg-1、0.56 mg·kg-1,土壤pH为4.21±0.14、4.32±0.21和4.16±0.17。2019年1月(914 d后)采用五点法采取0~10 cm土壤样品混合为1个土壤样品,土钻直径为3 cm。
1.3 土壤样品测定方法
土壤全碳和全氮用元素分析仪(Elementar Vario ELIII,德国)测定;土壤铵态氮和硝态氮采用连续流动分析仪(AA3,Bran+Luebbe,德国)测定;可溶性有机碳和有机氮采用TOC/TN分析仪(Multi N/C® 2100(S),Analytik Jena AG,德国)测定;称取10 g风干土壤置于50 mL离心管中,加入25 mL 0.01 mol·L-1CaCl2溶液,摇匀并静止30 min后测定土壤pH。采用Hedley等[22]连续浸提法测定土壤中不同形态的磷组分,称取0.5 g过100目筛土壤,依次加入阴离子树脂膜、0.5 mol·L-1NaHCO3、0.1 mol·L-1NaOH、1 mol·L-1HCl,提取出土壤中稳定性由弱到强的各级土壤磷素组分,最后用浓硫酸和高氯酸高温消煮测定土壤中的残余磷[22]。主要分为以下磷组分:1)速效磷(resin-Pi、NaHCO3-Pi),即生物最容易吸收利用的无机磷组分;2)铁/铝磷(NaOH-Pi),是与长期磷转化有关的强烈吸附在铝铁化合物上的无机磷磷酸盐;3)钙磷(HCl-Pi),比较难溶性的无机磷组分;4)有机磷(NaHCO3-Po、NaOH-Po),易矿化且对植物有效的有机磷组分;5)残余态磷(residual-P),闭蓄态无机磷,植物难以利用。
采用氯仿熏蒸法测定土壤微生物生物量磷[23]。土壤磷酸酶活性测定的原理是磷酸酶水解对-硝基酚磷酸钠产生对-硝基酚,其生成量与磷酸酶活性在一定范围内呈线性关系;具体为称取1.00 g 新鲜土壤(< 2 mm)于50 mL 离心管中,加0.25 mL甲苯、4.00 mL 通用缓冲剂储备液(酸性磷酸酶用pH 6.5,碱性磷酸酶用pH 11.0)和1.00 mL 用相同缓冲液配制的对-硝基酚磷酸钠溶液,37℃下培养1 h后,加入1.00 mL 氯化钙溶液和1.00 mL 氢氧化钠溶液终止反应,充分混匀后过滤,用紫外分光光度计(UV-2450,日本岛津)在400 nm 处比色[24],结果表示为μg·g-1·h-1(以p-nitrophenol计)。
1.4 数据处理与分析
采用SPSS 19单因素方差分析不同植物处理对土壤理化性质、磷酸酶活性、微生物生物量磷和磷组分含量的影响;采用Origin 8.5软件制图,图和表中数据为平均值±标准误。
2 结 果
2.1 不同植物土壤化学性质差异
不同植物处理间土壤化学性质存在显著差异(表1),其中,南美蟛蜞菊和杂交蟛蜞菊土壤全氮含量显著低于蟛蜞菊,南美蟛蜞菊土壤可溶性有机碳含量显著高于蟛蜞菊,全碳、铵态氮、可溶性有机氮和pH在三个植物处理间无显著差异。

表1 不同植物处理土壤化学性质Table 1 Chemical properties of the soil relative to treatment
2.2 不同植物土壤磷组分差异
南美蟛蜞菊和杂交蟛蜞菊土壤易分解磷和铁/铝磷含量显著高于蟛蜞菊(表2),而有机磷、残余态磷和全磷含量显著低于蟛蜞菊。此外,全碳︰有机磷(C︰OP)在三种植物处理中的范围为271~660,且由高到低依次为南美蟛蜞菊、杂交蟛蜞菊和蟛蜞菊。
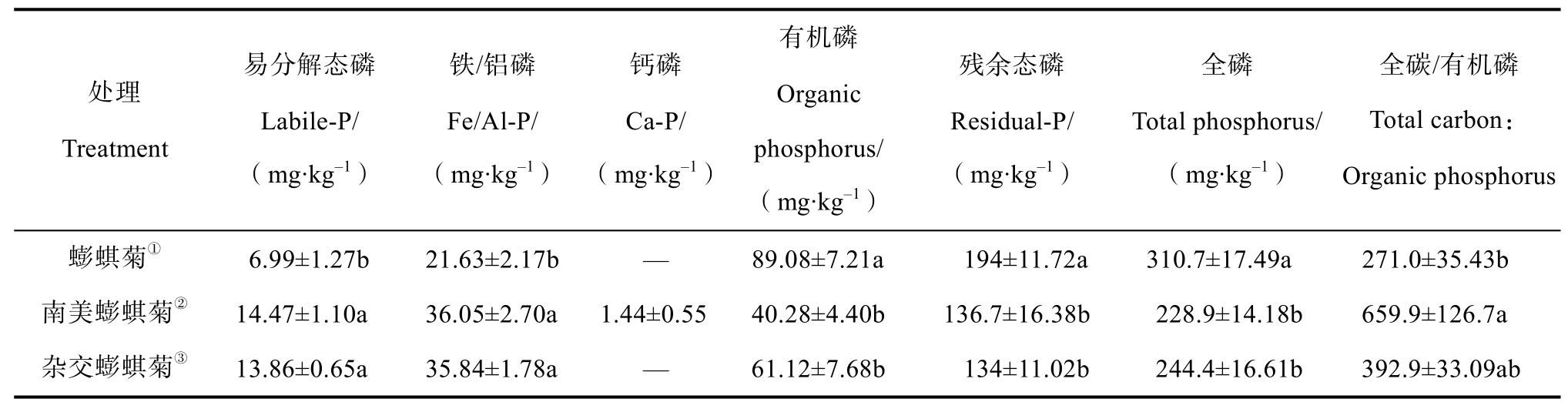
表2 不同植物处理下土壤磷组分Table 2 Phosphorus fractions in the soil relative to treatment
2.3 不同植物土壤微生物生物量磷和磷酸酶活性差异
南美蟛蜞菊和杂交蟛蜞菊处理中土壤微生物生物量磷显著低于蟛蜞菊处理(图1a),蟛蜞菊、南美蟛蜞菊和杂交蟛蜞菊三个处理中微生物生物量磷占全磷的41.2%、14.3%和25.7%。蟛蜞菊、南美蟛蜞菊和杂交蟛蜞菊三个处理中酸性磷酸酶活性无显著差异(图1b),而碱性磷酸酶活性在蟛蜞菊土壤中显著低于南美蟛蜞菊和杂交蟛蜞菊(图1c)。
2.4 土壤磷酸酶活性与磷组分的相关性
相关分析表明:酸性磷酸酶活性与各磷组分和全磷相关性不显著(表3),而碱性磷酸酶活性与易分解磷、铁/铝磷、钙磷显著正相关,与有机磷、残余态磷、全磷显著负相关(表3)。

表3 土壤磷酸酶活性与磷组分间相关系数Table 3 Correlation analysis of soil phosphatase activity and phosphorus fractions
3 讨 论
3.1 不同植物土壤磷组分状况
土壤磷转化的受控因素主要来自三个方面:1)地球化学作用释放钙结合磷,2)有机酸和H+溶解无机磷,3)微生物分解有机磷;此三者的相互作用形成了土壤磷转化过程在入侵植物和土著植物间的差异性格局[25]。本研究中,入侵植物和本地植物土壤磷组分差异显著(表2),南美蟛蜞菊土壤易分解态磷(labile-P)含量最高,蟛蜞菊土壤最低。先前的研究[26]也表明入侵植物Solidago gigantea通过根际酸化作用显著增加了易分解磷组分(resin-Pi,NaHCO3-Pi,NaOH-Pi)。本研究中,南美蟛蜞菊并未显著改变土壤pH,土壤微生物和磷酸酶活性可能是影响磷素矿化的重要因素。由于微生物生物量磷周转速度快,是土壤有效磷库的重要来源之一,其含量在南美蟛蜞菊土壤中最低,可能是微生物生物量磷转化为Labile-P导致的结果,因为较低的微生物生物量磷表明土壤有效磷相对缺乏[12]。表明微生物生物量磷对入侵植物土壤磷循环过程中具有重要意义。尽管化学固定作用对磷素的影响较大,在入侵植物南美蟛蜞菊土壤中难溶性磷(Residual-P)仍有显著降低,进而较易分解的磷组分(Fe/Al-P)也出现不同程度的减少,总磷随之降低。
本研究中全碳与有机磷比大于200,表明土壤受到磷限制[27]。本研究中,土壤有机磷含量占全磷比例为17.6%~28.7%,表明土壤有机磷矿化为无机磷是土壤有效磷的重要部分[12-13]。蟛蜞菊土壤有机磷含量显著高于南美蟛蜞菊和杂交蟛蜞菊,这可能因为入侵植物磷吸收和归还模式与本地植物存在显著差异,进而导致土壤磷平衡的改变和磷组分的变化[28]。
3.2 磷酸酶活性调控土壤有机磷分解
当土壤无机磷缺乏时,会刺激微生物释放各种磷酸酶,包括酸性磷酸酶、碱性磷酸酶、植酸酶和核苷酸酶,酸性磷酸酶和碱性磷酸酶均能水解多种磷酸酯类[13]。先前的研究[29]表明,薇甘菊入侵显著增加了土壤酸性磷酸酶和碱性磷酸酶活性,进而增加了土壤有效磷含量。在本研究中,三种植物处理中土壤酸性磷酸酶活性并无显著差异,而南美蟛蜞菊和杂交蟛蜞菊土壤碱性磷酸酶显著高于蟛蜞菊(图1),因此,碱性磷酸酶在磷转化过程中起着重要作用。酸性磷酸酶主要由植物根和真菌分泌,而碱性磷酸酶主要由细菌分泌[13]。因此,解磷细菌能够分泌碱性磷酸酶作为获取磷的策略之一[30]。
前人研究[13]表明,碱性磷酸酶能矿化土壤90%的有机磷[13]。本研究中,碱性磷酸酶是影响土壤有机磷矿化的主要因子,供应植物所需的有效磷,且与有机磷含量显著负相关,从而降低土壤中有机磷含量(表2)。南美蟛蜞菊和杂交蟛蜞菊所吸收利用的有效磷主要来源于有机磷的矿化。碱性磷酸酶主要由微生物分泌,其活性与微生物活性密切相关,南美蟛蜞菊和杂交蟛蜞菊土壤可溶性有机碳含量高于蟛蜞菊(表1),为微生物提供更多碳源,微生物活性较强[27]。微生物能分泌更多的碱性磷酸酶,促进有机磷的矿化,增加土壤有效磷的含量。这可能是本研究中南美蟛蜞菊和杂交蟛蜞菊驱动土壤有机磷矿化的主要原因。因此,在土壤缺磷的华南地区,碱性磷酸酶促进有机磷的矿化对缓解土壤磷限制具有重要意义[31]。
4 结 论
在亚热带地区土壤高度风化,且不同植物处理中易分解态磷(labile-P)占全磷比例均较少,全碳与有机磷比大于200,表明土壤受到磷限制。但土壤有机磷含量及其占全磷的比例均较高,是土壤有效磷库的重要部分。此外,碱性磷酸酶是影响土壤有机磷矿化的主要因素,与有机磷显著负相关。入侵植物主要通过提高土壤碱性磷酸酶活性来矿化有机磷,从而增加土壤有效磷含量,供植物吸收利用。这可能是该地区入侵植物对磷限制的适应机制。

